Беременность после рака молочной железы
Беременность после рака молочной железы
Многие женщины задаются вопросом, можно ли и когда можно задумываться о планировании беременности после лечения рака молочной железы. Как правило, после завершения лечения беременность безопасна.
Об основных аспектах проблемы говорит хирург Центра Маммологии доктор Искра Даскалова.
В последние годы наметились две параллельные тенденции: с одной стороны, все больше и больше женщин откладывают момент деторождения (раньше первая беременность приходилась на 20-летний возраст, теперь все чаще и чаще на 30-летний), с другой стороны, рак молочной железы «молодеет» (всё чаще встречается среди женщин молодого возраста). Таким образом, нередко к моменту установления диагноза рак груди женщина не успела реализовать свой материнский потенциал. Существуют исследования, показывающие, что 47% женщин в возрасте до менопаузы, у которых был диагностирован рак груди, хотели бы иметь детей после лечения (Letourneau et al., Cancer 2012). Однако в прошлом завести ребенка удавалось только 3-5% таких женщин. Это происходило из-за неопределенности влияния беременности на дальнейший прогноз рака и страха, что это увеличит риск рецидива. Это приводило также и к высокому проценту абортов среди данной категории женщин (до 30% случаев). К счастью, за последние 2-3 года были опубликованы результаты нескольких важных исследований, позволивших развенчать старые предубеждения. Они доказали, что беременность после рака груди онкологически безопасна. Эти новые данные уже меняют нашу ежедневную практику.
По данным крупнейших мета-анализов, включавших 19 000 пациенток с раком груди (1 200 из них с беременностью после лечения), выявлено, что риск смерти на 41% ниже в тех случаях, когда женщина забеременела после лечения в сравнении с теми, когда беременности после лечения не было (Azim HA, Eur J Cancer, 2011). Другое крупное исследование (1 200 пациенток с раком груди, 330 из них – с беременностью после лечения) подтвердило, что беременность после лечения рака груди безопасна безотносительно гормонального статуса опухоли (присутствия или отсутствия гормональных рецепторов в опухоли) (Azim HA, J Clin Oncol, 2013). Поскольку около 15% выявляемых случаев рака груди приходятся на женщин в репродуктивном возрасте, то любой хирург-маммолог или медицинский онколог, должен знать об этих новых результатах и не отговаривать от беременности женщин после прохождения успешного курса терапии раннего рака груди, как это случалось в прошлом.
Важно также отметить, что прежде чем начать лечение, в частности химио- или гормональную терапию, пациентку следует информировать о возможном негативном влиянии такого лечения на способность иметь детей. Тем, кто планирует беременность после окончания лечения, следует предложить консультацию репродуктолога до начала лечения. Соответственно планирование беременности следует обсудить с лечащим врачом во время установления диагноза, на этапе планирования лечения.
Не существует официальных международных протоколов относительно времени планирования беременности после лечения рака груди, но большинство экспертов в этой области рекомендуют срок не ранее 2 лет после установления диагноза, не ранее 6 месяцев после химиотерапии, и не ранее 3 месяцев после гормональной или прицельной терапии. В настоящий момент в Европе проходит исследование (POSITIVE trail), результаты которого будут готовы в следующем году; они ответят на вопрос – безопасно ли временно приостановить гормональную терапию (курс которой длится достаточно долго – как минимум, 5 лет) для того, чтобы родить ребенка, и затем возобновить и завершить полный курс гормональной терапии.
Кормление грудью после рака молочной железы, даже из той, на которой была проведена операция (в случае органосохраняющей операции), тоже возможно, безопасно и должно поощряться.
В подготовке статьи использовались материалы:
Safety of pregnancy following breast cancer diagnosis: a meta-analysis of 14 studies. Azim HA Jr, Santoro L, Pavlidis N, Gelber S, Kroman N, Azim H, Peccatori FA. Eur J Cancer. 2011 Jan;47(1):74-83;
Prognostic impact of pregnancy after breast cancer according to estrogen receptor status: a multicenter retrospective study. Azim HA Jr, Kroman N, Paesmans M, Gelber S, Rotmensz N, Ameye L, De Mattos-Arruda L, Pistilli B, Pinto A, Jensen MB, Cordoba O, de Azambuja E, Goldhirsch A, Piccart MJ, Peccatori FA. J Clin Oncol. 2013 Jan 1;31(1):73-9;
Pregnancy after breast cancer: if you wish, ma'am. Pagani O, Partridge A, Korde L, Badve S, Bartlett J, Albain K, Gelber R, Goldhirsch A; Breast International Group; North American Breast Cancer Group Endocrine Working Group. Breast Cancer Res Treat. 2011 Sep;129 (2):309-17;
Pretreatment fertility counseling and fertility preservation improve quality of life in reproductive age women with cancer. Letourneau JM, Ebbel EE, Katz PP, Katz A, Ai WZ, Chien AJ, Melisko ME, Cedars MI, Rosen MP. Cancer. 2012 Mar 15;118(6):1710-7;
Pregnancy after Breast Cancer: Myths and Facts. Pagani O, Azim H Jr. Breast Care (Basel). 2012 Jun;7(3):210-214;
Pregnancy after breast cancer: population based study. Ives A, Saunders C, Bulsara M, Semmens J. BMJ. 2007 Jan 27;334(7586):194.
Childbearing and survival after breast carcinoma in young women. Mueller BA1, Simon MS, Deapen D, Kamineni A, Malone KE, Daling JR. Cancer. 2003 Sep 15;98(6):1131-40.
Pregnancy after adolescent and adult cancer: a population-based matched cohort study. Stensheim H, Cvancarova M, Møller B, Fosså SD. Int J Cancer. 2011 Sep 1;129(5):1225-36
Birth outcome in women with previously treated breast cancer--a population-based cohort study from Sweden. Dalberg K, Eriksson J, Holmberg L. PLoS Med. 2006 Sep;3(9):e336.
Birth outcome in women with breast cancer. Langagergaard V, Gislum M, Skriver MV, Nørgård B, Lash TL, Rothman KJ, Sørensen HT. Br J Cancer. 2006 Jan 16;94(1):142-6.
Pregnancy occurring during or following adjuvant trastuzumab in patients enrolled in the HERA trial (BIG 01-01). Azim HA Jr, Metzger-Filho O, de Azambuja E, Loibl S, Focant F, Gresko E, Arfi M, Piccart-Gebhart M. Breast Cancer Res Treat. 2012 May;133(1):387-91;
Breastfeeding in breast cancer survivors: pattern, behaviour and effect on breast cancer outcome. Azim HA Jr, Bellettini G, Liptrott SJ, Armeni ME, Dell'Acqua V, Torti F, Di Nubila B, Galimberti V, Peccatori F. Breast. 2010 Dec;19(6):527-31.
Chemotherapy, targeted agents, antiemetics and growth-factors in human milk: how should we counsel cancer patients about breastfeeding? Pistilli B, Bellettini G, Giovannetti E, Codacci-Pisanelli G, Azim HA Jr, Benedetti G, Sarno MA, Peccatori FA. Cancer Treat Rev. 2013 May;39(3):207-11.
www.emcmos.ru
Беременность и рак молочной железы
Беременность после лечения по поводу рака молочной железы
Беременность, наступившая после лечения рака молочной железы, не оказывает дополнительного влияния на выживаемость матери. Более того, среди женщин с раком молочной железы I и II стадии показатели 5-летней выживаемости были лучше у забеременевших после лечения рака, чем у небеременных.
{module директ4}
Женщинам, которые перенесли рак молочной железы, часто рекомендуют избегать беременности в течение 5 лет. Так как большинство фертильных женщин находятся в возрасте 30-35 лет, такая рекомендация практически исключает беременность. Так как беременность не влияет на частоту рецидивов, мотивами для таких рекомендаций могут быть попытка избежать проблем, если лечение рецидива осложнит беременность, или попытка избежать риска сиротства. Если у пары есть сильное желание иметь ребенка, то можно беременеть и раньше, чем через 5 лет после лечения опухоли, особенно если первичная опухоль была маленьких размеров и без широкого распространения.
Эстрогеновые рецепторы и рак молочной железы
В прошлом проводили определение в ткани рака молочной железы мембранных эстрогеновых и прогестероновых рецепторов как предикторов ответа опухоли на гормональную терапию. Также есть данные о том, что позитивные в отношении эстрогеновых рецепторов опухоли имеют более низкий риск ранних рецидивов. Тем не менее у беременных пациенток высокие концентрации прогестерона подавляют синтез эстрогеновых и прогестероновых рецепторов, и в условиях высоких концентраций обоих гормонов значительно преобладают ядерные формы этих рецепторов. Таким образом, опухоли молочной железы, возникшие во время беременности, с точки зрения наличия мембранных рецепторов являются рецептор-негативными. Проведение иммуногистохимических исследований, которые позволяют идентифицировать и ядерные рецепторы, дает более широкие возможности для диагностики.
Лечение рака молочной железы во время беременности
Как только установлен диагноз, пациентка без промедления должна подвергнуться хирургическому лечению. Принимая во внимание частое поражение лимфоузлов, должна выполняться модифицированная радикальная мастэктомия, которая позволяет адекватно оценить состояние всех регионарных лимфоузлов. Лучше избегать обычной мастэктомии с последующим облучением подмышечной области. Прерывание беременности по медицинским показаниям обычно не показано. Если на основе изучения послеоперационного материала имеются строгие показания для дополнительной химиотерапии, необходимо принять решение: прерывание беременности, или стимуляция преждевременных родов, или отсроченная химиотерапия в третьем триместре беременности. Так как отсрочка в лечении является наиболее принципиальным известным фактором ухудшения прогноза рака молочной железы во время беременности, роды должны быть стимулированы в наиболее ранние сроки, возможные для хорошей выживаемости плода — в 32-34 недели. Многие цитотоксические препараты, используемые для химиотерапии рака молочной железы, противопоказаны во время беременности. На определенные области можно проводить облучения, однако доза может оказать отрицательное влияние на плод.
www.sweli.ru
Беременность на фоне рака молочной железы

Рак молочной железы и беременность относится к одному из самых болезненных вопросов онкологии. Ведь, с одной стороны, такое явление должно быть невозможным в связи с тем, что беременность относится к одним из самых главных мероприятий по профилактике онкологических процессов в молочных железах. Но с другой стороны, данные статистики и научной литературы говорят о том, что случаи рака груди при ожидании ребенка – вполне реальное явление, вносящее огромные трудности на пути к выздоровлению и рождению здорового малыша. Самые тонкие вопросы этой темы освещены в рамках данной статьи.
Насколько это возможно
Рак молочной железы, возникший в период беременности или лактации, а также беременность, возникшая на фоне анамнеза, отягощенного раком груди, называют раком молочной железы, ассоциированным с беременностью (РМЖАБ). Согласно общепринятым данным о заболеваемости злокачественными опухолями молочных желез не более, чем 0,03% беременных (один случай на 3000 беременностей) сталкиваются с этой проблемой. В структуре рака груди РМЖАБ составляет от 0,28% до 3,8%. Научно установлено и доказано, что беременность после рака груди способна, как повышать риск его возникновения или рецидива, так и снижать. Поэтому никаких критериев и гарантий, что рак и беременность не разовьются одновременно и утяжелят течение друг друга нет.
Важно помнить! Данное состояние дает мощный гормональный всплеск в организме. И хотя молочные железы в это время находятся в состоянии относительного функционального покоя, они подвержены влиянию прогестерона и других гормонов. Возникшие в это время, или гормончуствительные опухоли в анамнезе на таком фоне могут ускорить либо возобновить свой рост. К счастью, это случается редко!
Вероятность возникновения РМЖАБ зависит от возраста и предшествующих родов у женщины:
- Беременность и роды в возрастном промежутке более 30 лет характеризуются повышением риска возникновения опухолей груди в 2-3 раза. После 40 летнего рубежа такой риск повышается в 4-5 раз.
- Увеличение количества родов снижает риск развития рака, но не ликвидирует его вообще.
- Даже у женщин до 30-40 лет с несколькими родами в анамнезе возможно возникновение РМЖАБ, если они являются носителями генных мутаций (по генам BRCA1 и BRCA2) в клетках молочных желез. Вероятность повышается с каждой последующей беременностью.
- Настороженность должна быть выше у женщин с отягощенным наследственным анамнезом по раку (наличие заболевания у ближайших кровных родственников).
- Послеродовый период, не сопровождающийся лактацией и грудным вскармливанием, повышает риск возникновения рака почти в два раза. Продолжительная и неоднократная лактация снижает риск возникновения рака в последующем.
Возникновение рака груди во время беременности
 Если случается так, что во время беременности или лактации у женщины обнаруживается раковая опухоль груди, важно понимать, что скорее всего, начало его развития заложено до зачатия. Ведь подобные опухоли растут в течении нескольких месяцев или год.
Если случается так, что во время беременности или лактации у женщины обнаруживается раковая опухоль груди, важно понимать, что скорее всего, начало его развития заложено до зачатия. Ведь подобные опухоли растут в течении нескольких месяцев или год.
Естественно, что на этапе планирования семьи и всевозможных осмотров, которые должны были обнаружить явные проблемы, определить опухоль не возможно. То время, когда образовалась первая раковая клетка до ее разрастания в виде опухолевого узла, доступного визуальной или инструментальной диагностике, стало периодом мнимого благополучия, во время которого и произошло зачатие. Возникает настоящая проблема, как совместить рак молочной железы и беременность, особенно если она желанная или на поздних соках развития.
Важно помнить! Нет ни одного сведения, что рак груди, даже на 4 стадии, сопровождающийся распространенными метастазами, оказывает вредное влияние на плод. Основные опасности для него связаны с необходимостью использования агрессивных методов лечения, которые способны спровоцировать развитие тяжелых пороков развития или даже внутриутробную гибель!
В этом отношении целесообразно рассматривать такие варианты:
- Прерывание беременности по медицинским показаниям. Однозначная целесообразность данного мероприятия прослеживается при обнаружении раковых опухолей любой стадии при сочетании с беременностью в сроке до 12 недель.
- Пролонгирование с последующими родами. Целесообразно во втором и третьем триместрах беременности в таких вариантах.
Раки первой второй стадии подлежат раннему удалению хирургическим путем. Объем операции зависит от типа опухоли и состояния лимфатических узлов. От операции отказываться не стоит, поскольку она не несет непосредственной угрозы жизни ребенка и дает возможность будущей матери избавиться от болезни.
Раки 3 и 4 стадии. В независимости от срока беременности подлежат хирургическому лечению в объеме расширенной радикальной операции с удалением всей молочной железы и лимфатических узлов. Это даст возможность остановить распространение опухоли, выносить и родить после онкологии здорового ребенка. Роды в таких случаях вызывают искусственным путем или выполняют кесарево сечение после 36-37 недель. В раннем послеродовом периоде или даже на последних неделях беременности назначается гормональная и химиотерапия по общей программе.
Беременность после рака молочной железы
Если женщины с раком молочной железы в анамнезе, прошедшие радикальное лечение планируют беременность, они должны помнить:
- недопустимо планировать беременность, имея раковую опухоль, не пройдя соответствующего лечения;
- зачатие должно планироваться не ранее, чем через 6 месяцев после окончания лечения;
- беременность способна, как ликвидировать вероятность рецидива рака навсегда, так и вызывать его на разных сроках своего течения;
- чем больше времени прошло с момента окончания лечения предшествующего рака до момента планирования беременности, тем выше вероятность нормального ее течения и здорового материнства. Безопасный период составляет около пяти лет;
Важно помнить! Планирование беременности и родов у женщин, имеющих отношение к раку должно строится на реальном желании и потребности конкретной женщины в этом. Но при этом недопустимо руководствоваться только своими чувствами. Мнение специалистов, индивидуальный подход и реальная оценка перспектив должны стать теми звеньями, которые максимально улучшат исходы рака и беременности, как для матери, так и плода!
♦ Рубрика: Лечение и диагностика.www.nashagrud.ru
Беременность и рак молочной железы
В современной литературе рак молочной жележы (РМЖ), возникший на фоне беременности, лактации либо в течение первого года после завершения беременности, обозначают термином «РМЖ, ассоциированный с беременностью».
СИНОНИМЫ
Carcinoma mamma.КОД ПО МКБ-10C50 Злокачественное новообразование молочной железы.В зависимости от анатомической локализации опухоли заболеванию присваивают статистический шифр.· C50.0 Соска и ареолы.· C50.1 Центральной части молочной железы.· C50.2 Верхневнутреннего квадранта молочной железы.· C50.3 Нижневнутреннего квадранта молочной железы.· C50.4 Верхненаружного квадранта молочной железы.· C50.5 Нижненаружного квадранта молочной железы.
· C50.6 Подмышечной задней части молочной железы.
ЭПИДЕМИОЛОГИЯ
Ежегодно в мире выявляют более 1 млн новых случаев РМЖ, прогнозируя рост числа заболевших к 2010 г. до 1,5 млн.
В России РМЖ занимает первое место по частоте среди всех злокачественных новообразований у женщин. Ежегодно регистрируют более 46 тыс. новых случаев РМЖ. Примерно 1 из 10 женщин на протяжении жизни заболевает РМЖ.
Смертность равна половине заболеваемости РМЖ. В 2002 г. в России от РМЖ умерли 22,1 тыс. женщин, что составило 16,7% среди злокачественных новообразований. Среди всех злокачественных новообразований, выявляемых при беременности, РМЖ занимает второе место по частоте после РШМ. На 3000 беременностей приходится 1 случай РМЖ. Около 3% всех наблюдений РМЖ диагностируют во время беременности. До 7,3% женщин моложе 45 лет, страдающих этим заболеванием, — беременные или кормящие.
КЛАССИФИКАЦИЯ
Классификация РМЖ, ассоциированного с беременностью, не отличается от таковой у небеременных и основана на клинических проявлениях заболевания. В её основу положены восемь признаков: анатомическая локализация и размер опухоли, объём метастатического поражения лимфатических узлов, наличие отдалённых метастазов, стадия развития опухоли (как вариант комбинации её размера и объёма метастатического поражения), а также клеточный тип, гистопатологический уровень дифференцировки и тип экспрессируемых рецепторов клеток опухоли.
Клиническая классификация первичной опухоли и регионарных лимфатических узлов (Международный противораковый союз, 6-е издание. Перевод и редакция проф. Н.Н. Блинова).
Оценка размеров первичной опухоли (T):·T0 — нет признаков первичной опухоли;·TX — оценка первичной опухоли невозможна;·Tis — карцинома in situ; внутрипротоковая карцинома, дольковая карцинома in situ или поражение соска (болезнь Педжета);·T1 — опухоль 2 cм или менее в наибольшем измерении;·T1mic — микроинвазия; опухоль 0,1 см или менее 1 см в наибольшем измерении;·T1а — опухоль более 0,1 см, но менее 0,5 см в наибольшем измерении;·T1b — опухоль более 0,5 см, но менее 1 см в наибольшем измерении;·T1c — опухоль более 1 см, но менее 2 см в наибольшем измерении;·T2 — опухоль более 2 см, но менее 5 см в наибольшем измерении;·T3 — опухоль более 5 см в наибольшем измерении;·T4 — опухоль любого размера, прорастающая грудную стенку и кожу;·T4а — прорастание грудной стенки;·T4b — отёк (включая симптом «лимонной» корки) или изъязвление кожи молочной железы;·T4с — сочетание T4а и T4b;
·T4d — воспалительный РМЖ.
Поражение регионарных лимфатических узлов (N): NX (если лимфатические узлы нельзя исследовать по какойлибо причине), N0 (регионарные лимфатические узлы не пальпируются), N1 (метастазы в ипсилатеральные подмышечные лимфатические узлы, при этом последние подвижны), N2 (метастазы в ипсилатеральные подмышечные лимфатические узлы, которые неподвижно фиксированы друг с другом или с окружающими тканями), N3 (метастазы в надключичные и подключичные лимфатические узлы на стороне поражения, метастазы в окологрудинные лимфатические узлы на стороне поражения).
Отдалённые метастазы (М): MX (наличие отдалённых метастазов оценить невозможно), M0 (отсутствие метастазов), М1 (есть отдалённые метастазы; уточнение их локализации в конкретном органе — лёгком, костях, печени, мозге и т.д.).
Стадии РМЖ:· 0 (ТisN0M0);· I (Т1N0M0);· IIA (T1N1M0,T2N0M0);· IIB (T2N1M0,T3N0M0);· IIIA (T1N2M0,T2N2M0,T3N1M0,T3N2M0);· IIIB (T4N0M0,T4N1M0,T4N2M0);· IIIC (любая Т N3M0);
· IV (любая Т любая N M1).
ЭТИОЛОГИЯ (ПРИЧИНЫ) РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
На заболеваемость РМЖ оказывает влияние ряд факторов.
· Факторы риска развития РМЖ, связанные с репродуктивной функцией.- Раннее менархе, поздняя менопауза.- Нерегулярный менструальный цикл.- Отсутствие беременностей и родов (риск рака снижается на 7% с каждыми родами).
- Поздняя первая беременность и поздние первые роды. У женщин, имевших поздние первые роды (в возрасте старше 30 лет) или не имевших родов вообще, риск заболеть РМЖ в 2–3 раза выше, чем у родивших до 20 лет.
Каждые последующие роды в возрасте до 30 лет сопровождаются дальнейшим снижением риска развития РМЖ. Риск возникновения РМЖ в возрасте до 40 лет в 5,3 раза выше у женщин, родивших в возрасте старше 30 лет по сравнению с родившими до 20 лет.
- Продолжительность лактации менее 1 мес. Отсутствие лактации сопровождается увеличением риска возникновения РМЖ в 1,5 раза. Прослеживается обратная зависимость между общей длительностью лактаций и риском развития РМЖ.
· Наследственные факторы. В 5–10% наблюдений РМЖ связан с мутацией генов BRCA1 и BRCA2, что объясняет семейные случаи заболевания. Риск развития РМЖ у женщин-носителей мутантных генов чрезвычайно высок и составляет 80–95% на протяжении всей жизни. Рожавшие женщиныносители данных мутаций существенно чаще (в 1,71 раза) заболевают РМЖ в возрасте до 40 лет, чем нерожавшие. Ранний возраст первых родов в этой группе не снижает риск развития рака.
·Факторы риска, связанные с заболеваниями молочных желёз и других органов.- Наличие пролиферативной формы фиброзно-кистозной болезни и различных доброкачественных опухолей молочных желёз (риск возникновения рака увеличивается в 2,3 раза).
- Травмы молочной железы, неоперированные лактационные маститы.
· Генитальные факторы риска.- Рак эндометрия, рак яичников повышают риск развития РМЖ в 2 раза.- Некомпенсированное влияние эстрогенов также повышает риск РМЖ. Для женщин, у которых естественная менопауза наступила в возрасте до 45 лет, риск развития РМЖ снижается вдвое по сравнению с теми, у кого менструации продолжаются после 54 лет. Показано достоверное снижение риска возникновения рака у женщин с хирургической кастрацией до 40 лет на 47% по сравнению с группой женщин с естественной менопаузой в 45–54 года, причём наименьшее число опухолей обнаружено при искусственной менопаузе до 35 лет.
- Приём синтетических прогестинов повышают риск развития РМЖ.
· Факторы внешней среды.- Факторы риска внешней среды и питания (курение, алкоголь, избыточный вес).
- Ионизирующая радиация. В качестве фактора риска имеет наибольшую опасность в возрасте до 30 лет (в период от пременархе до 18 лет). Это одна из причин предпочтительного использования УЗИ, а не рентгенологического метода исследования молочных желёз у молодых женщин.
Этиологические факторы, влияющие на возникновение РМЖ на фоне сущест-вующей беременности, предположительно, не отличаются от таковых в группе небеременных пациенток.
ПАТОГЕНЕЗ
Регуляция нормального функционирования молочной железы происходит под влиянием комплексного взаимодействия между различными гормонами.
Гормональное влияние на развитие РМЖ хорошо известно. Эстрогены и прогестерон могут выполнять роль стимуляторов роста опухоли во время беременности, если злокачественная трансформация уже произошла. Это осуществляется в результате индукции синтеза факторов роста, которые стимулируют пролиферацию эпителиальных клеток молочной железы и тормозят апоптоз (транскрипция фактора роста эндотелия сосудов индуцируется эстрогенами, что может привести к патологической неоваскуляризации); стимуляции клеточного роста за счёт отрицательной обратной связи, согласно которой эстрогены нивелируют эффекты ингибирующих факторов роста.
Известен эффект эстрогенов, вызывающих ускорение роста числа микрометастазов, — стимуляция так называемых спящих метастазов. Прогестерон также поддерживает циклическую пролиферацию молочных желёз в течение беременности, стимулируя рост эпителия. В зависимости от продолжительности воздействия прогестерон может потенциально видоизменять ответ как нормальных, так и раковых клеток молочной железы на различных уровнях.
КЛИНИЧЕСКАЯ КАРТИНА (СИМПТОМЫ) РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Гипертрофия, набухание молочных желёз, изменение консистенции, усиленная васкуляризация, а также ряд возможных осложнений (мастит, галактоцеле) затрудняют осмотр и маскируют развивающуюся опухоль во время беременности и лактации.
Наиболее характерной жалобой у 95% больных бывает определение болезненных неоформленных опухолевидных масс в ткани молочной железы, часто сопровождающихся дискомфортом в области соска (болезненность, покалывание, отёчность); изменение состояния всей молочной железы в виде асимметричного набухания и уплотнения; одностороннее увеличение лимфатических узлов. Втяжение соска, наличие кожных симптомов (например, «симптом площадки»), как правило, не отмечают.
ДИАГНОСТИКА РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ БЕРЕМЕННОСТИ
АНАМНЕЗ
Нередко в анамнезе у заболевших раком на фоне беременности есть пролиферативная форма фиброзно-кистозной болезни, а также различные доброкачественные опухоли молочных желёз. В 45–50% случаев пациентки, ранее имевшие беременность, перенесли лечение по поводу лактационного мастита. Нередко пациентки отмечают случаи РМЖ в своей семье. При сборе анамнеза женщины указывают на длительный период наблюдения опухоли. В 82% случаев пациентки самостоятельно выявляют опухоль в I триместре. Треть заболевших на фоне беременности при первом выявлении опухоли не обращаются за врачебной помощью, а при подозрении на злокачественный процесс в 25% случаев отказываются от диагностических мероприятий. С момента появления первых симптомов доустановления диагноза врачом у беременной женщины проходит гораздо больше времени, чем в обычной ситуации (15 и 4 мес соответственно). Поздняя диагностика РМЖ в период беременности приводит к отсрочке начала лечения в среднем на 2–3,5 мес. Установлено, что 1 мес задержки в лечении увеличивает риск метастазирования в подмышечные лимфатические узлы на 0,9%, а задержка в лечении на 6 мес — на 5,1%. По этой причине к моменту установления правильного диагноза заболевание нередко находится в неоперабельной стадии.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
Физиологическая гипертрофия (средний вес молочных желёз, равный приблизительно 200 г, удваивается во время беременности до 400 г), изменение консистенции, отёк, усиленная васкуляризация затрудняют осмотр. Стандартное пальпаторное исследование малоэффективно и в большинстве случаев, особенно на поздних сроках гестации, не позволяет дифференцировать опухоль.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Клинический и биохимический анализы крови больных с РМЖ, ассоциированном с беременностью, не отличаются от таковых у здоровых беременных. Изменение биохимических показателей крови, косвенно указывающих на возможное метастазирование РМЖ в кости или в печень, при беременности не характерно. Так, активность ЩФ при беременности физиологически может увеличиваться от 2 до 4 раз; АЛТ, АСТ, лактатдегидрогеназа обычно находятся на уровне, соответствующем сроку беременности. Уровень половых гормонов и пролактина у больных с РМЖ также соответствует срокам беременности.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Рентгенологическое исследование (маммография) ассоциируется с негативным влиянием на плод. Тем не менее, при адекватном экранировании и защите плода в ряде случаев этот метод диагностики можно проводить. Так, рентгенография в передней и боковой проекции воздействует на плод в дозе только 0,4–0,5 мрад (0,004–0,005 Гр) при доказанной повреждающей дозе, равной 0,05–0,1 Гр. Однако маммография при беременности существенного диагностического значения не имеет и в 25% случаев даёт ложноотрицательную картину — тень опухоли сливается с гипертрофированной железистой тканью (рис. 50-1, см. цв. вклейку). Если удалось визуализировать участок уплотнения (симптом затемнения) в двух проекциях, можно говорить об объёмном процессе. Высокоинтенсивное затемнение неправильной формы, нечёткость контура, наличие микрокальцинатов не позволяют исключить злокачественный процесс. Однако в большинстве случаев чётко определить размеры и структуру опухоли весьма затруднительно.

Рис. 50-1. Рентгенограмма молочной железы в прямой проекции. Рак молочной железы. Беременность 24 нед.
Опухоль чётко не определяется.
УЗИ (ультрасонография) — метод, наиболее рекомендуемый для диагностики рака у беременных и кормящих женщин. С помощью стандартного УЗИ возможно выполнить цветовую и энергетическую допплерографию, количественную оценку скорости кровотока в визуализируемых сосудах. В 97% случаев метод УЗИ позволяет провести дифференциальную диагностику кистозных образований с солидными (рис. 50-2, см. цв. вклейку). При сонографии РМЖ представляет собой гипоэхогенное образование (тёмносерые оттенки на экране), неправильной формы без чётких контуров, неоднородной структуры, с гиперваскуляризацией
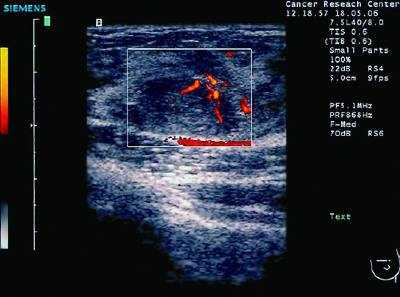
Рис. 50-2. Сонограмма молочной железы. Пациентка, 23 года. Беременность 11 нед. Фиброаденома.
МРТ можно применять во время беременности, так как данный метод не несёт радиоактивного компонента. Тем не менее, контрастный препарат гадобутрол не рекомендуется использовать при беременности за исключением случаев крайней необходимости. В настоящее время в России МРТ молочных желёз исследуют и используют в диагностике случаев, неоднозначно интерпретируемых при маммографии и УЗИ. Оценка количественной характеристики динамического накопления контрастного вещества (интенсивное), а также качественные характеристики выявленного патологического процесса (нечёткие, тяжистые контуры) позволяют дифференцировать злокачественный процесс.
Цитологическое и гистологическое исследования пунктатов и биоптатов молочной железы — наиболее достоверные методы диагностики. Результат цитологического исследования у беременных во многом зависит от опыта работы цитолога с аналогичными случаями.
Эксцизионную биопсию, выполняемую под местной анестезией, считают «золотым стандартом» при любой неясной патологии в молочной железе. При завершённой беременности для снижения риска развития лактационного свища рекомендуют прекратить лактацию приблизительно за неделю до проведения манипуляции (каберголин). После выполнения биопсии назначают холодовое воздействие на молочные железы и их тугое бинтование. Техника «Cor- биопсии» образований в молочной железе высокоспецифична и высокочувствительна (рис. 50-3, см. цв. вклейку)
Морфологу, выполняющему исследование удалённого препарата, необходимо сообщить о наличии беременности у пациентки. «Сor-биопсия» позволяет не только получить достаточное количество материала для верификации диагноза, но и выполнить целый набор иммуногистохимических исследований для определения прогноза и тактики лечения пациентки (рецепторный статус опухоли, экспрессия гена Her2-neu, Ki-67 и т.д.). РМЖ у беременных имеет то же гистологическое строение, что и в группе небеременных. От 70 до 90% опухолей соответствует инфильтративному протоковому РМЖ. У беременных чаще наблюдают опухоль больших размеров с выраженным внутрипротоковым компонентом, метастатически изменённые регионарные лимфатические узлы, распространение раковых эмболов по лимфатическим щелям. Как правило у беременных, больных РМЖ, определяют эстроген и прогестеронотрицательные опухоли.
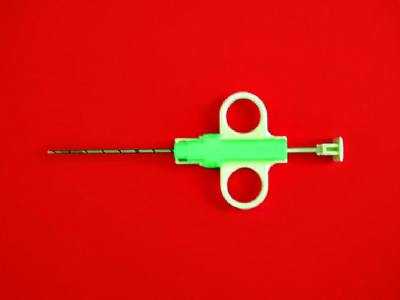
Рис.50-3. Аппарат-игла для проведения «Cor-биопсии».
Выявление отдаленных метастазов в печени без риска для плода может быть произведено с помощью УЗИ и МРТ.
Радиоизотопное исследование костей скелета для выявления метастазов выполняют чрезвычайно редко, поскольку данный метод исследования несёт 0,00194 Гр лучевой нагрузки на плод.
СКРИНИНГ
Программа скрининга подразумевает маммографическое и физикальное исследования, а также самообследование женщиной молочных желёз. У беременных наиболее рациональными, доступными и информативными методами скрининга считают самообследование молочных желёз и УЗИ. Схема ультразвукового скрининга при беременности, регламентированная приказом №457 МЗ РФ «О совершенствовании пренатальной диагностики в профилактике наследственных и врождённых заболеваний у детей» включает три обязательных исследования в 10–14, 20–24 и 32– 34 нед беременности, позволяющие своевременно диагностировать ВПР. Считают рациональным одномоментно выполнять и контрольные УЗИ молочных желёз.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику РМЖ у беременных и кормящих женщин следует проводить с маститом, фиброаденомой, листовидной опухолью молочной железы, галактоцеле, липомой, лимфомой, гамартомой, саркомой, туберкулёзом. Постановка диагноза «лактационный мастит» при наличии злокачественной опухоли в молочной железе — типичная ошибка в клинической практике. Кроме совпадения сроков проявления истинного лактационного мастита и РМЖ не редкостью бывает и совпадение клинической картины (рис. 50-4, 50-5, см. цв. вклейку).
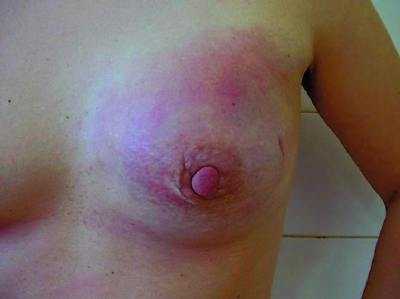
Рис. 50-4. Пациентка, 21 год. Беременность 16 нед. Рак молочной железы (отёчно-инфильтративная форма).
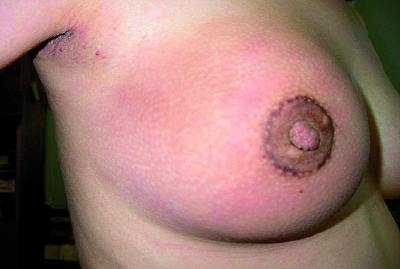
Рис. 50-5. Пациентка, 25 лет. Беременность 24 нед. Мастит.
В последние годы всё чаще наблюдают стёртые формы воспалительных поражений молочной железы, характеризующиеся, если не полным отсутствием, то, по крайней мере, слабой выраженностью типичных клинических проявлений. Так, гнойный мастит может протекать с нормальной или субфебрильной температурой, без озноба, без выраженных изменений картины крови, при вялой воспалительной реакции. В клинике возрастает число случаев необоснованного и неадекватного применения лечебных физиотерапевтических процедур, которые стимулируют диссеминацию злокачественного процесса и приводят к быстрой инвазии в окружающие ткани, образуя так называемые острые, или диффузно-инфильтративные, формы рака.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При обнаружении опухоли и при её цитологической верификации необходимо коллегиальное обсуждение полученных диагностических данных с участием онколога и акушера. В крупных медицинских центрах на этапе постановки диагноза возможно привлечение медицинского генетика.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
В диагнозе указывают локализацию опухоли (правая/левая молочная железа) и соответствие стадии по классификации ТNM. Необходимо указать наличие беременности и срок гестации в неделях.
Рак правой молочной железы T2N0M0 (IIА стадия). Беременность 23–24 нед.
ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ПРИ БЕРЕМЕННОСТИ
ЦЕЛИ ЛЕЧЕНИЯ
Целью лечения больного с онкологическим заболеванием считают не только достижение максимально выраженного клинического эффекта, но и увеличение продолжительности и улучшение качества жизни. Определение лечебной тактики зависит прежде всего от стадии заболевания, а не от срока беременности. В том случае, когда больная отказывается от медицинской помощи и приоритетом для неё и её семьи представляется защита плода, лечение откладывают до момента родов. Как правило, прогноз у больных, выбравших этот вариант, крайне неблагоприятен.
Второй вариант подразумевает немедленное завершение беременности и проведение лечения в объёме, адекватном стадии опухолевого процесса. Дальнейшее лечение не отличается от такового у небеременных.
Третий вариант, который всё чаще применяют в мировой практике последние 20 лет — проведение лечения без прерывания беременности. При этом можно проводить как оперативные вмешательства, так и лекарственную терапию.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Лечение РМЖ подразумевает комплексный подход, включающий оперативное вмешательство, лекарственное лечение и лучевую терапию. Несмотря на то что лучевую терапию достаточно часто применяют в обычной онкологической практике, для беременных она противопоказана. Тератогенные свойства лучевой терапии, а также угроза развития онкологической патологии у ребёнка, в том числе лейкоза, заставляют воздерживаться от её применения на протяжении всей беременности. При проведении стандартного курса в суммарной дозе, равной 5000 рад (50 Гр), плод получает лучевую нагрузку в пределах от 3,9–15 рад (0,039–0,15 Гр) в I триместре и 200 рад (2 Гр) — к концу беременности. Пороговой повреждающей дозой для плода в I и II триместрах беременности считают 10 рад (0,1 Гр). Доза от 10–15 рад приводит к дефектам развития, нарушениям ЦНС, доза 50–200 рад — к задержке развития, а доза от 100–250 рад — к уродствам.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Спорными вопросами бывают безопасность и возможные побочные эффекты противоопухолевых препаратов в период беременности. Наибольший риск развития уродств у плода возникает при проведении химиотерапии в I триместре беременности — частота ВПР составляет 10–20%, возрастает частота спонтанных абортов.
Химиотерапия, проводимая во II и III триместрах беременности, также может приводить к преждевременным родам и таким осложнениям, как миелосупрессия у матери и плода, кровотечение и инфекционные заболевания, задержка роста, малая масса тела плода, рождение его мёртвым. Отдалённые результаты проведения химиотерапии во время беременности неизвестны. Решение о проведении химиотерапии возможно лишь после разъяснительной беседы с беременной и её семьёй.
В случае полной информированности больной о всех возможных осложнениях и при решении немедленно начать лечение, сохранив плод, во II и III триместрах беременности возможно назначение неоадъювантной полихимиотерапии (доксорубицин, циклофосфамид).
На современном этапе нет отдалённых данных о судьбе и здоровье детей, родившихся у женщин, подвергшихся специфическому лекарственному лечению.
Одним из наиболее действенных методов терапии РМЖ считают гормональное лечение. Однако антиэстрогенное средство тамоксифен оказывает тератогенное действие и противопоказан при беременности.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Оперативное лечение считают основным методом при РМЖ. На начальных стадиях заболевания возможно выполнение оперативного вмешательства в качестве первого этапа лечения. Радикальная мастэктомия или органосохраняющая операция, а также сопровождающее анестезиологическое пособие, не опасны для плода и, как правило, не приводят к самопроизвольному аборту. Радикальная маст-эктомия с сохранением обеих грудных мышц — наиболее рациональный хирургический объём при начальных (I, II) стадиях РМЖ в I триместре, когда больная хочет сохранить беременность. Больные, перенёсшие мастэктомию, не нуждаются в лучевой терапии. Органосохраняющие операции при сохранении беременности нежелательны, так как требуют дополнительной лучевой терапии, а её можно проводить только после завершения беременности. Необходимость выполнения аксиллярной диссекции во всех случаях определяется высокой частотой метастазов в регионарные лимфатические узлы.
При отказе больной от полного удаления молочной железы, при начальных сроках беременности органосохраняющая операция может быть дополнена полихимиотерапией, начиная со II триместра, и лучевой терапией после раннего родоразрешения.
Если диагноз поставлен в конце II триместра или позже, вариантом выбора считают радикальную резекцию с последующей дистанционной лучевой терапией после завершения беременности.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Метод лечения у больных РМЖ, ассоциированным с беременностью, определяют индивидуально с учётом срока беременности и данных о распространённости опухоли предпочтительно консилиумом с привлечением хирурга, акушера, химиотерапевта, радиолога, психолога.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация в онкологический стационар показана в случае согласия больной на тот или иной вид лечения. При госпитализации необходимо заключение акушера о сроке беременности, объективная инструментальная оценка жизнеспособности плода, наличия или отсутствия его патологии. Акушер предоставляет заключение о противопоказании к тому или иному виду планируемого лечения.
ОЦЕНКА ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ
Оценка эффективности лечения. Лечебный эффект от неоадъювантной химиотерапии определяется на основании сравнения размеров опухоли до лечения и после, наличия отека, гиперемии. Если контроль осуществляется на фоне существующей беременности, необходимо подобрать безопасные для плода методы. После окончания лечения контрольное исследование, включающее, осмотр, маммографию, рентген легких, УЗИ органов брюшной полости, радиоизотопное исследование костей, проводится через 6 месяцев. Последующее обследование — через 1 год.
ВЫБОР СРОКА И МЕТОДА РОДОРАЗРЕШЕНИЯ
При местнораспространённом РМЖ (стадии IIIA, IIIB, IIIC), при отёчноинфильтративных формах рака и при IV стадии рака, если необходимо проведение химиотерапии и больная согласна на прерывание беременности, в качестве первого этапа лечения рекомендуют прерывание беременности, причём на любом сроке (с 22–27 недель — «очень ранние» преждевременные роды). При постановке диагноза в III триместре и при решении пролонгировать беременность возможны ранние преждевременные роды в сроке 34 недель.
ПРОФИЛАКТИКА РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Профилактика основана на программах формирования здорового образа жизни и устранении факторов риска развития рака. Помимо повышения информированности женщин репродуктивного возраста о возможной злокачественной патологии молочных желёз на фоне беременности необходимо внедрять методы самообследования, а главное — инструментальное исследование молочных желёз в рамках прегравидарной подготовки. Основные профилактические меры должны быть направлены на выявление болезни на максимально ранних сроках.
Необходимо включить УЗИ молочных желёз в план наблюдения беременной либо на этапе планирования, либо в I триместре беременности.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТКИ
Необходимо информировать женщин о том, что опухолевые клетки не метастазируют в ткани плода; женщина, болеющая раком, должна прекратить лактацию, что связано с необходимостью немедленно начать лечение и принимать различные лекарственные препараты. Ошибочно предположение, что будущий ребёнок женского пола непременно заболеет РМЖ, если у болеющей матери обнаружены мутации генов BRCA1 и BRCA2.
Следует объяснить, что последующая беременность не ухудшает прогноз у больных с ранней стадией РМЖ. Вопрос о беременности после проведённого лечения при сохранённой репродуктивной функции следует решать с осторожностью. Необходимо учитывать стадию заболевания, наличие или отсутствие неблагоприятных факторов прогноза. Минимальным интервалом от момента завершения лечения до планирования последующей беременности считают интервал 2–3 года.
После окончания лечения женщина должна находиться под длительным наблюдением онколога. Срок первого контрольного осмотра — через 6 мес от момента проведения лечения. Затем рекомендована явка через год.
ПРОГНОЗ
При сравнении в рамках одинаковых стадий и возрастных групп выживаемость беременных, больных РМЖ, ассоциированным с беременностью, не отличается от таковой в группе небеременных. Тем не менее, РМЖ, ассоциированный с беременностью, имеет худший прогноз, чем в целом РМЖ, что обусловлено большей распространённостью болезни на момент постановки диагноза.
Примерные сроки нетрудоспособности
Ориентировочные сроки временной нетрудоспособности при злокачественных новообразованиях молочной железы (класс II по МКБ-10) I стадии составляют 50–75 дней, II–III стадии — 80–115 дней. Вопрос об установлении инвалидности решают после завершения оплачиваемого отпуска по беременности и родам.
www.medsecret.net