Гипофункция яичников что такое
Характерные симптомы, причины происхождения и пути лечения гипофункции яичников
Skip to content
Нарушение нормальной физиологической продуктивности женских органов происходит в силу различных причин. Изменение гормонального фона со снижением или увеличение эстрогенов влечет за собой раннее старение женского организма или задержку полового созревания, сопровождающуюся аменореей.
Распространенность такой патологии среди прекрасной половины человечества ничтожно мала: среди молодых девушек гипофункция яичников может встречаться в 0,1% случаев, у женщин бальзаковского возраста нарушение составляет 1% всех гинекологических заболеваний. Склонных к аменорее женщин такой сбой продуктивности яичников поражает в 10 раз больше, чем абсолютно здоровых.
Несмотря на то, что такой диагноз в народе не считают заболеванием, все же тотальное нарушение гормонального фона, сопутствующее яичниковой недостаточности, влияет на организм женщины целиком. Изменения эндокринных, иммунных и обменных процессов обязательно вызывает у прекрасной половины человечества снижение общего физического здоровья с неврологическими сбоями.
Этиология происхождения заболевания
Однозначных и строго определенных причин возникновения яичниковой недостаточности назвать невозможно. Множество провокаций, вызывающих такую патологию, как первичная гипофункция яичников, создают несколько самых распространенных пунктов:
- Наследственная предрасположенность.
- Гормональные изменения в период эмбрионального развития.
- Перенесенные инфекции и вирусные заболевания в период беременности.
Вторичная, может развиться вследствие таких причин:
- Несбалансированность питания и недостаточная насыщенность его витаминами и минералами.
- Различные методы облучения, имеющие воздействие на организм вследствие лечения онкологических заболеваний.
- Излишнее злоупотребление диетами, приводящее к истощению организма.
- Регулярные и сильные расстройства нервной системы.
- Нарушение достаточного кровообращения головного мозга, приводящее к сбоям в работе гипоталамо – гипофизарной системы, участвующей в формировании деятельности яичников.
- Наличие в анамнезе эндокринных заболеваний: сахарный диабет, ожирение, Базедова болезнь и прочее.
- Последствия неправильного применения механической внутриматочной контрацепции – спирали.
- Искусственное прерывание беременности.
- Оставшиеся воспалительные процессы женских половых органов.
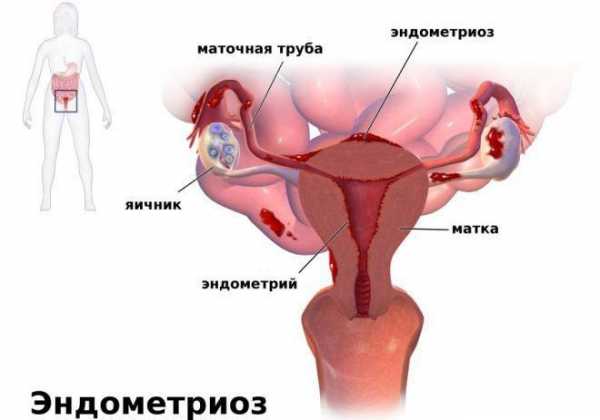
Классификация яичниковой недостаточности
Отличительные характеристики признаков такой патологии, проявляются в строгом соответствии с видовой классификацией заболевания. Существует два основных типа яичниковой недостаточности:
- Первичные изменения, имеющие врожденную этиологию
- Вторичная патология, имеющая отношение к приобретенному заболеванию вследствие нарушения обмена веществ или гормонального дисбаланса.
Также признаки недостаточности зависят и от степени запущенности болезни. Гипофункция яичников делится на три основных степени:
- Легкая стадия характеризуется недостаточным развитием матки, эндометрия. В симптоматике легкого проявления болезни присутствует гипоплазия и медленное развитие молочной железы, нарушение менструального цикла по типу нерегулярности и частых задержек.
- Средней степени яичниковой недостаточности предшествуют визуально ощутимые признаки недоразвития женской груди и гениталий, а также отсутствие месячных и редким «оволосением» паховой зоны.
- Тяжелая форма патологии выражена в явном отсутствии молочных желез, видимой атрофической гипопластикой влагалища и матки. Недостаток «оволосения» в подмышечной и паховой области сводится до критического минимума.

Даже при нормальных показателях величины и размеров матки, ее недоразвитие может проявляться в патологическом изменении эндометрия.
Симптоматика болезни
Проявления недостаточной функции яичников могут быть разделены на три основные группы:
- Физиологические признаки, возникшие вследствие врожденных патологий или приобретенных после травм и нарушения гормонального баланса.
- Сбои в регулярности менструального цикла по типу скудности выделений или их полном отсутствии.
- Постоянная угроза выкидыша во время беременности, а также бесплодие в силу недоразвития физиологических особенностей женских половых органов.
Остальные симптомы проявления зависят от сопутствующего заболевания, вызвавшего яичниковую недостаточность. Это могут быть:
- Выделения молозива из соска женской груди.
- Аменорея.
- Изменение размеров матки, с атрофией эндометрия.
- Нарушение стабильности психоэмоционального фона.
- Нестабильность кровяного давления, перебои в работе сердца.
- Общая симптоматика болезней: слабость, утомляемость, неработоспособность.
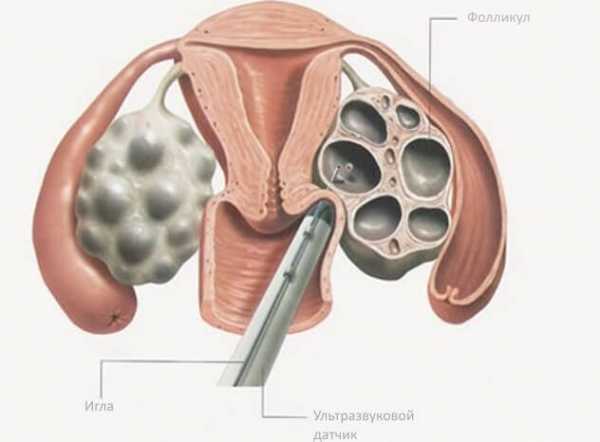
Прежде чем выставить диагноз «гипофункция яичников», гинекологи учитывают данные о нормальных показателях антропометрических данных, проводят визуальный и пальпаторный осмотр половых органов на предмет соотношения их с возрастной нормой. После посещения гинеколога обычно назначается ультразвуковое исследование гениталий, матки и придатков, а также лабораторная диагностика гормонального фона организма. В более тяжелых стадиях проявления болезни возможны и дополнительные обследования.

Лечебные мероприятия
Лечения яичниковой недостаточности является довольно сложным процессом, состоящим из нескольких этапов. Особенно если гипофункция яичников имеет первичное врожденное происхождение.
- Первоначальным шагом к лечению является максимальная стимуляция физиологических резервов организма для полноценного развития половых органов. С этой целью изучают анамнез жизни пациентки и устраняют возможные провокационные факторы, способствующие развитию болезни: от смены вредных профессиональных условий до излечения хронических и инфекционных заболеваний. Помимо сбалансированности питания, нормализации психоневрологического фона и распределения физических нагрузок, проводят физиотерапевтические мероприятия и активную терапию.
- Второй этап лечения содержит продолжение работы по активации выработки гормонов в организме с целью достижения нормальных размеров и расположения половых органов, соответственно возрасту пациентки. Популярными медикаментами в этот период лечения являются прогестерон или прегнин, этинилэстрадиол. Причем курсы лечения состоят из 2-3 месяцев с повторным приемом препаратов через такую же временную продолжительность перерыва. Конечная цель такой активной гормонотерапии заключена в активации репродуктивной функции половых органов.
- Третий и четвертый этапы лечебных мероприятий направлены на восстановление продуктивности матки и предупреждение возможных рецидивов. Объектами этих пунктов лечения являются все женщины с яичниковой недостаточностью, независимо от происхождения болезни: врожденная или приобретенная. Стабилизация овуляционной деятельности женского организма – главная задача третьего этапа. Обычным способом достижения результата в этот период является прием таких препаратов, как кломифен, по строго определенной схеме, установленной доктором индивидуально в каждом отдельном случае.
После успешного излечивания недостаточной работы яичников, происходит учет–диспансеризация таких пациенток с целью систематического наблюдения за ними. Это необходимо для своевременной коррекции лечебных мероприятий при первых признаках возможного рецидива болезни. Такой диспансерный учет является пожизненным, потому как нарушение гормонального баланса в организме может возникнуть в любой момент. Именно эта провокация оказывается самой популярной при повторных появлениях болезни.
Конечно, гипофункция яичников лечится тяжелее в зрелом возрасте, когда женщина уже достигла 35-летия. Но при терпеливом и ответственном подходе к приему назначенного лечения избавиться от болезни можно в любом возрасте.
Важно знать! ×aginekolog.ru
Первичная гипофункция яичников
Первичная гипофункция яичников называется иначе преждевременным климаксом, преждевременной недостаточностью яичников или, чаще всего, синдромом истощенных яичников. Данная патология характеризуется комплексом симптомов, которые проявляются у женщин до 40 лет, не имевших до этого менструальной и генеративной дисфункции.
Характерными признаками первичной гипофункции яичников являются:
- прекращение менструаций (аменорея);
- невозможность зачатия;
- приливы жара;
- усиленное потоотделение.
Механизм развития
Факторы, влияющие на возникновение синдрома истощенных яичников, носят средовой или генетический характер. Развитию заболевания у большинства пациенток могут предшествовать неблагоприятные факторы в процессе внутриутробного развития (экстрагенитальная патология или токсикоз беременности у матери) либо большого количества инфекционных заболеваний, перенесенных в пубертатном возрасте. О том, что первичная гипофункция яичников имеет генетическую этиологию, говорит и тот факт, что практически половина женщин, страдающих синдромом, имеют родственниц, у которых есть нарушения менструального цикла и раннее наступление менопаузы (около 40 лет). Уровень полового хроматина составляет 14-25%.Раннее истощение яичников может быть вызвано генными мутациями и нарушениями функционирования иммунной системы, и, в итоге, разрушением герминативных клеток яичников.
Симптомы гипофункции яичников
Проявлениями развития данного заболевания являются прекращение менструаций либо их нерегулярность и скудные объемы в течение от полугода до трех лет. Через 1-2 месяца после прекращения месячных появляется общая слабость, головные боли, боли в области сердца и приливы жара. Синдром истощенных яичников не нарушает жировой обмен, почти все больные имеют нормальное телосложение и развитие молочных желез.
Диагностика
Диагноз устанавливают на основании жалоб пациенток детородного возраста, заключающихся во внезапном прекращении менструаций, повышенном потоотделении и приливах жара, бесплодии.
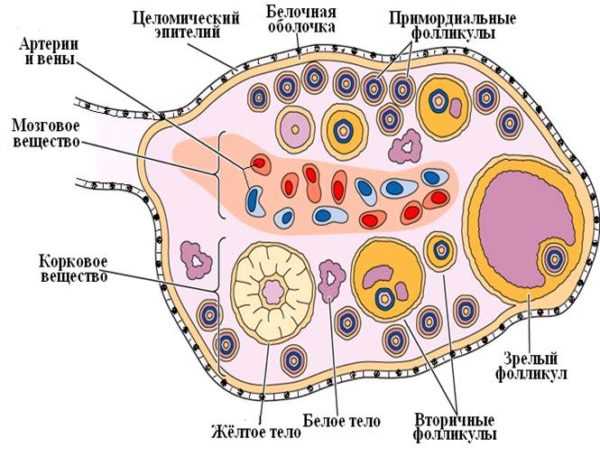
Гинекологическое обследование выявляет резкую гипоплазию матки и отрицательный симптом «зрачка». При ультразвуковом исследовании – уменьшение размеров матки и яичников. При лапароскопии обнаруживается сморщенность яичников, отсутствие желтых тел, фолликулы не просвечивают. Гистологический анализ биоптатов яичников выявляет отсутствие фолликулов.
Гормональное обследование выявляет низкий показатель эстрогенов, увеличение содержания фолликулостимулирующего гормона. Неполноценность эстрогенной стимуляции эндометрия обуславливает отрицательную прогестероновую пробу. Пробы с кломифеном, менопаузальным или хорионическим гонадотропином человека не приводят к активации функции яичников. Рентгенологическое исследование определяет отсутствие патологий турецкого седла и черепа.
Лечение первичной гипофункции яичников
Лечение данной патологии требует терпения, так как происходит довольно длительное время и заключается, в первую очередь, в заместительной гормональной терапии.
В течение трех недель назначается курс этинилэстрадиола, после чего делается недельный перерыв. Менструация обычно наступает после первого курса приема данного препарата. После проведения 2-3 курсов рекомендован переход на монофазные комбинированные препараты с эстрогенами/гестагенами (нон-овлон, ригевидон, марвелон, демулен и т.д.), в результате чего улучшается общее самочувствие, уменьшается потливость и исчезают приливы жара.
В современной практике чаще всего рекомендуется использование эстрадиола валерата (вместо микрофоллина). Схема приема эстрофема, прогинова или комбинированных препаратов – эстрадиола валерата в комбинации с гестагеном - заключается в непрерывном курсе, 1 таблетка в сутки.
Существует несколько комбинированных препаратов, основным компонентом которых является эстрадиол валерат:
- клиогест или трисеквенс (его комбинация с норэтистероном),
- цикло-прогинова (комбинация с норгестрелом),
- климонорм (комбинация с левоноргестрелом).
Хорошие результаты дает терапия эстрогенами, увеличивающими количество рецепторов гонадотропинов в яичниках и поэтапный прием гестагенов и кломифена в комбинации с хорионическим гонадотропином.
Первичная гипофункция яичников и беременность
Синдром истощенных яичников, или первичная гипофункция, является частой причиной гормонального бесплодия. Однако своевременное эффективное лечение позволяет нормализовать репродуктивную функцию и обеспечивает возможность зачатия в естественном цикле. Лечение данной патологии должно заключаться не только в гормональной заместительной терапии, но и в нормализации образа жизни. Пациентка должна соблюдать определенный режим труда и отдыха, иметь достаточный уровень физической активности, рационально питаться. Благоприятные условия, общее здоровье организма благотворно сказываются на функции репродуктивной системы. Женщины с первичной гипофункцией яичников при беременности должны с ранних сроков постоянно наблюдаться у специалиста, поскольку относятся к группе риска невынашивания.
Автор Комарницкая А.И.
klinika23.ru
Первичная гипофункция яичников
04 Августа в 11:21 2012
Синдром истощенных яичников (СИЯ). К первично-овариальной гипофункции яичников относят так называемый синдром истощенных яичников. Для характеристики этого патологического состояния предложено много терминов: «преждевременный климакс», «преждевременная менопауза», «преждевременная недостаточность яичников» и др. По мнению В. П. Сметник, термин «синдром истощенных яичников» наиболее приемлем, так как указывает на яичниковый генез заболевания и необратимость процесса. СИЯ — это комплекс патологических симптомов (аменорея, бесплодие, «приливы» жара к голове, повышенная потливость и т. д.). Является довольно редким заболеванием, точно его частота пока не установлена. Возникает у женщин моложе 37-38 лет, имевших в прошлом нормальную менструальную и генеративную функции. Установлено, что в возникновении этого заболевания играет роль множество факторов, причем как средовых, так и наследственных. Более чем у 80 % больных выявлено действие неблагоприятных факторов еще в период внутриутробного развития, в пре- и пубертатном периодах: токсикозы беременности и экстрагенитальная патология у матери, высокий инфекционный индекс в детстве. Анализ генеалогических данных показал, что в 46 % случаев родственницы I и II степени родства имели нарушения менструальной функции и сравнительно часто ранний климакс (38-42 года). Видимо, на фоне неполноценного генома любые экзогенные воздействия (инфекции, интоксикации, стрессы и пр.) могут способствовать атрезии фолликулярного аппарата яичников. Половой хроматин колеблется от 14 до 25 %. У большинства больных выявляется нормальный женский кариотип 46/XX, редко обнаруживается мозаичный набор хромосом. Одной из причин раннего истощения функции яичников могут быть генные мутации, наследующиеся или возникшие de novo. Не исключается возможность аутоиммунных нарушений. В конечном счете патогенез заболевания связан с пре- и постпубертатной деструкцией герминативных клеток яичников. Для СИЯ характерны гипопластичные яичники. Они небольших размеров (1,5— 2x0,5x1-1,5 см), массой не более 1-2 г каждый. Такие яичники правильно сформированы, в них четко различается корковый или мозговой слои, но число примордиальных фолликулов в первом слое резко уменьшено. Этих фолликулов обычно хватает на 5—15 лет репродуктивной жизни. Имеющиеся примордиальные фолликулы подвергаются нормальному росту и развитию. Они достигают стадии зрелого граафова пузырька и овулируют с формированием большей частью полноценных желтых, а затем и белых тел. Фолликулы, не достигшие стадии зрелых граафовых пузырьков, подвергаются, как и в физиологических условиях, кистозной, а затем и фиброзной атрезии. К периоду завершения репродуктивной функции яичников в них обнаруживается стерильная кора с атрофической межуточной тканью, поскольку судьбы ее клеток и фолликулов связаны. Исчезновение последних сопровождается и резким уменьшением числа клеток в межуточной ткани. Как правило, menarche у больных с СИЯ наступает своевременно, менструальная и генеративная функции не нарушаются в течение 12-20 лет. Заболевание начинается либо с аменореи, либо с олигоопсоменореи, продолжающейся от 6 мес до 3 лет. Через 1 -2 мес после прекращения менструаций появляются «приливы» жара к голове, затем присоединяются слабость, головные боли, быстрая утомляемость, боли в сердце, снижается работоспособность. Нарушения жирового обмена, как правило, не наблюдается. Все больные с СИЯ правильного телосложения. Антропометрия выявляет женский фенотип. Гипоплазии молочных желез не наблюдаются. При гинекологическом осмотре выявляют резкую гипоплазию матки, снижение эстрогенной реакции слизистых оболочек, отсутствие симптома «зрачка». При изучении функции яичников выявляется ее резкое снижение: симптом «зрачка» всегда отрицательный, кольпоцитологическое исследование (КИ) в пределах 0-10 %, в исследовании слизи (ИС) присутствуют базальные и парабазальные клетки вагинального эпителия. Ректальная температура монофазная. При пневмопельвиграфии или ультразвуковом сканировании выявляются резко уменьшенные в размерах матка и яичники. Эти данные можно подтвердить и с помощью лапароскопии, при которой обнаруживаются маленькие морщинистые яичники желтоватого цвета, желтые тела отсутствуют, фолликулы не просвечивают. При гистологическом исследовании биоптатов яичников фолликулы не обнаруживаются. Гормональное исследование показывает низкий (обычно ниже, чем в раннюю фолликулярную фазу) уровень эстрогенов. При определении гонадотропных гормонов отмечено заметное повышение ФСГ, содержание которого в 3 раза превышает овуляторный и в 15 раз базальный уровень этого гормона у здоровых женщин того же возраста. Содержание ЛГ у больных с СИЯ приближается к уровню его в период овуляторного пика и в 4 раза выше уровня базальной секреции лютеинизирующего гормона. Уровень пролактина снижен в 2 раза по сравнению с его содержанием у здоровых женщин. Прогестероновая проба у всех больных отрицательна, что отражает недостаточную эстрогенную стимуляцию эндометрия. На фоне проведения эстроген-гестагенной пробы у всех больных отмечается улучшение самочувствия и появление менструальноподобной реакции через 3-5 дней после ее окончания. Эти данные свидетельствуют о выраженной гипофункции яичников и сохранении чувствительности и функциональной активности эндометрия.Проба с кломифеном (по 100 мг в течение 5 дней) не приводит к стимуляции функции яичников. При введении МЧГ (менопаузного человеческого гонадотропина) или ХГ (хорионического гонадотропина) активация также не наблюдается.
Для выяснения резервных возможностей гипоталамо-гипофизарной системы проводится проба с ЛГ-РГ (100 мкг в/в). При введении ЛГ-РГ отмечается увеличение исходно повышенных уровней ФСГ и ЛГ, что указывает на сохранение резервных возможностей гипоталамо-гипофизарной системы при СИЯ. В течение изучения характера электрической активности мозга у больных с СИЯ отмечается редукция сс-ритма. У некоторых из них на ЭЭГ отмечаются нарушения, характерные для патологии гипоталамических ядер. При анализе рентгенограмм выраженных изменений черепа и турецкого седла не выявляется. Проба с эстрогенами позволяет уточнить патогенетические механизмы нарушения секреции гонадотропных гормонов. Ее результаты свидетельствуют о сохранности и функционировании механизмов обратной связи между гипоталамо-гипофизарными структурами и половыми стероидами, так как после введения эстрогенов отмечено закономерное снижение уровня гонадотропинов. При введении эстрогенов наблюдается восстановление характера электрической активности мозга даже при довольно длительном течении заболевания. У некоторых больных, по мнению тех же авторов, истощение функции яичников может являться следствием повышенной нейрогормональной активности гипоталамических структур, продуцирующих ЛГ-РГ. Ее причиной, очевидно, является нечувствительность ре-цепторных механизмов к эстрогенам, с одной стороны, и к гонадотропным гормонам — с другой. По данным Г. П. Корневой, у больных с первично-яичниковой недостаточностью наряду с повышением гонадотропных гормонов выявлен сниженный уровень дофамина (ДА) в крови и слегка повышенный — серотонина (СТ). Коэффициент ДА/СТ равняется 1. Таким образом, диагностика СИЯ основана на появлении аменореи у женщин репродуктивного возраста, бесплодии, «приливах» жара к голове, повышенной потливости. Одними из основных диагностических критериев СИЯ являются значительное повышение уровня гонадотропинов, особенно ФСГ, резкое снижение содержания эстрогенов, уменьшение размеров матки и яичников и отсутствие в них фолликулов. Прогестероновая и стимулирующие функцию яичников пробы с кломифеном, МЧГ и ХГ отрицательны. Отличительной чертой заболевания является улучшение общего состояния больных на фоне терапии эстрогенными препаратами. СИЯ следует дифференцировать с заболеваниями, имеющими сходную симптоматику. Для исключения опухоли гипофиза основными методами являются краниография, а также офтальмологическое и неврологическое обследование. В отличие от женщин с СИЯ, у больных с гипогонадотропным гипогонадизмом отмечаются низкий уровень гонадотропинов, отсутствие вазомоторных расстройств. При применении средств, стимулирующих функцию яичников (гонадотропины, кломифен), отмечается ее активация, чего не наблюдается у больных с СИЯ. При лапароскопии яичники небольшие, но просвечивают фолликулы; они также обнаруживаются при гистологическом исследовании биоптатов яичников. СИЯ следует дифференцировать с синдромом резистентных или рефрактерных яичников, который также характеризуется первичной или вторичной аменореей, бесплодием, нормальным развитием вторичных половых признаков, гипергонадотропным состоянием, умеренной гипоэстрогенией. Синдром встречается редко. Морфологически при этом синдроме яичники гипопластичны, хотя и правильно сформированы: четко различимы корковый и мозговой слой; в коре достаточное количество примордиальных фолликулов и единичные малые зреющие фолликулы с 1-2 рядами клеток гранулезы. Полостные и атретические фолликулы, желтые и белые тела практически не встречаются. Межуточная ткань содержит больше клеток, чем, например, при гипогонадотропном гипогонадизме. Предполагают аутоиммунную природу заболевания с образованием антител к рецепторам для гонадотропинов. Описана идиопатическая форма первично-овариальной недостаточности с высоким уровнем ФСГ и наличием фолликулов в яичнике. Лечение заключается в заместительной терапии половыми гормонами. При исходной или длительной аменорее его следует начинать с эстрогенизации. Микрофоллин по 0,05 мг в день курсами по 21 день с семидневными перерывами. Как правило, после первого же курса наступает менструальноподобная реакция. После 2-3 курсов микрофоллина или других эстрогенов можно переходить на комбинированные эстроген-гестагенные препараты типа бисекурина (ноновлон, ригевидон, овидон). Вегетативная симптоматика («приливы» жара, потливость) быстро купируется, улучшается общее самочувствие. Лечение следует проводить минимальными дозами, оказывающими положительный эффект. По мнению В. П. Сметник, обычно достаточно 1/4 таблетки указанных препаратов, не следует добиваться менструальноподобной реакции, а лишь стремиться к уменьшению выраженности вегетососудистых расстройств. Лечение следует проводить до возраста естественной менопаузы. В весенние месяцы показаны курсы витаминотерапии. Лечение больных с первичной овариальной недостаточностью является своеобразной профилактикой атеросклероза, инфаркта миокарда, остеопороза. Профилактика заключается в предотвращении воздействия таких неблагоприятных факторов, как токсикозы беременности и экстрагенитальная патология у матери, инфекционные заболевания в детстве. Необходим учет генетических факторов. Н.Т. Старкова-
Диффузный токсический зоб (ДТЗ, базедова болезнь, базедов зоб, болезнь Грейвса). Этиология и патогенез
Диффузный токсический зоб (ДТЗ, базедова болезнь, базедов зоб, болезнь Грейвса) — наиболее распространенное заболевание щитовидной железы, возникающее вследствие повышенной продукции тиреоидных гормонов. При этом, как правило, отмечается диффузное увеличение ее размеров Заболевание чаще встр...
Эндокринные заболевания -
Ожирение. Этиология и патогенез
Ожирение — хроническое рецидивирующее заболевание, характеризующееся избыточным содержанием жировой ткани в организме (у мужчин не менее 20 %, у жеОжирение — хроническое рецидивирующее заболевание, характеризующееся избыточным содержанием жировой ткани в организме (у мужчин не менее 20 &...
Эндокринные заболевания -
Гипофункция мужских половых желез
Гипогонадизм, или тестикулярная недостаточность,— патологическое состояние, клиническая картина которого обусловлена снижением в организме уровня андрогенов, характеризуется недоразвитием половых органов, вторичных половых признаков и, как правило, бесплодием.
Эндокринные заболевания
medbe.ru
MED24INfO
К первичной овариальной гипофункции яичников относится так называемый синдром истощенных яичников. Для характеристики этого патологического состояния предложено много терминов: “преждевременный климакс”, “преждевременная менопауза”, “преждевременная недостаточность яичников” и др. Термин “синдром истощенных яичников” (СИЯ) точнее отражает яичниковый генез заболевания и необратимость процесса. СИЯ, проявляющийся комплексом патологических симптомов (аменорея, бесплодие, приливы жара к голове, повышенная потливость и др.), является довольно редким состоянием. Оно развивается у женщин моложе 37—38 лет, имевших в прошлом нормальную менструальную и генеративную функцию. Профилактика сводится к предотвращению воздействия таких неблагоприятных факторов, как токсикозы беременности и экстрагениталь- ная патология у матери, инфекционные заболевания в детстве. Этиология и патогенез. В возникновении СИЯ играет роль множество средовых и наследственных факторов. Более чем у 80 % больных выявляется действие неблагоприятных факторов в период внутриутробного развития, пре- и пубертатном периодах (токсикозы беременности, экстрагенитальная патология у матери, высокий инфекционный индекс в детстве). Анализ генеалогических данных показывает, что родственницы 46 % больных имели нарушения менструальной функции и сравнительно часто — ранний климакс (38 лет — 42 года). Показатель полового хроматина колеблется в пределах от 14 до 25 %. У большинства больных выявляется нормальный женский кариотип 46,XX, редко обнаруживается мозаичный набор хромосом. Одной из причин раннего истощения функции яичников могут быть генные мутации. Не исключается возможность аутоиммунных нарушений. В конечном счете заболевание связано с пре- и постпубертатной деструкцией герминативных клеток яичников. Клиническая картина. Как правило, менархе у больных с СИЯ наступает своевременно; менструальная и генеративная функции не нарушаются в течение 12—20 лет. Заболевание начинается либо с аменореи, либо с оли- гоопсоменореи, продолжающейся от 6 мес до 3 лет. Через 1—2 мес после прекращения менструаций возникают приливы жара к голове, присоединяются слабость, головные боли, быстрая утомляемость, боли в сердце, снижается работоспособность. Жировой обмен, как правило, не нарушен. Все больные с СИЯ имеют правильное телосложение. Гипоплазия молочных желез отсутствует. При гинекологическом осмотре — резкая гипоплазия матки, снижение эстрогенной реакции слизистых оболочек, отсутствие симптома “зрачка”. Симптом “зрачка” всегда отри нательный, КПЙ в пределах 0—10%, ИС выявляет базальные и парабазальные клетки влагалищного эпителия, ректальная температура монофазная. При УЗИ выявляются резко уменьшенные в размерах матка и яичники. Эти данные можно подтвердить и с помощью лапароскопии, при которой обнаруживаются небольшие морщинистые яичники желтоватого цвета, желтые тела отсутствуют, фолликулы не просвечивают. При гистологическом исследовании биоптатов яичников фолликулы не обнаруживаются. При гормональном исследовании определяются низкий, обычно ниже, чем в фолликулярную фазу, уровень Е2, повышение ФСГ, содержание которого в 3 раза превышает овуляторный и в 15 раз базальный уровень этого гормона у здоровых женщин того же возраста. Концентрация ЛГ приближается к его уровню в период овуляторного пика и в 4 раза выше уровня базальной секреции Л Г. Содержание ПРЛ снижено в 2 раза по сравнению с нормой. Прогестероновая проба у всех больных отрицательна, что отражает недостаточную эстрогенную стимуляцию эндометрия. На фоне эстроген-гестагенной пробы у всех больных отмечаются улучшение самочувствия и появление менструальноподобной реакции через 3—5 дней после окончания пробы. Эти данные свидетельствуют о сохранении чувствительности и эндометрия. Проба с кломифеном (по 100 мг в течение 5 дней) не приводит к стимуляции яичников ни по данным ТФД, ни по уровню Е2. При введении менопаузального гонадотропина человека (МГЧ) или ХГЧ активация функции яичников также отсутствует. При внутривенном введении Л Г ГнРГ (100 мкг) увеличиваются исходно повышенные уровни ФСГ и ЛГ, что указывает на сохранение резервных возможностей гипоталамо-гипофизарной системы. У больных с СИЯ отмечается редукция альфа-ритма на ЭЭГ, а у некоторых — нарушения, характерные для патологии гипоталамических ядер. Эстрогены восстанавливают характер электрической активности мозга даже при длительном течении заболевания. Проба с Е2 позволяет уточнить механизмы нарушения секреции гонадотропных гормонов. Результаты пробы свидетельствуют о сохранности и функционировании механизмов обратной связи, так как после введения Е2 уровень гонадотропинов закономерно снижается. При рентгенографии выраженные изменения черепа и турецкого седла не выявляются. При первичной яичниковой недостаточности наряду с повышением содержания гонадотропных гормонов находят сниженный уровень ДА в крови и слегка повышенный уровень серотонина. Диагноз. СИЯ подозревают при появлении аменореи у женщин репродуктивного возраста, бесплодии, приливов жара к голове, повышенной потливости и др. Основными диагностическими признаками являются значительное повышение уровней гонадотропинов, особенно ФСГ, резкое снижение содержания эстрогенов, уменьшение размеров матки и яичников и отсутствие в них фолликулов. Прогестероновая проба и пробы с кломифе- ном, МГЧ и ХГЧ отрицательны. Отличительной чертой заболевания является улучшение общего состояния больных на фоне терапии эстрогенными препаратами. Дифференциальный диагноз. Для того чтобы исключить диагноз опухоли гипофиза, проводят краниографию и при необходимости КТ или МРТ головы, а также офтальмологическое и неврологическое обследование. В отличие от женщин с СИЯ у больных гипогонадотропным гипогона- дизмом отмечаются низкий уровень гонадотропинов, отсутствие вазомоторных расстройств. При использовании средств, стимулирующих функцию яичников (гонадотропины, кломифен), наблюдается ее активация, что не регистрируется у больных с СИЯ. При лапароскопии выявляются небольшие яичники с просвечивающими фолликулами, которые обнаруживаются и при гистологическом исследовании биоптатов. СИЯ следует дифференцировать от синдрома резистентных или рефрактерных яичников (СРЯ), который также характеризуется аменореей, бесплодием, нормальным развитием вторичных половых признаков, гиперго- надотропным состоянием и умеренной гипоэстрогенией. Синдром встречается редко и, возможно, имеет аутоиммунную природу (образование антител к рецепторам гонадотропинов). Не исключено, что определяемые радиоим- мунологическим методом высокие уровни ЛГ и ФСГ при СРЯ имеют слабую биологическую активность. Из фолликулярной жидкости выделен полипептидный ингибитор связывания ФСГ с рецепторами клеток гранулезы. Этот фактор, а также гона- докринины яичников, регулирующие процесс атрезии фолликулов, могут играть определенную роль в патогенезе СРЯ. Клиническая картина СРЯ гетерогенна, однако общим для заболевания является наличие у больных вторичной (реже первичной) аменореи, наступающей через 5—10 лет после наступления менархе. У многих женщин в дальнейшем могут быть спорадические менструации. При гинекологическом обследовании и УЗИ — некоторая гипоплазия матки, яичники средних размеров или несколько уменьшены. Уровень Е2 в плазме крови снижен. Содержание гонадотропинов всегда повышено: ФСГ до 40—90 мЕД/л; Л Г до 30—130 мЕД/л. Уровень ПРЛ нормальный. Проба с прогестероном первый раз может быть положительной, но в дальнейшем становится отрицательной. Проба с эстроген-гестагенными препаратами, даже в микродозах, всегда положительна. При введении эстрогенов наблюдается снижение уровня ФСГ, что свидетельствует о сохранности механизмов обратной связи. Точный диагноз СРЯ может быть поставлен только при гистологическом исследовании яичников (в отличие от СИЯ при СРЯ запас примордиальных фолликулов не истощен). Лечение. При СИЯ используют заместительную терапию половыми гормонами. При исходной или длительной аменорее применяют микрофол- лин (этинилэстрадиол) по 0,05—0,0125 мг (1—1/4 таблетки) в день курсами по 21-й день с 7-дневными перерывами. Как правило, после первого же курса наступает менструальноподобная реакция. После 2—3 курсов можно переходить на монофазные комбинированные эстроген-гестагенные препараты (нон-овлон, бисекурин, ригевидон, марвелон, фемоден, демулен и др.). Вегетативная симптоматика (приливы жара, потливость) быстро купируется, самочувствие улучшается. Добиваться менструальноподобной реакции не рекомендуется. Следует стремиться лишь к ослаблению вегетососу- дистых расстройств. В настоящее время предпочитают использовать не микрофоллин, а эстрадиола валерат (эстрофем или прогинова по 1 таблетке в день в непрерывном режиме) или комбинированные препараты (эстрадиола валерат + + гестаген) по той же схеме. Например, клиогест, или трисеквенс (эстрадиола валерат + норэтистерон), цикло-прогинова (эстрадиола валерат + норге- стрел), климонорм (эстрадиола валерат + левоноргестрел). Эффективны и конъюгированные эстрогены (гормоплекс или премарин). В весенние месяцы показаны курсы витаминотерапии. Лечение больных с первичной овариальной недостаточностью является профилактикой атеросклероза, инфаркта миокарда, ОП.Лечение СРЯ представляет большие трудности. Имеются сообщения об эффективной терапии эстрогенами, что связывают с эффектом “отдачи”. Кроме того, эстрогены увеличивают количество рецепторов гонадотропинов в яичниках. Предлагают лечить этих больных поэтапно гестагенами и кло- мифеном, возможно, в комбинации с ХГЧ. Применяют и аналоги люлибе- рина.
www.med24info.com