Способы лечения миомы матки
Миома матки: лечение народными средствами в домашних условиях
Диагностирование этого заболевания, звучит для женщины, как приговор, хотя это не так. Вовремя обнаруженная болезнь достаточно быстро лечиться, часто, народными средствами и не имеет побочных эффектов. Для начала, стоит разобраться с определением, обозначающим данное заболевание.
Миома матки – доброкачественная опухоль, возникающая у женщин достигших половой зрелости, связанная с нарушением функционирования кровотока и лимфы в мышцах матки.
Самый распространенный период болезни – это возраст женщины от 30 до 50 лет. Опасность данного заболевания состоит в том, что по мере роста опухоли могут быть задеты другие органы малого таза, что приведет к кровотечениям и, возможно, к летальному исходу.
Причины и симптомы заболевания
Симптоматика в некоторых женщин практически не просматривается, а диагностируется заболевание, только на плановом приеме у гинеколога. Все же есть общие симптомы для определения этой болезни.
- Постоянные тупые или ноющие боли внизу живота, в области яичников или матки.
- Отсутствие месячных более 3 месяцев.
- Проблемы с дефекацией, постоянные запоры или боли при мочеиспускании. В сильно запущенных случаях, страдают в первую очередь кишечник и мочевой пузырь.
- Бели. Выделения молочного цвета, иногда с примесями крови и дурным запахом.
Если вы обнаружили у себя хотя бы один из вышеприведенных симптомов, стоит немедленно обратится к вашему врачу-гинекологу, так следует начать незамедлительное лечение миомы, в том числе, и народными средствами.
Причины заболевания
- Первой и самой важной причиной является наличие гормонального сбоя у женщины. Неработающие яичники – это существенная причина возникновения миомы.
- Женские стрессы и нервные срывы весьма способствуют возникновению и росту этого заболевания.
- Недавно перенесенные или хронические заболевания почек, такие как пиелонефрит и тонзиллит.
- Систематический труд в тяжелых условиях (климатический или тяжелый физически).
- Заболевания щитовидной железы. Гормональный дисбаланс.
В случае уже существующего заболевания, то есть дополнительные причины, влияющие на рост и развитие опухоли. Это, прежде всего:
- Периодические аборты на поздних сроках.
- Хронические «женские» заболевания яичников и маточных труб, как правило, это воспалительные процессы.
- Чересчур длительное применение гормональных контрацептивов без перерывов.
- Отсутствие беременности и кормления грудью до 30 лет.
Диагностика заболевания
Провести полную диагностику может только лечащий врач-гинеколог, основываясь на ряде клинических исследований, таких как:
- Тщательной проверки и анализа жалоб и анамнеза. Стоит понимать, что анамнез – это течение и симптомы заболевания за определенный период времени.
- Изучение анамнеза наследственности. Сбор и анализ наследственных заболеваний у мамы, бабушки и т. д.
- Полученных данных при осмотре больной, реакция на пальпацию внутренних органов малого таза.
- Общих данных гинекологического профосмотра.
- И самый важный пункт в диагностировании данного заболевания – УЗИ. С помощью ультразвукового обследования можно не только определить наличие опухоли у женщины, но и узнать размеры и местоположение «очагов» болезни.
В особо запущенных случаях, иногда, назначают дополнительное обследование на предмет перехода доброкачественной опухоли в злокачественную. Для этого используют передовые медицинские технологии, на основании, которых и делают вывод. В современном мире, для более точной диагностики используют:
- Биопсия узла, при помощи гистероскопа. При этом методе берут при помощи длинного «штыря» кусочек пораженной болезнью ткани, для дальнейших клинических исследований на предмет рака.
- Лапараскопия органов малого таза и брюшной полости, проводится путем делания небольшого разреза в области живота под общим наркозом, и путем введения туда сверхчувствительной трубки, для получения клинических данных.
- Ангиография, сложна тем, что в кровь женщины, вводят специальное вещество, способное проявить любую злокачественную болезнь.
- Томография при помощи магнитных лучей, ее еще называют магнитно-резонансная.
Профилактика заболевания
Для того, чтобы максимально исключить появление и развитие миомы матки стоит вовремя предпринять все шаги, исключающие заболевание.
- Тщательно следите за гигиеной половой жизни, исключите незапланированные беременности, своевременно лечите воспаления и не допускайте гормональных нарушений.
- Регулярно проходите гинекологический осмотр у врача-гинеколога. Своевременное обнаружение врачом заболевания, избавит от тяжелого и длительного лечения.
- Беременность до 25 лет. Безусловно, не стоит воспринимать эту рекомендацию буквально современный мир изменился, поменялись и требования к рождению. Просто не стоит забывать, что физиология женщины устроена таким образом, что самое лучшее время для воспроизводства потомства – это до 25 лет.
- Регулярные занятия сексом значительно снижают риски появления заболевания. Уже давно доказано, что регулярное достижение оргазма женщиной, снижает почти на 50 % риск заболеваний «женской» сферы.
- Регулярные физические нагрузки. Спортивные тренировки снижают возможность застоя крови и лимфы в тканях, повышают тонус мышц, и благотворно сказываются на всем организме в целом.
- Одевайтесь тепло в холодное время года. Переохлаждение бедер и ног, могут привести к снижению иммунитета и возникновению воспалительных процессов в органах малого таза.
- Старайтесь отдыхать своевременно, избегайте стрессовых ситуаций.
- Старайтесь не находиться долго под действием солнечных лучей без защитных кремов. Ультрафиолетовые лучи пагубно действуют на состояние иммунной системы, что в свою очередь снижает защитные силы организма.
Народные рецепты лечения миомы матки
Так сложилось, что лечение миомы народными средствами в домашних условиях не какая-то средневековая дикость, а вполне действенный и эффективный способ избежать хирургической операции. Ниже приведены самые эффективные способы лечения миомы народными методами.
Лечение миомы с помощью лекарственных растений
- Лечение с помощью календулы. При миоме календулу пьют, делают тампоны, регулярно спринцуются. Для лечения миомы народным способом при помощи календулы, сначала делают отвар. Для приготовления отвара берут 2 ст. л. сухой травы или мелко порубленной свежей, заливают стаканом кипятка и охлаждают до комнатной температуры. Принимают вовнутрь 3 р/день по ½ стакана отвара.
- Сок алоэ. Для приготовления этого рецепта берем растение старше 3 лет, отламываем стебель, тщательно раздавливаем его (до кашицеобразного состояния). Далее, полученную смесь смешиваем с 1 ч. ложкой меда, добавляем несколько крупиц прополиса, все тщательно перемешиваем и смазываем тампон полученной смесью. Вводим во влагалище на 1 час.
- Рецепт против миомы от Ванги. Возьмите конопляные зерна, сделайте из них отвар и пейте 3 р/день, до полного исчезновения опухоли. Миома пройдет через 2-3 недели, пить необходимо до еды.
- Лечение Чистотелом. Вылечить миому матки сможет такое народное средство, как Чистотел. Это растение довольно ядовитое, поэтому и применять его необходимо с определенной долей осторожности, чтобы не навредить еще больше. Лечат непросто чистотелом, а спиртовой настойкой. Для приготовления настойки берут 0.5 л водки, 5 ст. л. чистотела, 1 ст. л. меда, все смешиваем, переливаем в стеклянную емкость и прячем в темное место на 14 дней. Принимать по 1 ст. ложке перед первым приемом пищи (завтрак). Принимать не в чистом, а разбавленном виде, ложку настойки растворяем в 1 ст. воды и выпиваем, каждые 3 дня увеличивать дозу на половину ложки и так до 5 или до полного выздоровления.
- Марьин корень. Если сможете достать это редкое растение, то попробуйте лечиться им, оно достаточно эффективно и, главное, проверено временем. Для лечения используйте отвар и настойку. Приготовить настойку вы сможете по вышеприведенному рецепту, все пропорции соблюдайте один в один. А отвар готовится по следующей схеме – 2 ст. л. травы на 1 ст. кипятка. Использовать отвар можно для спринцеваний и для приема внутрь перед едой. Настойку можно принимать по 3 ст. л. 3 р/день до еды, запивая небольшим количеством воды. Курс не больше 2 месяцев.
- Боровая матка. Это чудо-растение давно известно своими свойствами восстанавливать женское здоровье. Использовать растение можно ввиде отваров для приема внутрь 3 раза в день по ½ стакана перед едой. Готовить отвар согласно инструкции. Можно также использовать спиртовую настойку. Готовить настойку согласно вышеприведенным инструкциям, пить 3 раза в день по 2 ст. ложки перед едой, запивая стаканом воды.
- Корень тутового дерева и кора вишни. Это сочетание надолго избавит вас от женских опухолей, это средство давно известно сибирским лекарям своей эффективностью в лечении «женских» болезней. Для приготовления необходимо взять 1 часть коры и 3 части корня, смешать с водкой, настоять и принимать по 15-20 капель 3 раза в день до еды. Подобная настойка укрепляет стенки матки и способствует рассасыванию существующих опухолей.
- Лечение луком. Для лечения миомы матки таким народным средством, как лук, необходимо взять небольшую головку, натереть на терке. Далее, сделать самодельный тампон с полученной смесью, вставить во влагалище и держать не менее 30 минут, средство очень эффективно, но необходимо будет потерпеть.
Другие народные рецепты лечения
- Компресс из меда и канифоли сосны. Для приготовления этого компресса требуется взять 2-3 ст. л. меда, 10 сосновой канифоли и пару растительного масла, все тщательно перемешать и выложить на хлопчатобумажную тряпочку. После, аккуратно приложить к лобку и носить несколько дней не снимая, волосы, предварительно побрить.
- Тампоны из гусиного жира. Для приготовления этих тампонов берем 10 ложек свежего гусиного жира, растопить и добавить немного отвара календулы, остудить и ставить свечи во влагалище подряд 10 дней.
- Тампоны с рыбьим жиром. Берем тампон, пропитываем его рыбьим жиром и ставим на всю ночь во влагалище, и так 10 дней подряд.
- Лечение с помощью гирудотерапии. Пиявки издревле считались средством № 1 от болезней связанных с застоями в крови. С их помощью лечится не только миома, но и прочие опухоли вплоть до злокачественных образований.
- Лечение грецким орехом. Для приготовления настойки необходимы зеленые (молодые) орехи. Их заливают водкой и настаивают 15 дней в темном месте, принимают по 2 ст. л. 3 р/день, до полного выздоровления.
- Лечение кедровым орехом. Для лечения миомы матки без операции народными средствами делают настойку из кедровых орехов. Для приготовления настойки используют вышеприведенный рецепт, только вместо грецких орехов используют пустую скорлупку из кедровых.
- Кембриджская глина. Лечение глиной известно давно, только его мало кто применяет, а зря, по эффективности оно сравнимо с самыми передовыми методами официальной медицины. Народное лечение миомы матки с помощью глины проводится путем смешивания глины с водой до плотного пластелинообразного состояния, затем нанесения на низ живота до полного застывания. Курс лечения 21 день.
Общие рекомендации
Важно помнить, что никакое лечение народными средствами без операции миомы матки не будет эффективным, если вы в корне не измените свой образ жизни: не бросите пить и курить, не прекратите вести сидячий образ жизни, не перестанете постоянно жаловаться на проблемы.
Полностью избавьтесь от пагубных привычек, начните бегать по утрам и займитесь спортом. Попытайтесь больше времени проводить на свежем воздухе (желательно в лесу), в компании родных и близких, запишитесь а бассейн. Только такие комплексные меры помогут избавиться от миомы раз и навсегда без операции, боли и стресса.
Ваша болезнь – это не приговор, а руководство к активным действиям и тотальному перепросмотру предыдущего образа жизни.

Мы очень рады, что Вы, дорогие читатели, все чаще появляетесь на страницах нашего блога. Специально для Вас, работает команда профессиональных диетологов, гомеопатов и народных лекарей.
Если Вы прочитали материал и он оказался для Вас полезным, пожалуйста, поделитесь им в соц сетях. Мы будем Вам очень благодарны!
naturdoc.ru
Современные методы лечения миомы матки: медикаментозное, хирургическое или ЭМА - что выбрать и где лечить миому в Москве
- медикаментозные
- хирургические
- эмболизация маточных артерий
Медикаментозное лечение миомы матки
В настоящее время для медикаментозного лечения миомы матки используется только один фармацевтический препарат Эсмия. Это негормональное средство, которое блокирует рецепторы прогестерона - основного гормона, который способствует росту миоматозных узлов. Под воздействием этого препарата миоматозные узлы уменьшаются. К сожалению, это происходит не всегда.
Эффективность препарата зависит от того, насколько много прогестероновых рецепторов содержится непосредственно в миоматозном узле. В зависимости от этого результаты лечения могут быть различны – от практически полного отсутствия эффекта до ярко выраженного эффекта.
Медикаментозное лечение данного заболевания рекомендуется в тех случаях, когда эмболизация маточных артерий будет избыточным методом – например, в молодом возрасте при маленьких миоматозных узлах. Если у 20-летней пациентки узлы не превышают 1,5 – 3 см и заболевание протекает бессимптомно, то изначально медикаментозного лечения препаратом Эсмия, который позволяет на раннем этапе заболевания уменьшить эти узлы до минимума, будет вполне достаточно. Со временем медикаментозное лечение можно будет повторить при необходимости.
Иногда для лечения данного заболевания применяются также другие лекарственные препараты, но в современной гинекологической практике они считаются менее эффективными, чем любые другие методы лечения.
Хирургическое лечение миомы матки
Хирургическое удаление миоматозных узлов производится с помощью миомэктомии или гистерорезектоскопии.
Эти методы рекомендуются в тех случаях, если пациентка планирует беременность в ближайшее время и миоматозные узлы могут помешать зачатию или благополучному вынашиванию плода.
Но в этом случае необходимо оценить, насколько этот метод лечения может быть травмирующим для матки – в каждом случае это решается индивидуально.
Данные хирургические методы лечения применимы, если:
- миоматозный узел расположен снаружи матки
- миоматозный узел расположен внутри полости матки и его удобно полностью срезать с помощью гистерорезектоскопии
Гистерэктомия (хирургическое удаление матки) назначается только в исключительных случаях:
- при гигантских матках (более 20 – 22 недель беременности)
- при наличии множества миоматозных узлов (кроме тех гигантских миоматозных узлов, при которых показана миомэктомия)
- при наличии сопутствующей пограничной патологии эндометрия, шейки матки или яичников.
Эмболизация маточных артерий
ЭМА позволяет окончательно решить проблему миоматозных узлов, так как у этого метода нет рецидивов, которые возникают при хирургическом лечении, и при таком методе практически не бывает осложнений.
Если заболевание протекает с выраженными симптомами (обильные кровотечения, боли и т.п.), то эмболизация маточных артерий позволяет полностью решить эту проблему.
Этот метод рекомендуется в следующих случаях:
- при симптомной миоме у пациентки, которая не планирует беременность в ближайшее время, но в будущем собирается иметь детей
- при симптомной миоме у пациентки, которая уже закончила свой репродуктивный период
- если женщина планирует беременность в ближайшее время, при этом миома является множественной или миоматозные узлы располагаются в разных локализациях, поэтому хирургический метод лечения может нанести матке выраженный дефект в виде глубоких множественных рубцов
При эмболизации миоматозные узлы не удаляются. Эмболы перекрывают сосуды, питающие узлы, и миома усыхает, так же как виноград становится изюмом.
Другие методы лечения миомы матки
Несмотря на то, что иногда врачи предлагают женщинам некоторые другие методы лечения этого заболевания, в настоящее время они считаются неэффективными. К таким методам относится Мирена, ФУЗ-абляция.
Доказано, что гормональная спираль Мирена не оказывает никакого действия на миоматозные узлы и не является способом лечения миомы матки.
Такой метод как ФУЗ-абляция изначально обещал хорошие результаты, но у него есть серьезные недостатки. Во-первых, существует очень много условий для реализации этого метода (т.е. его применение возможно только в определенных случаях), а во-вторых, при таком методе лечения очень часто возникают рецидивы.
БАДы (индинол, эпигалат) и средства народной медицины не являются методами лечения миомы матки, так как они не оказывают на данное заболевания никакого доказанного лечебного эффекта.
www.mioma.ru
Миома матки: лечение народными средствами
Миома – это доброкачественная опухоль в полости или снаружи матки. Это заболевание не относится к онкологическим. Может быть разных размеров. Ее размер варьируется от нескольких миллиметров, до нескольких сантиметров. Чаще всего они образуются по несколько штук.
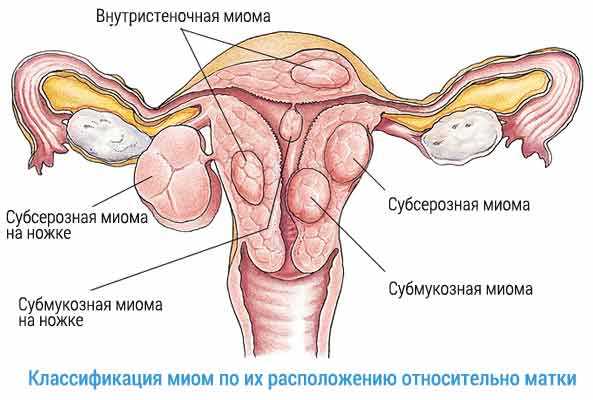
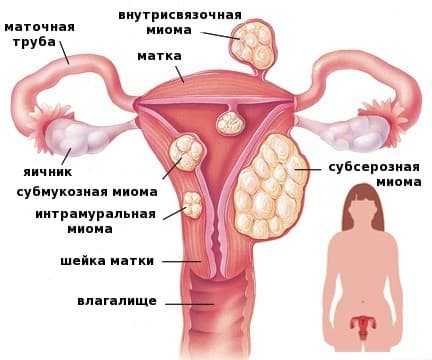
Миому матки можно поделить на несколько разновидностей:
- Суберозная – во время такой формы, опухоль располагается на внешней стороне органа, а от брюшной полости ее отделяет тонкая оболочка;
- Внутримышечная – в этом случае миома располагается в толще маточных мышц;
- Подслизистая – эта форма заболевания характеризуется тем, что опухоль возникает, прямо под слизистой оболочкой и проходит внутрь через просвет;
- Миома на ножке –во время этой формы может располагаться как на внутренней стороне матки, так и на внешней. Различаются они размером и толщиной ножки.
Причины возникновения заболевания
Возникает при нарушениях в работе эндокринной системы.

Очаги появление миомы матки
Опухоль может наблюдаться в юношеском возрасте, а потом с появлением климакса рассосаться. Основные причины возникновения заболевания:
- Наследственность;
- Дисбаланс на гормональном фоне;
- Воспалительные процессы в половых органах;
- Постоянные депрессии и стрессы;
- Отсутствие в повседневной жизни движения;
Чтобы понять суть заболевания, надо более подробно разобраться в причинах его возникновения.
- Излишек в организме эстрогена или недостаточное количество прогестерона. За счет того, что это гормональное заболевание, оно не беспокоит девушек до момента полового созревания и с наступлением климакса. Опухоль начинает активно расти, когда происходит сбой регуляции гормонов.
- Количество беременностей и абортов тоже влияют на появления новообразований. Рожавшие женщины реже сталкиваются с этим заболеванием, чем те, которые регулярно прерывают свою беременность.
- Питание играет значительную роль при данной болезни. Из-за жирной пищи увеличивается количество эстрогенов, а они как было сказано выше, влияют на активной рост опухоли. Страдают этим заболеванием в основном женщины, у которых есть лишний вес. Овощная диета и сбалансированное питание уменьшают риски появления.
- Если женщина не испытывает удовольствия от полового контакта, то это тоже может стать причиной возникновения доброкачественной опухоли.
- Женщины-диабетчицы тоже относятся к основной группе риска. Кроме этого, возможной причиной также является место жительства. У женщин, которые живут в сельской местности, оно встречается намного реже, чем у городских.
Симптоматика миомы матки
Если новообразования небольших размеров, симптомы могут полностью отсутствовать. Заболевания в таких случаях диагностируется во время планового медицинского осмотра. Если опухоль больших размеров, то девушки будут обязательно жаловаться на неприятные симптомы.
Заметка
При возникновении каких-либо симптомов, нужно немедленно обратиться в больницу, так как такие же симптомы, может иметь эндометриоз и рак яичников.
Болезнь может проявляться такими признаками:
- Регулярными нарушениями в менструальном цикле;
- Частое мочеиспускание образуется из-за того, что опухоль придавливает мочеиспускательный канал;
- Бесплодие;
- Тянущие боли в нижней части живота, которые не являются предвестниками менструации;
- Окружность живота увеличивается, а масса при этом не набирается.
Лечение без операции
Консервативные методы лечения можно применять на начальных этапах. Во время этого состояния ее рост замедляется, и можно с ней бороться медикаментозным путем.

Народные средства плюс питание и медикаментозное лечение
Во время медикаментозного лечения женщина должна употреблять:
- Оральные контрацептивы. Самой эффективной медикаментозной комбинацией является дезогестрел с этинилэстрадиолом. Эти средства хорошо борются с ее основными симптомами и помогают ей похудеть. Но не во всех случаях они помогают. Подходят для лечения образований, размер которых никогда не превышал 1,5 см.
- Агонисты. К медикаментам данной категории можно отнести трипторелин, бусерелин и газорелин. Во время приема этих медикаментов она уменьшается в размерах. Постоянно их употреблять тоже нельзя, так как они могут навредить женскому организму. Эти препараты зачастую предназначают перед предстоящей операцией, так как они помогают уменьшить ее размеры на 50%.
- Антипрогестагены. К этой группе медикаментов относиться только Мифепристон. Данное средство тоже назначают для применения перед операцией. Он не только помогает уменьшить образование в размерах, но и предотвращают большую кровопотерю во время операции.
- Антигонадотрорпины. К этой группе относится Даназол и Гестринон. Эти медикаменты устраняют только основные симптомы, на уменьшения размера они никак не влияют. Кроме этого, у них есть неприятные побочные эффекты, к которым относятся возникновение сыпи и излишней растительности на лице и теле. Также под действием этих лекарств может деформироваться голос. Их нужно применять только в комплексе с другими медикаментами.
- Гестагены применяются очень редко, так как они еще не полностью клинически тестированы. Единственным случаем, когда их можно применять, является миома матки и гиперплазия эндометрия. Применять такие медикаменты можно только под наблюдением врача.
- ФУЗ-абляция – это процедура, во время которой удаляются образования с помощью современных технологий. Преимущество ее заключается в том, что случаи рецидивов встречаются крайне редко. Удаляется путем ультразвукового выпаривания.
Преимущества данной процедуры:
- Девушка не подвергается наркозу;
- Не влияет на деторождение;
- Процедура не имеет никаких побочных эффектов;
- Реабилитация проходит в короткие строки.
Заметка
Матка во время процедуры не травмируется, поэтому женщина сможет спокойно зачать и выносить ребенка.
Принципы безоперационного метода лечения
Во время щадящего лечения нужно придерживаться специальной диеты, принимать регулярно гомеопатические препараты, а также заниматься фитотерапией. Данный тип лечения направлен на:
- Полную санацию половых органов;
- Активацию иммунитета при помощи народной медицины;
- Нормализацию обмена веществ путем регулирования и балансирования питания.
Когда нужно удалять миому путем оперативного вмешательства
Когда нужно делать экстренную операцию:
- Опухоль давит на соседние органы и мешает вести привычный образ жизни;
- Из-за опухоли возникают сильнейшие кровотечения из матки;
- Узлы матки начинают самостоятельно отмирать;
- Узлы расположены под слизистой оболочкой.
Во время выбора типа операции врач ориентируется на размер и на месторасположение опухоли.
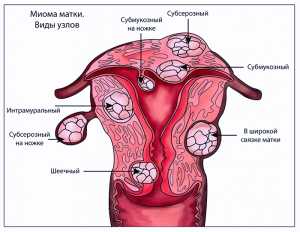
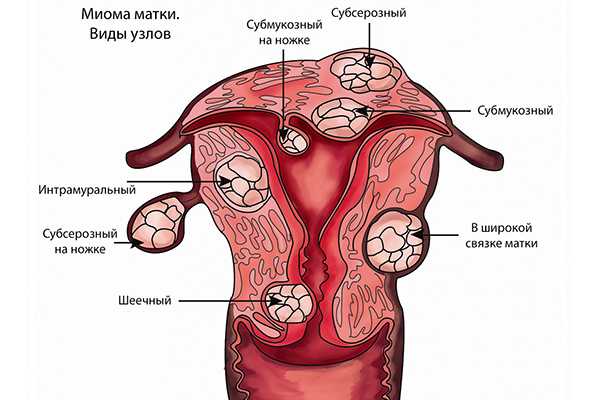
Виды узлов при миоме матки
Существуют три основных вида операции:
- Через небольшие отверстия в животе;
- Доступ к матке производится через влагалище;
- Через существенный разрез внизу живота.
Осложнения и последствия после операции
После удаления может начать развиваться злокачественная опухоль. Такие процессы происходят не часто, но женщине, чтобы их предотвратить, нужно регулярно наблюдаться у гинеколога. Если возникла новая опухоль, нужно следить за динамикой ее роста, так как если она быстро набирает размеры, это может свидетельствовать о ее злокачественности. Чтобы этого не допустить, врачи рекомендуют в тяжелых случаях удалять образования вместе с маткой.
На фоне удаленной миомы может возникнуть анемия или бесплодие. По сравнению с раком, это менее грозное последствие;
Может возникнуть некроз узла. В этом случая надо проводить экстренное хирургическое вмешательство.
Заметка
Если у женщины есть хоть один ребенок, то ей можно соглашаться на предложение врачей по удалению органа, так как она свои функции уже выполнила. Благодаря такому ответственному решению она сохранит себе здоровье и жизнь.
Народные средства лечения миомы матки больших размеров
В народной практике существуют множество способов, благодаря которым можно избавиться от большой миомы. Вот некоторые из них.
Боровая матка помогает лечить практически каждую женскую болезнь. При миоме нужно употреблять именно настойки из этого растения.
Чтобы приготовить настойку, берем 2 ч.л. измельченной сухой травы и заливаем 1 стаканом горячей воды. После этого смесь перемещаем на водяную баню и пропариваем там 5-10 минут. Настойку необходимо настоять в течение 5 часов, после этого процедить и употреблять по три раза в день в момент менструации.
Гирудотерапия при миоиме матки
Свежий сок картофеля тоже обладает свойствами, с помощью которых можно излечить данное заболевание. Чтобы им лечиться, нужно правильно его приготовить. Для выдавливания подойдет молодой, без повреждений и с розовой кожурой картофель средних размеров. Его нужно промыть от загрязнений при помощи щетки. После этого клубни надо натереть на самой мелкой терке и выдавить с получившейся кашицы сок. Получившийся сок требуется выпить сразу после отжима. Кроме этого, им можно делать спринцевание. Но для таких процедур нужно добавить сок свежей моркови в пропорции 1 к 1.
Настойка пустырника тоже является универсальным средством для лечения любых женских заболеваний. Чтобы приготовить настойку, нужно взять 1 часть сухого растения и залить его 5-тью частями спирта. Данному раствору необходимо дать настояться в течение месяца в темном месте, периодически нужно перемешивать.
Это народное средство нельзя употреблять при повышенном давлении и язве желудка.
Миому матки можно также лечить при помощи прополиса и пиявок.
Видео:Народные средства от миомы
Заключение
Миому матки можно побороть как оператиным путем, так и с помощью народной медицины. При выборе народного средства нужно обязательно проконсультироваться с врачом. Самым оптимальным вариантом является лечение опухоли одновременно медицинским и народным путем.
detieco.ru
Неоперативные методы лечения миомы матки
Лейомиома матки — одно из самых распространенных заболеваний у женщин, однако, несмотря на успехи в диагностике миомы матки, до настоящего времени не существует «золотого» стандарта лечения, что обусловлено как нерешенными проблемами патогенеза миомы матки, так и традиционно сложившимися представлениями «о бесполезности» матки при реализованной репродуктивной функции. Поэтому наиболее распространенным методом лечения миомы матки остается гистерэктомия. Подобный радикализм у большинства больных не обоснован, поскольку практически отсутствует риск озлокачествления и отмечается прогресс в появлении методов, тормозящих рост опухоли и вызывающих регресс симптомов заболевания [1, 4] Использование малоинвазивных и неинвазивных методов лечения на ранних этапах развития миомы матки позволяет остановить развитие заболевания, привести к его регрессу и не допустить в дальнейшем нарушения репродуктивной функции [2, 3].
Эпидемиология. Факторы риска
Частота возникновения миомы матки составляет 15–17% у женщин старше 30 лет и 30–35% у женщин, достигших пременопаузального возраста [1, 5]. Однако в последние годы наблюдается тенденция к «омоложению» миомы матки — возникновение ее у женщин до 30 лет, что обусловлено как совершенствованием диагностики, так и широким распространением «агрессивных» акушерских и гинекологических вмешательств. Частое сочетание миомы матки с доброкачественными заболеваниями эндометрия, эндометриозом осложняет течение заболевания и затрудняет тактику лечения.
Средний возраст выявления миомы матки составляет 32,8 ± 0,47 года, а показания к активному хирургическому лечению появляются примерно к 45 годам. Установлено, что развитие этой опухоли занимает в среднем 5 лет и в 84% случаев узлы являются множественными [1, 5,].
Эпидемиологические исследования выявили ряд факторов риска развития этой опухоли — этнические, генетические, паритет, вредные привычки, питание [1, 7]. У афро-американских женщин встречаемость миомы матки самая высокая, причем возникают в более молодом возрасте, достигают больших размеров и частота анемий выше, особенно по сравнению с кавказскими и азиатскими женщинами. Объяснением служит повышенный уровень циркулирующих эстрогенов по сравнению с женщинами другой расы.
Исследования близнецов и семей выявили генетический фактор риска [1]. Так, вероятность развития этой опухоли значительно выше и возникает в более молодом возрасте у женщин, матери и/или сестры которых страдали этим заболеванием. Недавно был определен фактор наследственности, как предполагают, играющий роль в этиологии опухоли матки. Хотя 50–60% миом матки являются кариотипически нормальными, однако часто встречаются аберрации, которые затрагивают хромосомы 6, 7, 12 и 14 (Gross K. L., 2001). Перестройки в этих хромосомах последовательно влияют на две недавно обнаруженные группы генов белка — HMGIC и HMGIY. Они кодируют те белки, которые, вероятно, играют роль в транскрипции и могут играть свою роль в аномальном росте миом. Однако, несмотря на доказательство наследования, не выявлено, какие именно генные мутации могут привести к развитию данного заболевания, а следовательно, не существует и превентивных мер.
Отсутствие детей и раннее наступление менархе повышает в 2–3 раза риск развития миомы. Причем степень уменьшения риска тем выше, чем больше детей в семье, — так у женщин с тремя доношенными беременностями риск снижается на 50–90%, хотя не выявлено никакой корреляции между возрастом при первых родах и миомами, а также для женщин 45 лет и старше защитный эффект parity не столь очевиден [7]. Объяснить это можно либо более высокой степенью риска вследствие более длительного периода с момента последних родов, либо более длительного периода воздействия стероидных гормонов в целом. Противоречивы данные о действии оральных контрацептивов. Однако в большинстве работ доказано, что применение оральных контрацептивов не повышает риск развития миомы матки. Так же как и нет никаких доказательств увеличения роста и количества миоматозных узлов на фоне приема заместительной гормональной терапии (ЗГТ) (Luoto R., 2002).
Избыточный вес, особенно в сочетании с низкой физической активностью на фоне хронического стресса, повышает риск миомы матки в 2–3 раза, причем прибавка веса после 18 лет влияет более значительно, чем ожирение в детском и пубертатном возрасте. Это объясняется повышенной периферической конверсией в жировых клетках андрогенов в эстрогены под воздействием ароматазы и более высокой биодоступностью факторов роста, типа инсулиноподобного фактора роста-1 (ИПФР-1).
Не выявлено корреляций с курением, хотя теоретически курение могло бы снижать риск миомы матки, поскольку напоминает состояние, характерное для относительного дефицита эстрогена, т. е. с характерными признаками остеопороза, ранней менопаузой и более низкими показателями рака эндометрия [5]. Однако данные, которыми мы располагаем сегодня, достаточно противоречивы, и только некоторые исследователи отмечают среди курильщиц уменьшение риска на 30–50% [1, 16].
Аналогии между опухолями гладкой мускулатуры и атеросклеротическими бляшками и, следовательно, возможную корреляцию между атерогенными факторами и риском миомы матки изучали Faerstein et al. Исследователи зафиксировали увеличение риска миом в 2,1 раза у пациенток до 35 лет с артериальной гипертензией, принимающих гипотензивную терапию дольше пяти лет и при длительности заболевания не менее пяти лет.
Таким образом, дальнейшие исследования, особенно посвященные цитогенетическим и молекулярным аспектам миом, приведут нас к определению тех генетических локусов, которые играют важную роль в индуцировании данных опухолей.
Патоморфология. Патогенез
Лейомиома матки представляет собой доброкачественную опухоль моноклонального происхождения, развивающуюся из гладкомышечных клеток и содержащую различное количество волокнистой соединительной ткани. Большинство ученых считают, что миома матки соответствует критериям истинной опухоли, о чем свидетельствуют: моноклональный характер развития миомы (как и большинство опухолей, в том числе и злокачественных), большие размеры и автономный рост опухоли, обусловленный воздействием факторов роста и цитокинов, активизация процесса неоангиогенеза, генетическая нестабильность (до 40% миом имеют генетические нарушения), т. е. вследствие мутаций уменьшается точность воспроизведения генетического аппарата, нарушается механизм репарации ДНК, изменяется регуляция клеточного цикла в поврежденных клетках, что приводит к неуклонной опухолевой прогрессии [1, 4, 25].
По мнению большинства ученых, миомы возникают в результате множественных соматических мутаций в нормальных клетках миометрия, что ведет к постепенному снижению регуляции их роста. Опухоль растет из клетки-прародительницы, в которой произошла первоначальная мутация и является следствием нарушения тканевого гомеостаза, поддерживаемого балансом клеточной пролиферации и апоптоза. В последнее десятилетие установлено, что образование и рост опухоли связаны с изменениями сложных взаимодействий между стероидными гормонами и их рецепторами, местными факторами роста и состоянием внеклеточного матрикса [20, 25, 12].
В настоящее время наибольшее подтверждение находит теория Fujii S., согласно которой развитие гладкомышечных клеток мезодермального происхождения происходит на эмбриональном этапе длительно: от 14 до 30 недель внутриутробного периода развития. Поэтому эти еще недифференцированные клетки за счет длительного периода внутриутробного развития могут подвергаться воздействию многочисленных факторов из организма матери (тропных гормонов, половых стероидов, факторов роста) и окружающей среды. Эти клетки-предшественники (уже с соматическими мутациями) сохраняются в миометрии и начинают расти после менархе. Их рост продолжается в течение многих лет на фоне выраженной активности яичников под действием как эстрогенов, так и прогестерона [12, 20, 27].
Также возможен и другой путь образования клеток-предшественников, при котором неопластическая трансформация миометрия может происходить в результате соматических мутаций нормального миометрия под влиянием половых стероидов и факторов роста. Однако молекулярные изменения, инициирующие эту трансформацию, до конца неизвестны.
Этиология и патофизиология остаются малопонятными, хотя к настоящему времени и определены основные молекулярно-генетические детерминанты возникновения этого заболевания. К ним относятся цитогенетические нарушения, изменения половых стероидов и гормональной чувствительности тканей, нарушение процесса ангиогенеза. В ткани миоматозных узлов в 40–50% имеются опухоль-специфические дефекты хромосом, определяемые кариотипически, что подтверждает роль генетических механизмов в росте и развитии миомы матки. Согласно современным представлениям, рост миомы происходит главным образом за счет пролиферации, стимулированной половыми стероидами через факторы роста по аутокринно-паракринному механизму, при относительно низкой готовности опухолевых клеток к апоптозу.
Несомненно, миома матки является гормонозависимой опухолью. До настоящего времени не известны механизмы, запускающие рост опухоли, но несомненна центральная роль половых стероидов — эстрогенов, прогестерона и их рецепторов в моделировании роста, дифференцировки и функции миометрия. Известно, что ключевую роль в контроле роста и развития миоматозных узлов играют эстрогены. Подтверждением этому служит повышенный уровень экспрессии эстрогеновых рецепторов в ткани узлов, по сравнению с неизмененным миометрием [8], а также стимулирующий эффект эстрогенов на синтез ДНК и клеточную пролиферацию в тканях матки. Также имеются данные о повышении уровня антигена клеточной пролиферации Ki-67 в нормальном миометрии [11] и усиление роста миомы матки преимущественно в лютеиновую фазу [20], что подтверждает роль прогестерона в индуцировании митогенного эффекта факторов роста. Очевидно, влияние эстрогенов и прогестерона комплементарны, т. е. эстроген создает условия для стимуляции пролиферации прогестероном [13]. Это подтверждается и работами, в которых прогестерон вызывает увеличение экспресии PCNA и эпидермального фактора роста в клетках миомы, тогда как эстрадиол в тех же клетках увеличивает экспрессии PCNA и ЭФР-рецептора [25, 11]. Следовательно, сочетанное действие эстрадиола и прогестерона стимулирует пролиферативный потенциал клеток миомы.
Другим потенциальным механизмом образования миомы матки является торможение механизмов апоптоза [12, 17]. В многочисленных работах доказано влияние половых стероидов не только на пролиферативные процессы, но и на регуляцию апоптоза в миометрии. Установлено, что протеин Bcl-2, тормозящий апоптоз, значительно меньше экспрессируется при лейомиоме по сравнению с нормальным миометрием. Причем эстрадиол, подавляя экспрессию этого протеина, снижает апоптоз.
Таким образом, развитие пролиферативных процессов, к которым относится и лейомиома матки, обусловлено не только повышенной пролиферацией клеток, но, возможно, и ослаблением индукции апоптоза.
В реализации влияния половых стероидов участвуют местные ауто- и паракринные факторы (факторы роста, цитокины и др.), продукция которых находится под контролем эстрогенов и прогестерона. Митогенное действие эстрогенов опосредовано местными регулирующими ростовыми факторами. Результатом их избыточной продукции является ускорение клеточной пролиферации, гипертрофия клеток, увеличение объема межклеточного матрикса, и нередко отмечается сочетание этих явлении [8]. Наиболее значимыми факторами роста для миомы являются трансформирующий фактор роста-бета (ТФР-бета), стимулирующее влияние на продукцию которого оказывает также и прогестерон. Эстрогены действуют и на межклеточный матрикс, оказывая непосредственное стимулирующее влияние на коллаген типа I и III и протеин коннексин-43 щелевидных межклеточных контактов [14].
Таким образом, стероидные гормоны могут оказывать стимулирующее влияние на пролиферацию опухолевой ткани путем воздействия и на местные факторы роста, продуцируемые гладкомышечными клетками и фибробластами [14, 25]. Влияние медиаторов различных факторов клеточного роста, также как и половых стероидов, осуществляется через клеточные рецепторы, концентрация и чувствительность которых играют важную роль в регуляции опухолевого роста. Основными модуляторами клеточного роста, обладающими выраженными митогенными свойствами на миометрий и ткань миомы, являются ИПФР-1, эпидермальный фактор роста (ЭФР), ТФР-бета и группа ангиогенных факторов роста. В настоящее время ангиогенез рассматривается как ключевой фактор в развитии опухолевых процессов. Это касается и роли ангиогенеза в патогенезе миомы матки. Основными индукторами процесса ангиогенеза являются сосудистый эндотелиальный фактор роста (СЭФР-А), ангиогенин и основной фактор роста фибробластов (ФРФ-2).
Противоположным действием на ангиогенез и, следовательно, ограничивающим рост опухолевой ткани обладают ингибиторы ангиогенеза. Одним из основных является эндостатин, который является не только мощным ингибитором ангиогенеза, но и специфическим ингибитором пролиферации клеток эндотелия. СЭФР — является важнейшим фактором, определяющим процессы образования новых сосудов и повышенную сосудистую проницаемость. Гипоксия ткани внутри миоматозного узла стимулирует экспрессию СЭФР и, таким образом, вызывает отек узла, что обусловлено способностью СЭФР повышать проницаемость сосудов [38]. Экспрессия СЭФР в тканях матки и яичников может регулироваться гормональным путем — половыми стероидами. Следует отметить, что ТФР-бета и ФРФ могут являться и факторами, модулирующими рост сосудов; ФРФ являются потенциальными митогенами, в то время как ТФР-бета — выраженный ингибитор пролиферации клеток эндотелия. Полагают, что ФРФ стимулируют ангиогенез, непосредственно воздействуя на эндотелиальные клетки, в то время как ТФР-бета оказывает опосредованное непрямое влияние, стимулируя другие клеточные типы к выделению факторов, стимулирующих клетки эндотелия.
Процессы ангиогенеза в миомах неразрывно связаны с морфогенезом этих опухолей и в значительной степени определяют особенности возникновения, характер роста и клинико-морфологические варианты (простая и пролиферирующая миома матки), и, по мнению ряда авторов, методы лечения миомы матки в перспективе должны быть связаны с возможностью воздействия на процессы ангиогенеза [6, 14].
Следовательно, половые стероиды осуществляют регуляцию роста миомы посредством комплекса факторов, регулирующих пролиферацию, апоптоз и ангиогенез в опухолевой ткани.
Таким образом, многочисленные исследования, посвященные патогенезу данного заболевания, выявили ряд факторов роста и рецепторов, влияющих на пролиферацию гладкомышечных клеток, апоптоз, продукцию межклеточного вещества, на пролиферацию и миграцию эндотелиоцитов, играющих важную роль в процессе развития опухоли. Полученные научные данные внесли не только определенную ясность в понимание механизмов влияния половых стероидов на рост миомы матки, но наметили новые направления в медикаментозном лечении.
Диагностика. Клиника
Основными инструментальными методами диагностики миомы матки являются ультразвуковое исследование (УЗИ), значительно реже — компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). В последние два десятилетия гистероскопия и лапароскопия обеспечили новый метод диагностики и лечения миомы матки. Информативным методом распознавания субмукозной и интерстициальной с центропетальным ростом миомы матки является гистероскопия (точность достигает 99,2%). Достоинство метода — возможность одновременной биопсии эндометрия, с целью диагностики сопутствующих гиперпластических процессов. Лапароскопия используется преимущественно при необходимости дифференциальной диагностики миомы и опухоли яичника, а также для распознавания вторичных изменений в миоматозных узлах, являющихся противопоказанием к консервативной терапии.
У половины пациентов болезнь протекает бессимптомно и диагностируется только при гинекологическом или ультразвуковом исследовании. Но у каждой второй женщины возникают симптомы заболевания, которые ухудшают качество жизни и требуют лечения. Симптомы зависят от количества, размеров и расположения миоматозных узлов, а также от степени вторичных дегенеративных и воспалительных изменений в ткани узлов. Основные симптомы лейомиомы матки: 1) обильные, длительные менструации и/или ациклические кровотечения, которые сопровождаются слабостью, утомляемостью, приводят к развитию железодефицитной анемии, 2) тянущие боли внизу живота (у 20–30% больных), очень редко возникают острые боли, связанные с нарушением кровотока в миоматозных узлах, и сопровождаются повышением температуры, слабостью, 3) при больших размерах лейомиомы матки может происходить давление на соседние органы: мочевой пузырь, прямую кишку, что проявляется учащенным мочеиспусканием, запорами, 4) бесплодие, невынашивание беременности, осложнения во время родов наблюдаются у каждой третьей пациентки с множественными миомами.
Тактика ведения
Несмотря на то, что миома матки является наиболее часто выявляемым заболеванием, в тактике ведения больных данной патологией остается много нерешенных вопросов и противоречий. В разных странах имеются различные подходы к лечению заболевания, отличаются и показания к радикальным операциям. Тактика ведения больных миомой матки включает три основных направления: выжидательное, консервативное и активное воздействие на опухоль.
Выжидательное ведение больных с миомой матки возможно только при отсутствии симптоматики и небольших по размеру (до 10–12 недель) опухолях при реализованной репродуктивной функции и заключается в активном амбулаторном наблюдении: динамическое ультразвуковое исследование, цитологический контроль состояния эпителия шейки матки и эндометрия, определение уровня онкомаркеров. Однако, учитывая частоту встречаемости сопутствующей патологии при миоме матки, только у небольшого числа пациентов мы можем ограничиться выжидательной тактикой ведения.
Консервативное ведение больных миомой матки заключается преимущественно в гормональном лечении, хотя в последние годы предложены противофибротические средства, антиангиогенные, аналоги соматостатина (в настоящий момент эти препараты находятся на стадии клинических испытаний). Среди гормональных препаратов несомненное лидерство принадлежит аналогам гонадолиберина и антигестагенному препарату — мифепристону (RU 486). Эти препараты используются как в качестве самостоятельного лечения, показания к которому четко определены, так и в качестве адъювантной терапии, имеющей определенные преимущества и недостатки.
Активная тактика ведения больных с миомой матки делится на два основных направления: хирургическое лечение и малоинвазивные вмешательства. Хирургический метод продолжает оставаться основным методом лечения данной категории больных — до 80% больных подвергаются гистерэктомии или миомэктомии. Однако многие женщины в наше время стремятся отложить деторождение на более поздний возраст, когда, к сожалению, значительно чаще развивается лейомиома матки. Поэтому совершенствование медикаментозного лечения и малоинвазивных, органосохраняющих технологий является основной тенденцией в современных условиях.
Методы лечения
Поиск и применение новых лекарственных средств и малоинвазивных технологий, приближающихся по эффективности к гистерэктомии и не вызывающих побочных эффектов, является альтернативным лечением миомы матки.
В настоящее время можно выделить три основных подхода к лечению миомы матки.
-
Хирургические методы лечения: радикальные операции (гистерэктомия, применяемая при миоме матки больших размеров, множественной, при сочетанной патологии у женщин с реализованной репродуктивной функцией) и органосохраняющие операции (миомэктомия, применяемая при нереализованной репродуктивной функции).
-
Неинвазивные методы лечения: медикаментозное лечение, направленное на контроль роста лейомиомы и развития симптомов заболевания, и фокусированная ультразвуковая абляция миомы матки.
-
Малоинвазивные методы лечения (эмболизация маточных сосудов, миолиз различными источниками энергии).
Традиционно терапевтическое лечение миомы матки основывается на воспроизведении медикаментозной псевдоменопаузы и/или индукции гипоэстрогении. Медикаментозная терапия в качестве монотерапии, как правило, назначается пациенткам при бессимптомном течении заболевания и при небольших (соответствующих менее 12 нед беременности) размерах опухоли [1, 15, 16). На протяжении довольно длительного времени использовались гестагены: норэтистерон (Норколут, Примолют-нор), дидрогестерон (Дюфастон) и др. Однако результаты лечения были малоэффективны. Основываясь на прогестероновой гипотезе развития миомы матки, малоэффективные результаты лечения производными прогестерона вполне объяснимы. В настоящее время применение гестагенов оправдано только при сочетании миомы матки (небольших размеров) с гиперпластическими процессами эндометрия и аденомиозом у женщин позднего репродуктивного или пременопаузального периода при постоянном динамическом наблюдении. Современное медикаментозное лечение включает применение агонистов гонадотропин-релизинг гормона (аГн-РГ) либо в качестве долгосрочной монотерапии, либо как этап комбинированного метода [15, 16].
Однако при несомненной эффективности этих препаратов, даже при минимальном курсе лечения (3–4 месяца), они обладают выраженным побочным действием, связанным с развитием эстроген-дефицитного состояния. Механизм действия этих препаратов заключается в подавления гонадотропной функции гипофиза, вследствие которой развивается гипоэстрогения и блокада продукции прогестерона. Очевидно, агонисты гонадолиберина действуют непосредственно и на опухолевую ткань, что подтверждается наличием рецепторов к гонадолиберину, снижением уровня рецепторов к эпидермальному фактору роста, подавлением продукции ТФР-бета и пролактина непосредственно в ткани лейомиомы матки (при лечении этими препаратами). Возможна также непосредственная стимуляция аналогами гонадолиберина процессов апоптоза в опухолевой ткани, что подтверждается повышением экспрессии рецепторов Fas и их лигандов (маркеры апоптоза). Десенситизация гипофиза и подавление функции яичников приводят к уменьшению объема матки и лейомиомы примерно на 50–65% и прекращению меноррагий, благодаря развитию аменореи, что позволяет скорректировать анемию до операции. Оптимальным режимом введения данных препаратов является короткий 3–4-месячный курс с ежемесячными инъекциями. Важной особенностью действия аГн-РГ является снижение кровоснабжения узлов, что стимулирует процесс апоптоза, а также уменьшает кровопотерю и сокращает длительность оперативного вмешательства. Побочные эффекты аГн-РГ связаны с гипоэстрогенией, проявляющейся вазомоторными симптомами, снижением минеральной плотности костной ткани, что ограничивает длительность приема и требует корригирующей терапии.
Принципиально новым препаратом, применяемым при лечении больных с миомой матки, является антипрогестин — мифепристон. Мифепристон — это синтетический стероид, обладающий одновременно антипрогестероновой и антиглюкокортикоидной активностью. Механизм действия заключается в связывании с прогестероновыми рецепторами, вследствие чего блокируется их функция. Суточная доза препарата — 50 мг в течение трех месяцев перорально, непрерывно. Эффективность препарата сравнима с эффективностью аналогов гонадолиберина — на 40–49% уменьшаются размеры матки и узлов. Основная особенность действия этого препарата — отсутствие гипоэстрогении, поэтому не наблюдается ни вазомоторных симптомов, ни снижения минеральной плотности костной ткани. У большинства женщин с миомой матки развивается аменорея при 3-месячном и более длительном курсе лечения. Первоначально мифепристон у больных с миомой матки применялся в качестве предоперационной подготовки, что являлось вполне обоснованным, так как при минимальных побочных эффектах (слабые приливы, тошнота) удается добиться снижения размеров опухоли и уменьшения менометроррагий. В настоящее время проводятся научные исследования по применению этого препарата и в качестве единственного метода лечебного воздействия в более длительном режиме [10, 22, 23].
Недавно предложены совершенно новые подходы к лечению миомы матки — блокирование действия специфических факторов роста [16, 28]. Действие одной группы препаратов (так называемая антифибротическая терапия) основывается на том, что лейомиомы содержат большое количество внеклеточного матрикса, состоящего из фибронектина, коллагена типа 1, 3 и протеогликанов. Доказано, что ТФР-бета и ФРФ увеличивают продукцию межклеточного вещества гладкомышечными клетками и снижают образование коллагеназы. Пирфенидон — антифиброзный препарат, ингибирует синтез ДНК, клеточную пролиферацию и продукцию коллагена в гладкомышечных клетках лейомиомы и нормального миометрия, вызванную вышеназванными факторами роста. Этот препарат обладает дозозависимым действием, минимальным количеством побочных эффектов и не оказывают токсического воздействия на гладкомышечные клетки. (В настоящее время проводятся клинические испытания.)
Действие другой группы препаратов основывается на ингибировании ангиогенеза [6, 14, 16]. Несколько факторов роста принимают участие в процессе ангиогенеза: ФРФ, ТФР, СЭФР (последний является важнейшим, так как синтезируется большинством линий опухолевых клеток и обладает многосторонним влиянием). Двумя основными механизмами эти факторы роста индуцируют рост лейомиомы матки: первый — усиление пролиферации, миграции гладкомышечных клеток сосудов и эндотелиоцитов; второй — стимуляция формирования кровеносных сосудов. Пока только единственный препарат, обладающий ингибирующим влиянием на ангиогенез, — интерферон-альфа прошел клиническое испытание на 20 больных с лейомиомой матки. Показано достоверное уменьшение объема образования уже после первой недели лечения. Таким образом, ингибирование ангиогенеза, посредством воздействия на перечисленные факторы роста, представляет собой одну из наиболее перспективных стратегий лечения лейомиомы матки.
Следовательно, для большинства пациентов более привлекательным остается медикаментозное лечение в качестве единственного метода. Поэтому поиск новых лекарственных средств, позволяющих избежать оперативное вмешательство и в то же время не приводящих к выраженным побочным эффектам, поможет решить важную проблему женского здоровья.
Другим направлением в органосберегающих методах лечения миомы матки, которые бы при высокой эффективности обладали и максимальной (достаточной) безопасностью, стала разработка в конце 90-х годов нового неинвазивного хирургического метода, который получил название «Неинвазивная абляция миомы матки воздействием фокусированного ультразвука (ФУЗ) под контролем ядерно-магнитно-резонансной томографии».
Об эффективности и безопасности ФУЗ-МРТ-абляции сообщали C. M. Tempany и соавт. (2000), Rabinovici J. и соавт. (2002), а Jolesz F. A., Hynynen K. (2002) назвали метод ФУЗ «идеальной операцией». Технология ФУЗ-МРТ представляет собой сочетание высокоинтенсивного фокусированного ультразвука, луч которого неинвазивно нагревает выбранные участки ткани миомы и вызывает их термический некроз, и магнитно-резонансной томографии. Звуковые волны проходят сквозь ткани, не вызывая их повреждения, и за счет фокусировки волн происходит локальный нагрев ткани миомы до 55–90 °С, что вызывает термическую коагуляцию в четко ограниченной области, не оказывая никакого вредного воздействия на окружающие ткани, т. е. ФУЗ-МРТ-абляция обеспечивает локальный селективный коагуляционный некроз в малом объеме ткани (в точке фокуса), что используется для прецизионной неинвазивной абляции опухолей.
Процесс лечения состоит в последовательных воздействиях (так называемых соникаций) на небольшие фрагменты опухоли, что приводит к нагреванию их и селективному коагуляционному некрозу. Механизм действия ФУЗ-абляции включает как прямое, так и опосредованное повреждающее воздействие. Прямое — это термическое воздействие за счет высвобождения энергии звуковой волны. Опосредованное — за счет изменения локального кровотока и нарушения питания опухолевой ткани. Доказано, что при нагревании ткани до 60 °С в течение 1 секунды происходит гибель всех клеток за счет их дегидратации, повреждения сосудистых структур, денатурации белков и разрушения коллагеновых волокон. Иммуногистохимические исследования показали, что данный метод вызывает летальное или сублетальное повреждение опухолевой ткани и исчезновение ее пролиферативной активности, при этом избирательность воздействия и полная безопасность ФУЗ для интактных тканей, окружающих миому, обусловлены также разницей в перфузии крови в миоматозном узле по сравнению с нормальным миометрием и преимущественным расположением сосудов по периферии узла миомы.
ФУЗ-МРТ-абляция особенно эффективна для лечения миомы матки вследствие высокого содержания экстрацеллюлярного матрикса, хорошо поглощающего тепло. Для доброкачественной опухоли нет необходимости элиминации каждой ее клетки, поэтому достаточно произвести коагуляцию в отдельных точках внутри миомы, что позволяет сократить объем миоматозных узлов и матки и тем самым уменьшить меноррагии, боли и давление на соседние органы малого таза, значительно улучшить качество жизни.
Продолжительность процедуры ФУЗ-абляции зависит от объема и количества узлов и в среднем составляет 3–4 часа. Эта процедура проводится амбулаторно, без общей анестезии, во время нее пациентка находится в сознании. После лечения пациентки обычно наблюдаются в стационаре в течение двух часов, что обусловлено только периодом действия седативных препаратов премедикации, и на следующий день уже трудоспособны.
Показаниями к ФУЗ-МРТ-абляции миомы матки являются: меноррагии, болевой синдром, симптомы сдавления соседних органов, размеры миоматозных узлов от 2 до 15 см, интерстициально-субсерозные, интерстициальные и интерстициально-субмукозные узлы, при количестве миоматозных узлов не более 5.
Противопоказаниями для ФУЗ-МРТ-абляции миомы следующие: субсерозные миомы на ножке, сочетанная гинекологическая патология — воспалительные процессы в малом тазу, бесплодие, образования в яичниках, гиперплазия эндометрия; онкологические заболевания, нереализованная репродуктивная функция, размеры миоматозных узлов менее 2 см, выраженное retroflexio-versio матки, грубые послеоперационные рубцы на передней брюшной стенке, ожирение II–III степени, тяжелые аллергические реакции на контрастные вещества, а также клаустрофобия, наличие крупных ферромагнитных имплантантов, наличие искусственных водителей ритма сердца (противопоказания для проведения МРТ).
Индивидуализация применения ФУЗ-МРТ-абляции миомы матки заключается в определении «доступности» миоматозных узлов для фокусированного ультразвука (предпочтительна локализация узлов по передней стенке и в дне матки), определении МРТ-типов миомы, необходимости проведения дополнительных манипуляций (висцеральный массаж, наполнение мочевого пузыря физиологическим раствором и т. д.), при этом интраоперационная эффективность ФУЗ-МРТ-абляции миомы снижается.
Обычно проводится либо «малая» процедура, при которой абляции подвергается около 30–35% объема миоматозного узла, либо «большая» — коагулируется не менее 70% объема. После «малой» процедуры не происходит значительного уменьшения размеров опухоли, тем не менее в 80% случаев отмечается значительная положительная динамика, исчезновение жалоб, болей и прекращение кровотечений. Кроме того, снижается пролиферативная активность миомы, и рост узлов прекращается. Это объясняется уменьшением плотности ткани после ФУЗ-МРТ-абляции — узлы становятся более «мягкими» и не оказывают выраженного давления на окружающие ткани. В настоящее время проводится лечение миом матки диаметром до 9 см, а в случае большого размера миомы — предварительная гормональная терапия в течение трех месяцев, с целью сокращения узлов и возможности проведения процедуры. Группой исследователей из США изучена безопасность и эффективность операций фокусированным ультразвуком под контролем МРТ для неинвазивного лечения лейомиомы матки [3, 24]. Согласно этим данным происходит уменьшение миомы через 3 мес на 37%, через 6 мес на 48% [19, 24]. За последние 2 года получено 30 беременностей у женщин, перенесших ФУЗ-МРТ-абляцию миомы матки и 13 родов без осложнений [26]. Среди осложнений ФУЗ-МРТ-абляции выделяют незначительную воспалительную реакцию (субфебрильная температура) и ожог I степени.
Таким образом, ФУЗ-МРТ-абляция имеет определенные преимущества по сравнению с малоинвазивными и инвазивными методами лечения:
-
легкопереносимая процедура — проводится в амбулаторных условиях, немедленное восстановление трудоспособности;
-
сохранение матки;
-
отсутствие комбинированного эндотрахеального наркоза;
-
отсутствие интраоперационной кровопотери и интра- и послеоперационных осложнений;
-
отсутствие постэмболизационного синдрома.
При определенных ситуациях (единичный или несколько миоматозных узлов, «доступных» узлах для абляции, при противопоказаниях для гормонального лечения) ФУЗ-МРТ-абляция может быть предпочтительнее, чем медикаментозное лечение.
Однако остаются дискуссионными следующие проблемы, требующие дальнейшего исследования:
-
применение ФУЗ-МРТ-абляции миомы матки у больных с нереализованной репродуктивной функцией.Для решения этой проблемы необходимо определить влияние ФУЗ-МРТ на процессы имплантации, на пролонгирование беременности;
-
рецидивирование миомы матки после ФУЗ-МРТ-абляции;
-
совершенствование техники проведения ФУЗ-МРТ-абляции (при различных локализациях миоматозных узлов).
Таким образом, можно предположить, что ФУЗ в недалеком будущем может стать безопасной альтернативой гинекологическим операциям — гистерэктомии, миомэктомии и эмболизации маточных артерий, позволяющей избежать всех многочисленных, связанных с этими операциями осложнений [2, 3, 19, 24].
Следующим направлением активного воздействия на опухоль являются так называемые малоинвазивные технологии. К ним относится миолиз и эмболизация маточных артерий. Миолиз (искусственное создание в опухоли нагноения, омертвения с помощью каутеризации) применяли достаточно давно известные хирурги ХIХ века. Новый виток в развитии этого метода был обусловлен внедрением в оперативную гинекологию лапароскопического доступа и использования различных источников энергии: лазеры, биполярная коагуляция, криовоздействие, высокочастотный ультразвук. Последним усовершенствованием метода стал отказ от лапароскопии и проведение чрезкожного миолиза с помощью лазера или криодеструкции под контролем МРТ. Несмотря на многочисленные исследования в течение последних лет, посвященных миолизу, этот метод широко не применяется в силу сложности контроля за разрушением ткани.
Другим видом лечения, относящимся к малоинвазивным технологиям, является эмболизация маточных артерий (ЭМА), предложенная в 1995 г. доктором Жаком Равина в качестве реальной альтернативы хирургическим операциям, представляет собой уникальный метод лечения миомы матки. Наблюдавшийся клинический эффект позволил авторам применить ЭМА в качестве альтернативы хирургическому лечению у больных с крайне высоким операционным риском. С 1997 года началось активное использование эмболизации маточных артерий в лечении миомы матки. К 2005 году в мире выполнено около 100 000 эмболизаций [21].
ЭМА основана на сокращении кровоснабжения всего миометрия (кратковременно) и миоматозных узлов (долговременно) путем окклюзии ветвей маточной артерии. Данная терапия позволяет воздействовать на лейомиому избирательно относительно окружающей ткани. Преимуществами этого вмешательства являются: сохранение матки, отсутствие кровопотери во время проведения процедуры, одновременное влияние на все миоматозные узлы, независимо от локализации, отсутствие комбинированного эндотрахеального наркоза, более краткий срок пребывания больной в стационаре и меньший риск развития осложнений. Доказана высокая эффективность ЭМА: уменьшение меноррагий — на 86–92%, уменьшение размеров матки (миоматозных узлов) — на 40–60%, регресс болевого синдрома у большинства больных. ЭМА считается малоинвазинным методом, несмотря на это для нее характерны побочные эффекты и осложнения. Побочные эффекты являются результатом выбранного способа лечения, поэтому они неотвратимы.
Постэмболизационный синдром различной степени интенсивности: лихорадочное состояние, тошнота, рвота, слабость, лейкоцитоз в сочетании с «разлитой» болью в абдоминальной области, возникает у 30–40% больных и купируется самостоятельно в первые 48 часов при условии консервативной терапии. Осложнения после ЭМА делятся на две группы: 1) ранние осложнения возникают во время или в раннем послеоперационном периоде и связаны непосредственно с методом; 2) поздние осложнения возникают в позднем послеоперационном периоде, к ним относятся прежде всего инфекционные осложнения, требующие проведения гистерэктомии (около 1% случаев). Двояко можно относиться к аменорее, возникающей примерно у 5% больных: для пациенток пременопаузального возраста, страдающих меноррагиями, это состояние является благоприятным исходом; для пациенток, желающих сохранить репродуктивную функцию, — это безусловно серьезное осложнение. Также и транцервикальная экспульсия миоматозного узла, отмеченная у 5–18% больных с субмукозной миомой матки, которая, как правило, протекает без значительного кровотечения. Таким образом, в настоящий момент мы можем констатировать, что показаниями к ЭМА при миоме матки являются все состояния, требующие хирургического лечения за исключением:
-
субсерозных миом на ножке;
-
сочетания миомы матки с воспалительными процессами органов малого таза, с образованиями в яичниках, с гиперпластическими процессами эндометрия, с заболеваниями шейки матки; с подозрением на саркому матки;
-
очетания миомы матки и бесплодия;
-
миомы матки у женщин с нереализованной репродуктивной функцией;
-
больных с почечной недостаточностью и с тяжелыми аллергическими реакциями.
Более предпочтительно проведение ЭМА, чем хирургическое вмешательство, у больных с ожирением, диабетом, гипертонической болезнью. Возможно и проведение ЭМА в качестве адъювантного этапа хирургического лечения при выраженной анемии, кровотечении или при миомах матки, соответствующих более 20–22 неделям беременности [18]. Также этот метод лечения обладает преимуществами по сравнению и с медикаментозным лечением, к которым относятся: одномоментность воздействия; сохранение длительное время эффекта процедуры и незначительный процент рецидивов, более высокая эффективность в отношении регресса симптоматики, размеров матки и узлов, отсутствие выраженных побочных эффектов, отсутствие ограничений по размерам лейомиомы матки, возможность проведения больным с экстрагенитальной патологией.
При сравнении результатов лечения ЭМА и ФУЗ-МРТ-абляции миомы наблюдается более выраженное уменьшение объемов матки (на 65,0–76,5%) и миоматозного узла (на 55–77,7%) после ЭМА через 12 мес [9], чем после ФУЗ-МРТ-абляции миомы (на 42,2% и на 37–48,7% соответственно [3, 19]. Качество жизни улучшается как после ЭМА, так и после ФУЗ-абляции миомы матки. Однако более полное и быстрое улучшение показателей качества жизни наблюдается после ФУЗ-абляции миомы матки в связи с особенностями техники проведения, т. е. отсутствием постэмболизационного синдрома, инвазии, анестезии, кровопотери во время процедуры, коротким сроком госпитализации, быстрым восстановлением трудоспособности и наличием минимальных осложнений. У пациенток с выраженной экстрагенитальной патологией: гипертоническая болезнь I–II стадии, варикозное расширение вен нижних конечностей, ожирение I, II степени, ЭМА и ФУЗ-МРТ-абляция миомы матки являются методами выбора с учетом противопоказаний к этим методам лечения. Однако необходим тщательный отбор пациентов с учетом всех показаний и противопоказаний, что позволит минимизировать возможные осложнения во время и после ЭМА и ФУЗ-МРТ-абляции миомы матки.
В заключение можно сказать, что именно развитие органосохраняющих неоперативных технологий в последние годы является приоритетным направлением в гинекологической практике европейских стран. Что касается медикаментозного лечения, то от применения некоторых препаратов (андрогены, гестагены), в связи с их неэффективностью, мы отказались, аналоги гонадолиберина, антигестагены являются препаратами выбора в наши дни, антифиброзная, антиангиогенная терапия — реальная альтернатива в ближайшем будущем. К сожалению, наши попытки медикаментозного лечения не позволяют на современном этапе полностью исключить необходимость гистерэктомии. ЭМА — перспективный метод, возможно, способный заменить хирургические методы воздействия, также как и ФУЗ-МРТ-абляция, однако эти методы требуют применения согласно строгим показаниям и противопоказаниям и с учетом технических ограничений. Наиболее перспективное направление — это будущие открытия в области генетики, которые позволят разработать не только неинвазивные методы лечения, но и схему превентивных мер, которые исключат необходимость в самом лечении. Закончить я бы хотела словами А. П. Губарева: «Оперировать фиброму только потому, что ее можно прощупать, еще нет оснований».
Литература
-
Вихляева Е. М. Руководство по диагностике и лечению больных лейомиомой матки. М.: МЕДпресс-информ, 2004. 400 с.
-
Кулаков В. И., Кира Е. Ф. Термическая абляция миоматозных узлов фокусированным ультразвуком — новый метод неинвазивной хирургии // Акуш. и гинекол. 2006. № 5. С. 3–5.
-
Курашвили Ю. Б., Мышенкова С. А., Шиповская Е. В., Лазуткина В. Ю., Степанов А. В. Патогенез воздействия ФУЗ-аблации на миому матки // Материалы V форума «Мать и дитя»: сб. науч. тр. М., 2007. С. 439–440.
-
Новикова Е. Г., Чиссов В. И., Чулкова О. В. Органосохраняющее лечение в онкогинекологии. М.: Видар, 2000. 112 с.
-
Миома матки (современные проблемы этиологии, патогенеза, диагностики и лечения)/Под ред. И. С. Сидоровой. М.: Медицинское информационное агентство, 2002. 256 с.
-
Степанова Е. В. Антиангиогенная терапия: новые возможности лечения злокачественных заболеваний // Практическая онкология. 2002. Т. 3. № 4. С. 246–252.
-
Baird D. D., Dunson D. B. Why is parity protective for uterine fibroids? // Epidemiology. 2003. Vol. 14. P. 247–250.
-
Bodner-Adler B., Bodner K., Czerwenka K. et al. Expression of p16 protein in patients with uterine smooth muscle tumors: an immunohistochemical analysis // Gynecol. Oncol. 2005. Vol. 96 (1). P. 62–66.
-
Boggs W. Uterine artery embolization effective long-term for leiomyomata // Obstet. Gynecol. 2005. Vol. 106. P. 933–939.
-
Chwalisz K., DeManno D. Therapeutic potential for the selective progesterone reseptor modulator asoprisnil in the treatment of leiomyomata // Semin. Reprod. Med. 2004. Vol. 22 (2). P. 113–119.
-
Cook J. D., Walker C. L. Treatment strategies for uterine leiomyoma: the role of hormonal modulation // Reprod. Med. 2004. Vol. 22. № 2.
-
Dixon D., Flake G. P., Moore A. B. et al. Cell proliferation and apoptosis in human uterine leiomyomas and myometria // Virchows Arch. 2002. Vol. 441. № 1. P. 53–62.
-
Healy D. L., Vollenhoven B., Weston G. Uterine fibroids. In: Shaw R. W., Soutter W. P., Stanton S. L., eds. Gynecology. 3 rd ed. Philadelphia: Churchill Livingstone, 2003. P. 479–494.
-
Liang Y., Hyder S. M. Proliferation of endothelial and tumor epithelial cells by progestin-induced vascular endothelial growth factor from human breast cancer cells: paracrine and autocrine effects // Endocrinology 2005. Vol. 146 (8). P. 3632–3641.
-
Luo X., Ding L., Xu J. et al. Leiomyoma and myometrial gene expression profiles and T response to gonadotropin releasing hormone analogue (GnRHa) therapy // Endocrinology. 2004. Vol. 16.
-
Manyonda I., Sinthamoney E., Belli A.-M. Controversies and challenges in the modern management of uterine fibroids // Br. J. Obstet. Gynaecol. 2004. Vol. 111. P. 95–102.
-
Martel K. M., Ko A. C., Christman G. M. et al. Apoptosis in Human Uterine Leiomyomas //Semin. Reprod. Med. 2004. Vol. 22, № 2.
-
Pron G., Bennett J., Common A. et al. The Ontario Uterine Fibroid Embolization Trial. Part 2. Uterine fibroid reduction and symptom relief after uterine artery embolization for fibroids // Fertil. Steril. 2003. Vol. 79. № 1. P. 120–127.
-
Rabinovici J. Pregnancies and Deliveries After MR-Guided Focused Ultrasound Surgery For the Conservative Treatment Of Symptomatic Uterine Fibroids: MRgFUS 2008-Selected scientific abstracts. Washington, 2008. 16 p.
-
Rein M. S. Advances in uterine leiomyoma research: the progesterone hypothesis // Environ. Health Perspect. 2000. Vol. 108 (Suppl. 5). P. 791–793.
-
Spies J. B., Pelage J. P. Uterine artery embolization and gynecologic embolotherapy. Zippincott Williams and Wilkins, 2005. P. 164.
-
Spitz I. M. Progesterone antagonists and progesterone receptor modulators // Expert. Opin. Investig. Drugs. 2003. Vol. 12 (10). P. 1693–1707.
-
Steinauer J., Pritts E., Jackson R. et al. Systematic review of Mifepristone for the treatment of uterine leiomyomata // J. Obstet. Gynecol. 2004. Vol. 103, № 6. P. 1331–1336.
-
Stewart E. A., Gostout B., Rabinovici J., Kim H. S. et al. Sustained relief of leiomyoma symptoms by using focused ultrasound surgery // Obstet. Gynecol. 2007. Vol. 110 (2). P. 279–287.
-
Strauss III J. K. Cell biology. In: Reproductive Medicine. Molecular, Cellular and Genetic Fundamentals / Ed. O. J. Bart, M. Fauser. 2003. P. 55–196.
-
Tempany C. M., Stewart E. A., McDannold N., Quade B. J., Jolesz F. A., Hynynen K. MRI-guided focused ultrasound surgery (FUS) of uterine leiomyomas: a feasibility Study // Radiology. 2003; 226: 897–905.
-
Wu X. Moleclular Mechanisms Involved In the Growth of Human Uterine Leiomyomas. Karolinska Institutet, Stockholm, Sweden, 2002.
-
Young, S. L., Al-Hendy A. Potential Nonhormonal Therapeutics for Medical Treatment of Leiomyomas. In: Uterine Leiomyomas: Options and Choices / Editor in Chief, B. R. Carr. Seminars in Reproductive Medicine. 2004. Vol. 22 (2). P. 121–130.
Т. Е. Самойлова, доктор медицинских наук, профессор
Перинатальный Медицинский Центр, Институт усовершенствования врачей Национального медико-хирургического центра им. Н. И. Пирогова, Москва
Контактная информация об авторе для переписки: tesamoylova@mail.ru
www.lvrach.ru