Миома этиология матки
Малая миома матки
Малая миома матки — доброкачественная гормонально-зависимая опухоль миометрия, возникает у женщин репродуктивного возраста (пик заболеваемости приходится на 40 лет). Миома матки составляет до 30% гинекологических заболеваний.
Современные представления о причине развитии миомы матки основаны на гормональной теории. Нарушения экскреции и метаболического превращения эстрогенов, а также соотношения фракций эстрогенов (преобладание эстрона и эстрадиола в фолликулиновую, а эстриола — в лютеиновую фазу) приводят к морфологическим изменениям в миометрии. Масса миометрия может увеличиваться в результате как гиперплазии гладкомышечных клеток, которая инициируется эстрогенами, так и гипертрофии этих клеток. Наряду с эстрогенами рост миомы стимулирует прогестерон.
Наряду с гормональными аспектами патогенеза малой миомы матки немаловажную роль играют изменения иммунной реактивности организма, особенно при наличии хронических очагов инфекции, выраженные изменения гемодинамики малого таза, а также наследственная предрасположенность.
По морфогенетическим признакам выделяют простые миомы, развивающиеся по типу доброкачественной мышечной гиперплазии, и пролиферирующие миомы с морфогенетическими критериями истинной доброкачественной опухоли. У каждой 4-й больной миома матки пролиферирующая, с быстрым ростом узлов. Количество патологических митозов в пролиферирующих миомах не превышает 25%.
Подозрение на саркому матки появляется при обнаружении в процессе гистологического исследования более 70% патологических митозов, а также при определении миогенных элементов с явлениями атипии и неоднородностью ядер клеток. Малигнизация миомы в саркому происходит менее чем в 1% клинических наблюдений. При субмукозном ее расположении риск малигнизации выше.
Классификация миомы матки
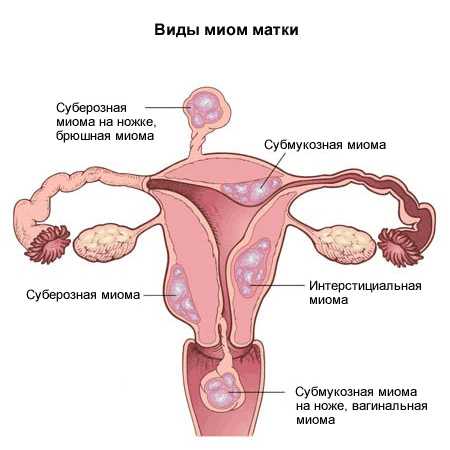
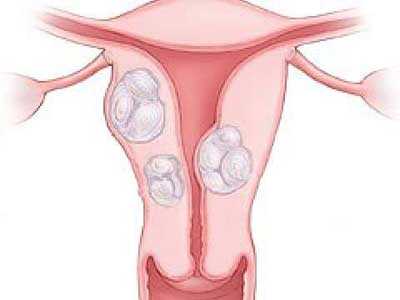
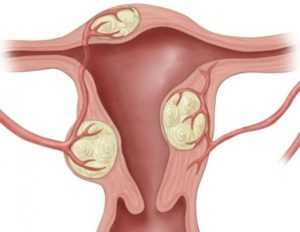
В зависимости от локализации и роста выделяют субмукозные (подслизистые) миоматозные узлы, растущие в полость матки и деформирующие ее, и субсерозные (подбрюшинные) узлы, растущие в сторону брюшной полости. Если по мере роста узел расслаивает листки широкой маточной связки, его называют интралигаментарным. Интерстициальные (межмышечные) узлы растут из среднего слоя миометрия и располагаются в толще миометрия.
Субмукозные миоматозные узлы могут характеризоваться различным топографическим расположением. В зависимости от локализации, ширины основания узла и величины интрамурального компонента выделяют следующие типы субмукозных миом:
- 0 тип — субмукозные узлы на ножке, без интрамурального компонента;
- I тип — субмукозные узлы на широком основании с интрамуральным компонентом менее 50%;
- II тип — миоматозные узлы с интрамуральным компонентом 50% и более. Для субсерозной миомы существует аналогичная классификация:
- 0 тип — субсерозный узел на ножке, без интрамурального компонента;
- I тип — интрамуральный компонент составляет менее 50% от объема узла, большая его часть является субсерозной;
- II тип — интрамуральный компонент представляет более 50% объема миоматозного узла, субсерозный компонент выражен мало.
Симптомы
Для субмукозной миомы характерны длительные, обильные менструации со сгустками (меноррагии), которые могут продолжаться в межменструальный период (метроррагии). Маточные кровотечения приводят к развитию анемии. Наряду с маточными кровотечениями бывают тянущие и схваткообразные боли внизу живота. В результате сокращений матки при 0 типе субмукозной миомы может произойти самопроизвольная экспульсия миоматозного узла. При рождающемся миоматозном узле боли бывают интенсивными и схваткообразными. Субмукозная миома матки нередко сопровождается бесплодием и невынашиванием беременности.
Отдельные субсерозные узлы малых размеров могут долго клинически ничем не проявляться, но по мере их увеличения возникают признаки нарушения питания опухоли, увеличивается вероятность перекрута ножки миоматозного узла. Пациентки могут жаловаться на дискомфорт внизу живота, периодически возникающие тянущие или острые боли. Боли могут иррадиировать в поясничную область, ногу, промежность. При совершившемся перекруте ножки миоматозного узла или возникновении обширной зоны некроза боли становятся интенсивными, появляются симптомы раздражения брюшины и общеклинические признаки «острого живота».
Интерстициально-субсерозные узлы менее подвержены деструктивным процессам вследствие нарушения питания, клинически долго не проявляются и могут достигать диаметра 10-25 см и более. Больных беспокоят ощущение тяжести и дискомфорта внизу живота, его увеличение. Болевой синдром связан с растяжением висцеральной брюшины матки, давлением миоматозных узлов на нервные сплетения малого таза. При нарушении кровообращения в миоматозных узлах боли острые. В зависимости от локализации субсерозных узлов возможно нарушение функции соседних органов. Рост узла кпереди способствует развитию дизурических явлений: больные жалуются на учащенное мочеиспускание, неполное опорожнение мочевого пузыря, императивные позывы к мочеиспусканию, острую задержку мочи. Перешеечное расположение узла на задней стенке матки приводит к давлению на прямую кишку и нарушает дефекацию. Субсерозные узлы, располагающиеся на боковой стенке матки в нижней и средней трети, при достижении большого размера изменяют топографию мочеточника, могут приводить к нарушению пассажа мочи на пораженной стороне, возникновению гидроуретера и формированию гидронефроза. Субсерозные узлы редко вызывают нарушение менструальной функции.
Интерстициальные узлы приводят к увеличению матки и могут заметно влиять на сократительную способность миометрия. У пациенток возникают жалобы на обильные длительные менструации, реже — на межменструальные кровяные выделения из половых путей. Однако прямой зависимости между размерами матки и появлением маточных кровотечений нет. Анемия у больных миомой матки может быть следствием хронических кровопотерь и острых маточных кровотечений. Без нарушений менструального цикла анемия может быть обусловлена депонированием крови в увеличенной миоматозными узлами матке. У пациенток с миомой матки (более 20 нед беременности) может возникнуть синдром, обусловленный сдавлением нижней полой вены, который проявляется сердцебиением и одышкой в положении лежа. Пациентки могут жаловаться на боли, увеличение живота, возможны острая задержка мочи, гидронефроз. При сочетании интерстициальных, субмукозных и субсерозных узлов клиническая картина многообразнее, чем при изолированных миоматозных узлах.
При двуручном гинекологическом исследовании пациенток с субмукозным расположением миомы тело матки может быть увеличено незначительно. У больных с рождающимся субмукозным узлом определяется сглаженность шейки матки, в цервикальном канале пальпируется округлой или овоидной формы узел плотной консистенции. Диагноз можно уточнить во время осмотра с помощью зеркал: миоматозный узел пролабирует из цервикального канала во влагалище, как правило, он белесоватого цвета, с выраженным сосудистым рисунком или петехиальными кровоизлияниями. Отдельные субсерозные миоматозные узлы пальпируются отдельно от матки как округлые плотные подвижные образования. Субсерозные узлы приводят к увеличению матки и изменению ее формы. Матка может достигать значительных размеров, ее поверхность становится бугристой, миоматозные узлы при пальпации плотные, а при нарушении кровообращения — болезненные. Интралигаментарные узлы определяются сбоку от матки и выполняют параметрий. Нижний полюс узла достижим при пальпации через боковой свод влагалища, он плотной консистенции, ограниченно подвижный при попытке смещения. У больных с интерстициальной миомой пальпируется плотная увеличенная матка с гладкой или бугристой поверхностью, как правило, безболезненная. В прошлом основным методом диагностики подслизистых узлов у пациенток с жалобами на обильные менструации, схваткообразные боли во время менструации и маточные кровотечения в постменопаузе была метрография. Рентгенологические признаки миомы матки: расширение или искривление ее тени, субмукозные миоматозные узлы определяются в виде дефектов наполнения с четкими контурами, чаще на широком основании.
В настоящее время одним из наиболее информативных методов диагностики миомы матки является эхография. Информативность УЗИ в диагностике миомы матки, по данным разных авторов, достигает 92,8-95,7%. Информативность УЗ-диагностики субмукозной миомы матки значительно возрастет с внедрением в практику внутриматочной эхографии с помощью специальных датчиков. Ультразвуковое сканирование позволяет обнаружить интерстициальные миоматозные узлы диаметром не более 8-10 мм. По данным УЗИ в зависимости от направления роста интерстициальных миоматозных узлов можно прогнозировать появление субмукозных и субсерозных миоматозных узлов.
Для уточнения топографического расположения миомы матки можно использовать ультразвуковые томографы, дающие трехмерное ультразвуковое изображение. Трехмерная реконструкция наиболее информативна для субмукозной локализации узлов, она позволяет также оценить сопутствующий гиперпластический процесс в эндометрии.
Гидросонография (ГСГ) — метод ультразвуковой диагностики, который используется для уточнения типа субмукозной миомы матки. ГСГ позволяет дифференцировать узел и полип эндометрия, более четко определить размер и локализацию подслизистого узла относительно перешейка и устьев маточных труб, а также оценить степень деформации полости матки. Важными моментами диагностики субмукозных узлов являются расположение интерстициальной части узла и близость латерального полюса к серозной оболочке матки. Все эти данные важны для выполнения миомэктомии субмукозных узлов с использованием транс-цервикального доступа. Для дифференциальной диагностики субсерозных узлов и опухолей забрюшинного пространства, увеличенных лимфатических узлов, опухолей малого таза и брюшной полости наряду с УЗИ применяют КТ и МРТ.
Гистероскопия позволяет с большой точностью диагностировать даже небольшие субмукозные узлы. Дефект наполнения в полости матки обычно выявляется при УЗИ или метрографии, но гистероскопия необходима для определения природы этого дефекта. Гистероскопия показана при появлении нарушений менструального цикла у пациенток с маткой, увеличенной не более чем до 12-13 нед беременности. При большем увеличении матки информативность гистероскопии снижается.
Для исключения патологии эндометрия и слизистой оболочки цервикального канала у пациенток с метроррагиями и контактными кровяными выделениями независимо от величины миомы матки проводится раздельное диагностическое выскабливание слизистой оболочки матки с последующим гистологическим исследованием соскоба.
Диагностическая лапароскопия показана при невозможности дифференциальной диагностики субсерозной миомы матки, опухолей брюшной полости и забрюшинного пространства неинвазивными методами.
Лечение
Вопрос о целесообразности лечения при малой миоме матки без клинических проявлений окончательно не решен. Тем не менее, таким пациенткам показано динамическое наблюдение у гинеколога с обязательным ультразвуковым контролем раз в год. Больным дают рекомендации, направленные на профилактику дальнейшего роста миомы и регуляцию гипоталамо-гипофизарно-яичниковых взаимоотношений. Пациенткам рекомендуют избегать тепловых процедур, им нельзя загорать на солнце и в солярии. Миома может увеличиться вследствие массажа и физиотерапии по поводу соматических заболеваний. С целью регуляции менструальной функции рекомендуется витаминотерапия по фазам менструального цикла (фолиевая кислота и витамины группы В в 1-ю фазу и витамин Е, аскорбиновая кислота — во 2-ю фазу) или использование гормональных контрацептивов. Предпочтительны монофазные эстроген-гестагенные препараты и низкодозированные гестагены.
Консервативная терапия миомы матки проводится с целью торможения роста или для обратного развития опухоли, лечения менометроррагий и анемии. С этой целью назначают прогестагены: норэтистерон, линэстренол, медроксипрогестерон. Под действием этих препаратов миома и соответственно матка уменьшаются в среднем на 1-2 нед беременности; уменьшается кровопотеря при менструации и нормализуется уровень гемоглобина. В репродуктивном возрасте прогестагены назначают циклически с 16-го по 25-й день менструального цикла или с 5-го по 25-й день в течение 6-24 мес. Как правило, клинический эффект удается получить при миоме, не превышающей 8 нед беременности. У пациенток перименопаузального возраста целесообразно использовать прогестагены в непрерывном режиме в течение 6 мес, тем самым способствуя медикаментозной атрофии эндометрия и наступлению менопаузы. Для создания медикаментозной менопаузы применяют также антигестагены — гестринон. Для лечения миомы матки в настоящее время апробирован антигестаген мифепристон (Ru486), однако еще не отработаны дозы препарата и сроки лечения.
На рост миоматозных узлов влияют а-ГнРГ (гозерелин, трипторелин, бусерелин). Под действием а-ГнРГ возможно уменьшение объема миоматозных узлов до 55%. Однако после прекращения приема препарата и восстановления менструальной функции у ряда больных начинается экспансивный рост миомы с признаками нарушения ее питания. Использование а-ГнРГ целесообразно у пациенток перименопаузального периода, поскольку обусловливает стойкую редукцию стероидогенеза, наступление менопаузы и, как следствие, купирование патологических симптомов малой миомы матки.
Агонисты ГнРГ используют для предоперационной подготовки к миомэктомии. Использование а-ГнРГ позволяет облегчить проведение миомэктомии и гистерэктомии у 76% больных из-за уменьшения матки и объема миоматозных узлов. При миомэктомиях после гормональной подготовки кровопотеря уменьшается на 35-40%.
С целью предотвращения менометроррагий и роста миомы применяют внутриматочную гормональную систему «Мирена», содержащую капсулу с левоноргестрелом (прогестаген). «Мирену» вводят на 5 лет, она обеспечивает регулярное поступление левоноргестрела в полость матки и местное действие на эндометрий и миометрий с минимальными системными эффектами. Менструации становятся скудными, в ряде случаев наступает медикаментозная аменорея. Однако данный метод лечения может быть предложен пациенткам с размерами матки, не превышающими 6-8 нед беременности. Использование «Мирены» противопоказано при субмукозной миоме, хронических воспалительных заболеваниях репродуктивной системы, фоновых процессах на шейке матки, а также у пациенток с абсолютными показаниями к оперативному лечению.
Но хирургическое удаление миомы матки остается ведущим методом лечения.
Прогноз
Миома матки относится к доброкачественным опухолям с редкой малигнизацией, поэтому прогноз для жизни благоприятный. Однако при росте миомы может потребоваться хирургическое лечение с исключением менструальной и репродуктивной функций у молодых женщин. Даже небольшие миоматозные узлы могут обусловить первичное и вторичное бесплодие.
Профилактика миомы матки
Профилактика заключается в своевременном выявлении заболевания на ранних стадиях и проведении патогенетически обоснованной терапии.
Полезно:
surgeryzone.net
Причины миомы матки, теория патогенеза миомы
За последние десять лет активное изучение миомы матки позволило существенным образом пересмотреть отношение к этому заболеванию. В данной статье подробным образом изложены все современные представления об этиологии и патогенезе миомы матки. В конце статьи сформулирована современная теория патогенеза этого заболевания.
На протяжении длительного времени этиология и патогенез миомы матки не отличались какой-либо конкретикой. Оставаясь “любимой патологией” гинекологов, склонных к хирургической деятельности, миома матки практически никогда не рассматривалось как заболевание, которое можно вылечить консервативно. В связи с этим тонкие вопросы этиологии и патогенеза объяснялись множеством общих и расплывчатых формулировок, подчас не имеющих никакого специфического характера. Суммируя все факторы и состояния, которые за долгие годы изучения миомы матки якобы играли роль в ее развитии и прогрессировании, невольно задаешься вопросом: что может быть общего между миомой матки и еще как минимум ста других, не только гинекологических заболеваний, поскольку выходит, что их этиологические и патогенетические спектры очень широко перекрываются. Уже такие этиологические предпосылки как “дисфункция системы гипоталамус – гипофиз-надпочечники – яичники” в совокупности с “нарушением гомеостаза и обмена веществ” можно смело отнести практически к любому патологическому процессу организма, за исключением разве что мозоли.
Однако, не надо забывать, что выше описанный “вакуум” теорий этиологии и патогенеза лейомиомы матки во многом объясняется отсутствием в предшествующие годы тех знаний и методик в молекулярно-генетической области, которыми мы располагаем в настоящее время. Помимо этого, важно также отметить, что в отличие от других патологических состояний, молекулярно-генетические исследования лейомиомы матки начались с некоторым опозданием и относительно меньшим исследовательским рвением. Несмотря на это, в вопросах этиологии и патогенеза лейомиомы матки совершен значительный прорыв вперед.
Первое и наиболее важное открытие, позволившее по-новому взглянуть на природу лейомиомы, стало выявление у миомы свойства моноклональности. Это доказывается гомозиготностью изоформ глюкоза – 6 фосфат дегидрогеназы в клетках миомы у гетерозиготных пациенток, и также подтверждается исследованиями Х связанного гена рецептора андрогена и Х связанного гена фосфоглицерокиназы различных клеток миомы. Таким образом стало ясно, что миоматозный узел растет из одной клетки, а при наличии в одной матке нескольких узлов, каждый из них развивается независимо друг от друга. Встал вопрос: как же образуется клетка предшественник, и что способствует ее возникновению.
В настоящий момент можно выделить две теории образования клетки предшественника. Первая – онтогенетическая, вторая – основывается на том, что вторичная соматическая мутация в нормальной клетке миометрия способствует образованию клетки предшественника.
Хотя гладкомышечные клетки входят в состав большинства органов и тканей человека миома матки в 95% случаев возникает в матке. Возникает очевидный вопрос – почему именно гладкомышечные клетки миометрия наиболее часто подвержены клональной пролиферации и откуда в миометрии возникает клетка-предшественик миомы матки.
Возможный ответ на эти вопросы может быть получен если мы рассмотрим три момента, связанные с природой гладкомышечных клеток. Первое – существует редкое заболевание – диссеменированный лейомиоматоз брюшины, который встречается только у женщин и ассоциирован с беременностью или приемом оральных контрацептивов. Это заболевание характеризуется появлением множества лейомиома-подобных узелков на брюшине всей брюшной полости, которые регрессируют в случае снижения уровня половых гормонов в крови. Эти узелки образуются из субперитонеальной мезенхимы вследствие пролиферации и дифференцировки гладкомышечных клеток и по своей чувствительности к колебаниям половых гормонов сходны с лейомиомой. Второй момент – особенность онтогенетического развития гладкомышечных клеток различных органов и тканей и третий – механизмы пролиферативного ответа клеток миометрия и миомы во время различных фаз менструального цикла и во время беременности.
Диссеминированный лейомиоматоз брюшины (ДЛБ)
Под диссеминированным лейомиоматозом брюшины понимают доброкачественное реактивное состояние, характеризующееся пролиферацией клеток субперитонеальной мезенхимы, обусловленное активностью половых гормонов. При этом заболевании наблюдается формирование множества лейомиома-подобных узелков различного размера (от микроскопических до 10 см в диаметре), которые располагаются на поверхности органов брюшной полости и малого таза, сальнике, брыжейке и париетальной брюшине. Узелки состоят из неизмененных гладкомышечных клеток или представляют собой смесь гладкомышечных клеток, фибробластов, миофибробластов и/или децидуальных клеток. Поверхность узелков покрыта мезотелием.
Мезотелий и ассоциированная с ним мезенхима фетального интраэмбрионального целома являются производными мезодермы, которые в последующем развиваются в брюшину и субперитонеальную строму соответственно. Инвагинация интраэмбрионального целома приводит к формированию парамезонефрального (Мюллерового) канала, из которого происходят маточные трубы, дно матки, шейка и верхняя часть влагалища. Общность эмбрионального происхождения производных Мюллерового канала и брюшины отражается в схожей с эндометрием реакцией брюшины и подлежащей ей стромы на воздействие эстрогенов и прогестерона. Клинически чувствительность субперитонеальной мезенхимы к половым гормонам проявляется в развитии эктопической децидуальной реакции в яичниках, брюшине, включая сальник и даже в лимфатических узлах малого таза. Предполагается, что клетки субперитонеальной мезенхимы по механизму метаплазии трансформируются стромально-подобные клетки эндометрия, децидуальные и гладкомышечные клетки. Таким образом, предполагается, что при развитии ДЛБ узелки формируются из субперитонеальной мезенхимы (возможно из недифференцированных мезенхимальных клеток) путем метаплазии.
В попытке изучить гистогенез лейомиомы матки Lipschutz и Vargas произвели эксперимент, в котором им удалось по средством введения высоких доз эстрогенов вызвать у гвинейских свиней развитие множества субперитонеальных узелков, напоминающих таковые при ДЛБ, , и что примечательно, после снижения уровня гормонов в крови произошел спонтанный регресс этих образований. На микроскопическом уровне эти узелки состояли из фибробластов. Однако, при добавлении к эстрогенам небольших доз прогестерона, состав узелков менялся, в нем появлялись гладкомышечные и децидуальные клетки, и тогда их сходство с узелками при ДЛБ становилось максимальным.
Результаты описанных выше исследований показывают, что воздействие эстрогенов на субперитонеальную мезенхиму является только начальным этапом формирования узелка. Для окончательного формирования этого образования необходимо синергичное воздействие эстрогенов и прогестерона, роль последнего при этом заключается в дифференцировки мезенхимальных клеток в децидуальные, миофибробласты и гладкомышечные клеток.
Таким образом, анализ случаев ДЛБ и экспериментальных моделей этого заболевания предполагает, что субперитонеальные гладкомышечные клетки имеют потенциал дифференцироваться как в гладкомышечные клетки, так и в стромальные клетки эндометрия, а так же формировать лейомиома-подобные узелки в ответ на воздействие половых гормонов. Так как по своему морфологическому строению узелки при ДЛБ и те, что были получены в результате эксперимента на животных имеют очень близкое сходство с лейомиомой можно предполагать, что лейомиома произрастает из недифференцированной мезенхимальной клетки, которая располагается в миометрии.
Развитие гладкомышечных клеток матки в процессе онтогенеза.
Эмбриональное развитие гладкомышеных клеток матки начинается с 18 недели гестации и заканчивается к 31 недели. К этому периоду миометрий уже полностью сформирован и четко отграничен от прилежащей стромы эндометрия. Интересно, что гладкомышечные клетки миометрия, как и фибробласто-подобные клетки стромального слоя эндометрия имеют одного и того же предшественника – недифференцированная клетка мезенхимы, при этом на ультраструктурном уровне эти клетки ничем не отличаются.
Механизмы, которые регулируют развитие и дифференцировку гладкомышечных клеток матки во время онтогенеза до сих пор не ясны. Дифференцировка мужских половых органов во время эмбрионального развития во многом контролируется андрогенами, в то время как этот же процесс в женском организме протекает автономно и не требует никаких внешних регуляторных факторов, ни от яичников ни из других источников.
По сравнению с гладкомышечными клетками матки (производные мезодермы), гладкомышечные клетки, являющиеся производными эндодермы, и формирующиеся в последующим в гладкомышечные клетки мочевого пузыря и желудочно-кишечного тракта имеют существенно более короткий период развития. Эти клетки полностью заканчивают свое формирование к 14 недели гестации. Более длительное развитие гладкомышечных клеток матки позволяет предполагать, что этот процесс контролируется совершенно другими регуляторными механизмами нежели в случае гладкомышечных клеток эндодермального происхождения. Недифференцированные клетки предшественники гладкомышеных клеток матки имеют в целом более длительный нестабильный период и, следовательно, большую подверженность патогенному воздействию различных материнских факторов, таких как половые гормоны и/или факторы роста.
Можно предполагать, что недифференцированные мезенхимальные клетки, поврежденные во время эмбрионального развития различными, неизвестными до сих пор, материнскими факторами, и являются теми самыми клетками-предшественниками миомы матки, которые в ответ на гормональные стимулы дают моноклональный пролиферат.
Матка, как ни один другой орган в человеческом организме, обладает огромным запасом физиологической пластичности. Во время беременности матка должна обеспечить возможность имплантации оплодотворенной яйцеклетки в свою стенку, обеспечить адекватный приток питательных веществ для роста плода, а так же обеспечить достаточный потенциал для изгнания плода по прошествии определенного периода времени и в последующем вернуться в то же состояние, какой она была до беременности. Для удачного развития всех описанных выше событий матка должна обладать способностью к стремительному увеличению своего размера и веса, что соответственно реализуется за счет пролиферации и гипертрофии клеток миометрия.
Во время фолликулярной фазы менструального цикла гладкомышечные клетки миометрия экспрессируют рецепторы как эстрогенов, так и прогестерона, в то же время индекс метки к Ki-67 (маркер пролиферирующих клеток) в этих клетках выражен скудно. Во время лютеиновой фазы экспрессия рецепторов прогестерона продолжается, а индекс метки Ki-67 немного возрастает. Во время беременности клетки продолжают экспрессировать рецепторы прогестерона, и отмечается существенное возрастание пролиферативной активности клеток. Экспрессия рецепторов эстрогенов во время лютеиновой фазы и во время беременности супрессируется. Следовательно, гладкомышечные клетки миометрия проявляют свою пролиферативную активность в основном во время лютеиновой фазы менструального цикла и в период беременности.
Как и гладкомышечные клетки миометрия, клетки миомы матки незначительно пролиферируют во время фолликулярной фазы менструального цикла; пролиферация заметно возрастает во время лютеиновой фазы цикла и в период беременности. Во время менопаузы, в лейомиоме матки обычно не выявляются делящиеся клетки.
Воздействие половых гормонов на эндометрий и миометрий имеет принципиальное различие, обусловленное разными функциональными задачами этих тканей. Так в эндометрии во время фолликулярной фазы цикла эстрогены стимулируют экспрессию рецепторов эстрогенов и прогестерона. Во время лютеиновой фазы прогестерон подавляет экспрессию обоих типов рецепторов, то есть ингибирует пролиферативные эффекты эстрогенов на ткань. В миометрии же, как уже было описано выше, наоборот, пролиферативные процессы в большей степени выражены во время лютеиновой фазы цикла и в случае развития беременности продолжаются и приобретают более выраженный характер.
Таким образом, во время каждой лютеиновой фазы менструального цикла в миометрии возрастает пролиферативная активность, проще говоря, матка настраивается на то, чтобы в случае развития беременности совершить “быстрый старт” – начать стремительно увеличиваться в размерах. Если беременность не наступает, пролиферативная активность миометрия затормаживается, что по времени совпадает с периодом менструации. Констрикция миометрия, направленная на остановку менструального кровотечения вызывает ишемию и гипоксическое состояние в ткани миометрия. Ишемия может затронуть и те гладкомышечные клетки, которые находятся в процессе митотического деления, что может привести к формированию дефектных клеток, становящимися в последствии клетками-предшественниками миомы матки.
Различные соматические мутации могут возникать в этих клетках в процессе многократного повторения менструального цикла. В таком случае, формирование миомы матки может рассматриваться как реакция на повреждение, по типу образования келоидного рубца или образования атеросклеротической бляшки в ответ на повреждение сосудистой стенки. Важно подчеркнуть, что повреждающим агентом может быть не только ишемия, развивающаяся во время менструации, но и другие факторы, к которым в частности относятся воспалительные процессы в матке, аденомиоз, а также различные травматичные медицинские манипуляции (аборты, выскабливания полости матки, кесарево сечение и пособие в родах и послеродовом периоде).
Можно предположить, что ишемия, во время менструации в меньшей степени является основным причинным факторов возникновения дефекта в делящейся гладкомышечной клетке миометрия. Скорее всего ишемия является разрешающим фактором или усиливающим элементом, при наличии другого, основного травмирующего агента. Именно факт многократного воздействия ишемии на поврежденную ткань может играть решающую роль.
Травматическое воздействие.
Как известно, травматическое воздействие на любую ткань, в том числе на миометрий активизирует процесс репарации. Однако известно, что каждая ткань имеет характерные особенности репаративного процесса. Так и гладкомышечная ткань проявляет ряд специфических отличий.
Еще давно было замечено И.В.Давыдовским ( ), что “…регенерация гладкой мускулатуры в принципе несколько отлична от регенерации других тканей, во-первых, тем, что она осуществляется не за счет воспроизведения из себе подобных элементов, а путем метаплазии, то есть превращения фибробластов соединительной ткани; во-вторых она тесно связана с функциональным состоянием данного органа или организма, являясь фактически компенсаторно-приспособительной реакцией”.
За последнее десятилетие было проведено множество исследований, посвященных изучению “поведения” гладкомышечных клеток в ответ на повреждение как in vitro так и in vivo. В связи с тем, что наиболее удобной моделью изучения гладкомышечных клеток (ГМК) in vivo являются сосуды, большинство работ выполнено именно на этом материале. Не менее важно также отметить, что ряд исследователей проводят параллели между механизмами развития атеросклеротической бляшки в стенке сосуда и миоматозным узлом в матке.
Переходя к триггерной роли травматического воздействия в патогенезе миомы матки, необходимо выделить два вида механического повреждения миометрия: вследствие различных медицинских вмешательств и “баллонный” механизм повреждения сосудов матки при возбуждении женщин с неполноценной половой функцией (аноргазмия, дисгармоничные половые контакты) и застойным полнокровием органов малого таза. Как отмечалось выше, вслед за повреждением в гладкомышечной ткани начинается процесс репарации. Однако известно, что этот процесс может приобретать патологический характер. К примеру, в случае повреждения области миометрия, содержащей клетки предшественники (клетки имеющие хромосомные аберрации), нормальные физиологические процессы, характерные для неизмененных клеток, могут иметь характер избыточности за счет нарушения внутренних регуляторных механизмов.
Эндометриоз
Другим триггерным фактором, способным запустить процесс образования миоматозного узла, может являться эндометриоз, а точнее аденомиоз. Известно, что вокруг очаговых и узловых форм аденомиоза всегда выявляется гиперплазия гладкомышечной ткани и довольно часто развивается миома. Помимо этого, частота совместной встречаемости эндометриоза и лейомиомы матки у одной пациентки достаточно велика и доходит, по данным отдельных авторов, до 60%. Тем не менее, помимо этих косвенных доказательств причастности аденомиоза к патогенезу лейомиомы матки существуют исследования, на молекулярно-генетическом уровне показывающие возможные механизмы участия эндометриоидных эксплантов в инициации роста лейомиомы. К таким фактам относится выявление хромосомных аберраций в очагах эндометриоза, характерных исключительно для лейомиомы, избыточная экспрессия различных факторов роста, цитокинов, рецепторов гормонов в эндометриоидном экспланте, которые играют важную роль в патогенезе лейомиомы, и локальная продукция которых в области миометрия, содержащей компетентные клетки, может явиться инициатором роста миоматозного узла.
Инфекция
Известно, что воспалительные заболевания половых органов давно бесславно занимают первое место среди всех гинекологических заболеваний. Установлено, что более чем у 1/3 больных лейомиомой матки заболеванию предшествовали и сопутствовали воспалительные изменения в придатках матки, у 60% – различные сочетания воспалительных заболеваний органов малого таза. Чаще всего, воспалительный процесс распространяется восходящим путем. Неадекватное и несвоевременное лечение, как известно, приводит к хронизации процесса. Помимо этого, различные внешние факторы, такие как аборты, роды, хирургические и диагностические вмешательства, способствуют возникновению и поддерживанию воспалительных процессов.
Определению роли инфекции, как триггерного фактора в патогенезе лейомиомы матки способствовало выявление характерной реакции миометрия при развитии в матке миометрита. Оказалось, что при этом острые формы миометрита протекают нередко с дистрофией и дисфункцией гладко-мышечных волокон. Если процесс стихает, то развивается картина хронического миометрита с наличием круглоклеточных инфильтратов, разрастанием соединительно-тканных волокон. Нередко это приводит к появлению в толще матки фиброзной ткани. Морфологические характеристики изменений происходящих в миометрии при развитии хронического воспаления очень похожи на морфологическую картину миомы. Помимо этого, при тщательном морфологическом исследовании маток, пораженных эндомиометритом, вокруг воспалительных очагов выявлялись зачатки миоматозных узлов.
Обнаружив и оценив указанные выше факты, нами было предпринято исследование, направленное на выявление наличия некоторых микроорганизмов в миоматозных узлах. С помощью ПЦР – методики были выявлены в миоматозных узлах специфические фрагменты ДНК хламидий, микоплазм и уреаплазм, причем в некоторых узлах отмечалась кооперация нескольких возбудителей. Несмотря на полученные данные, однозначно утверждать инфекционную природу данного заболевания, конечно, нельзя, поскольку известно, что для этого необходимо доказательство триады Коха.
Таким образом хронический воспалительный процесс способен также создать благоприятный фон для инициации роста миоматозного узла, за счет изменения клеточного и молекулярного баланса в области миометрия, содержащего компетентные клетки.
Рассматривая выше различные этиологические теории, мы упоминали о наличии хромосомных аберраций в клетке предшественнике миомы. Для лучшего понимания основных этапов патогенеза этого заболевания ниже мы дадим генетическую характеристику лейомиомы.
Генетическая характеристика лейомиомы матки
Итак, как уже упоминалось выше, первое и главное открытие в области цитогенетики миомы стало выявление свойства моноклональности данного образования. Таким образом, показано, что множественные миоматозные узлы в одной матке гомозиготны, униклеточны и имеют независимое происхождение. Происхождение из одной клетки предполагает существование кариотипических изменений в клетке предшественнике.
В 1994 году были опубликованы данные о цитогенетиечском исследование более 500 миоматозных узлов и только у 40% из них были обнаружены хромосомные изменения. Наиболее частыми аберрациями были: – делеция длинного плеча хромосомы 7 с дефектом между 7q21 и 7q36; – транслокация t(12;14) (q15;q23-24); – перестановка 6p21 – трисомия 12 хромосомы – перестановка 10q22 – перестановка 13q21-22
– делеция 3q
Помимо этого, среди миом с нарушенным кариотипом встречаются миомы, имеющие мозаичный тип нарушений, и что интересно, миомы с мозаичным кариотипом тоже являются моноклональными. Подобные находки заставили исследователей придти к заключению, что цитогенетические аберрации могут быть вторичными, а клональный рост миомы может начинаться раньше появления хромосомных аберраций.
Описанные хромосомные аберрации, встречающиеся в миомах располагаются в различных областях генома, где расположены гены, вероятно, участвующие в патогенезе данного образования. В связи с тем, что только 40% лейомиом имеют хромосомные аберрации, в остальных 60% – генетические нарушения тоже должны присутствовать, но характер их пока не уточнен.
Известно, что различные хромосомные нарушения реализуют разные патологические механизмы. Исходя из этого, можно заключить, что, вероятно, рост и развитие миоматозного узла может протекать различными путями.
Рассматривая различные хромосомные аберрации, встречающиеся в миоме, исследователи решили акцентировать внимание на регионе q15 12 хромосомы. Это регион часто повреждается в миомах в процессе транслокации t(12;14) (q15;q23-24). Причиной повышенного внимания исследователей к этой хромосомной аберрации явился тот факт, что подобная аберрация часто встречается в множестве других доброкачественных образований, таких как липомы, легочная хондроидная гамартома, полипы эндометрия и др.
В процессе исследования региона 12q15, был выявлен ген HMGIC, который по мнению авторов может являться наиболее вероятным кандидатом на роль основного гена, ответственного за развитие лейомиомы и других образований указанных выше. Помимо этого, в 6 хромосоме в регионе р21, который, как известно, также часто подвержен повреждению в миоме, обнаружен очень похожий по структуре ген HMGIY.
Продуктом экспрессии генов HMGIY и HMGIC являются белки, отнесенные к различным семействам группы высокоподвижных белков (high mobility group proteins), которые являются хроматин – ассоциированными негистонными белками, первоначально получившими свое название вследствие высокой электрофоретической подвижности в полиакриламидном геле. В дальнейшем было выявлено, что эти белки играют важную роль в регуляции структуры и функции хроматина. Помимо этого они ответственны за правильность трехмерной конфигурации комплекса ДНК с белком, то есть участвуют в таких клеточных процессах, как транскрипция ДНК.
Аберрантная экспрессия HMGIC и HMGIY белков чаще всего характеризует злокачественный процесс. В то время как дисрегуляция этих белков вследствие хромосомных перестроек, наиболее часто выявляется в различных доброкачественных мезенхимальных образованиях, таких как липома, легочная гамартома, полип эндометрия, а также и в миоме. При исследовании 33 миоматозных узлов в 16 из них была обнаружена высокая экспрессия HMGIC и HMGIY, при полном отсутствии экспрессии этих белков в окружающем миометрии. С помощью иммуногистохимических методик было установлено, что экспрессия этих белков ограничена только гладкомышечными клетками миомы и не распространяется на гладкомышечные клетки сосудов миомы и клетки соединительной ткани.
Дальнейшее изучение HMGIC и HMGIY белков выявило, что они экспрессируются практически во всех органах и тканях во время онтогенеза (надпочечники, аорта, кости, мозг, сердце, кишечник, почка, легкое, печень, мышцы, яичники, плацента, кожа, селезенка, желудок, яички и матка), в то время как во взрослом организме экспрессия этих белков выявлена только в легких и почках. Помимо этого, HMG белки экспрессируются при выращивании in vitro клеточных культур выше указанных тканей.
Подобный характер экспрессии HMGIC и HMGIY белков указывает на их участие в быстром росте эмбриональных тканей. Очевидно, что возобновление экспрессии этих белков в лейомиоме есть следствие дисрегуляции соответственных генов.
Таким образом, подводим итог: лейомиома матки – моноклональна, то есть растет и развивается из одной клетки. При наличии нескольких миоматозных узлов в одной матке, каждый из них растет независимо друг от друга. Около 40% лейомиом имеют хромосомные аберрации, которые, вероятно, могут иметь вторичный характер. Наиболее частые хромосомные аберрации это: t(12,14)(q15; q23-24) и перестановка в 6р21. Многие мезенхимальные доброкачественные образования также часто имеют эти хромосомные аберрации. В регионах указанных выше хромосомных аберраций находятся гены HMGIC и HMGIY в 12 и 6 хромосомах соответственно. Продукты экспрессии этих генов являются белками различных семейств группы высокоподвижных белков, играющие важную роль в различных клеточных процессах, в частности, таких как транскрипция ДНК. Помимо этого эти белки ответственны также за быстрый рост тканей в процессе онтогенеза и росте ткани in vitro. Возобновление экспрессии этих белков в лейомиоме – есть следствие дисрегуляции соответственных генов, и вероятнее всего, вследствие патологического стимула или триггерного фактора.
Итак, патогенез миомы матки можно представить следующим образом: клетка предшественник, которая в дальнейшем даст клон клеток миомы возможно образуется двумя путями. Первый связан с онтогенетическими нарушениями, второй – подразумевает возникновение соматической мутации уже зрелого миоцита. В итоге, миоцит с хромосомной аберрацией подвергается воздействию сложного каскада факторов, вызывающих митоз этой клетки, что в свою очередь способствует распространению этой хромосомной аберрации.
К основным факторам, участвующим в инициации и поддержании роста миомы относятся эстрогены, прогестерон и факторы роста. Между эстрогенами и прогестероном существует синергизм. Роль эстрогенов можно условно обозначить как “вспомогательную”, в то время как, прогестерон, вероятно является ключевым митогеном для миомы. Помимо этого, прогестерон, видимо, способствует росту миомы, удлиняя интервал жизни клетки, путем защиты ее от апоптоза.
Факторы роста являются медиаторами действия половых гормонов, стимулируя пролиферацию миомы, а также вызывают продукцию и перестройку экстрацелюллярного матрикса. Этот процесс вероятнее всего инициируется макрофагами, инфильтрирующими область зачатка миомы и выделяющими TNF и интерлейкин-1. Эти цитокины активируют экспрессию ГМ-КСФ, что приводит к избыточной продукции TGF клетками миомы. В дальнейшем TGF становится “дирижером” сложных биологических процессов, направленных на повышение синтеза ЭЦМ. Воздействуя на фибробласты TGF вызывает экспрессию в них CTGF – фактора роста стимулирующего выработку ЭЦМ. Альтернативно, TGF способствует транформации фибробластов в миофибробласты, также активно продуцирующие компоненты соединительной ткани.
Стимулируя активность ингибитора активатора плазминогена, TGF инактивирует протеолитическую систему, что угнетает ремоделирование ЭЦМ. Соучастником TGF в регуляции этой системы выступает bFGF. При этом известно, что ЭЦМ является резервуаром bFGF, то есть увеличение количества ЭЦМ приводит к увеличению bFGF, что представляет собой один из возможных порочных кругов, вовлеченных в патогенез миомы. Регулировать одну из важнейших коопераций в этом процессе, между TGF и CTGF, возможно способны цАМФ и TNF. Однако ингибирующее действие последнего ослабляется конкурентным механизмом блокирования взаимодействия TGF и CTGF.
Ключевыми факторами роста в патогенезе миомы матки являются EGF, IGF-I, bFGF, TGF, CTGF. Механизм их действия аутокринно/паракринный. Факторы роста способны оказывать свой эффект независимо от половых гормонов, что на определенных стадиях развития миомы может указывать на возможность наличия автономности данного образования. Возможность локальной продукции эстрогенов в лейомиоме и окружающем миометрии, также является важным фактором поддержания роста миомы.
Миома матки не злокачественное новообразование, хотя ей присуща такая характеристика как автономность, однако понимать этот термин в случае миомы матки следует несколько иначе.
Очевидно, что с самого начала, на стадии зачатка роста, миома матки всецело зависит от состояния миометрия, то есть наровне с неизмененной тканью отвечает на гормональные, метаболические и локальные стимулы, разве что ответ зачатка миомы несколько избыточен вследствие дисрегуляции отдельных генов, обусловленных хромосомными аберрациями.
С определенного момента локальное накопление продуктов избыточного ответа зачатка миомы на физиологические стимулы, речь в частности идет о факторах роста и ферментах, участвующих в трансформации андрогенов в эстрогены, начинает формироваться автономный процесс. Яичниковые гормоны перестают в полной мере, как это было прежде “управлять ситуацией”, поскольку постепенно происходит становление локальных механизмов, поддерживающих рост миомы. Преобладание процесса фиброза приводит к формированию фенотипического варианта – фибромиома, в то время как повышенная активность ферментов, участвующих в локальном синтезе эстрогенов, обусловит развитие клеточных, пролиферирующих или причудливых миом. Чаще же всего, эти два автономных процесса сбалансированы и мы сталкиваемся с типичной или обычной миомой матки.
Выше мы говорили, что миома матки по своей природе имеет сходство с такими образованьями как атеросклеротическая бляшка, липома, фиброма, легочная гамартома, келлоидный рубец и др. На первый взгляд, очевидность их сходства кажется сомнительной, однако если брать во внимание особенность органа и/или ткани, в которой происходит развитие этих образований, то многое проясняется. Миометрий, в отличии от других тканей, о которых речь шла выше, находится под постоянным влиянием гормонов, изменяющих его пластические свойства. Повышенная митотическая готовность и фенотипическая пластичность – именно эти свойства “достаются по наследству” миоме, что в последующем и определяет кажущееся различие миомы с перечисленными выше образованьями.
www.sovetginekologa.ru
Почему возникает миома матки и как ее лечат
Оглавление: [скрыть]
- Причины и профилактика
- Симптомы миоматоза матки
- Осложнения при миоматозе
- Лечение миоматоза матки
- Чего не следует делать
Одним из самых широко распространенных гинекологических заболеваний является миома матки. Статистические исследования показывают, что хотя бы раз эта опухоль возникает у каждой четвертой женщины в России. Что такое миома матки? Это патологическое изменение мышечного эпителия, в результате которого в гладких мышцах матки формируется узел. Размеры опухолей значительно различаются по величине, они могут достигать от нескольких миллиметров до 10 см. Рекорд за всю историю изучения заболевания принадлежит миоме, которая весила 63 кг. Почему возникает миоматоз матки? Какими профилактическими мерами можно уберечь себя от миомы?

Причины и профилактика
Патогенез миомы матки все еще недостаточно изучен, несмотря на повсеместное распространение этого заболевания. Ученые обнаружили следующие предпосылки, которые могут спровоцировать развитие миомы:
- множественные хирургические аборты, которые нарушают целостность мышечного эпителия матки, в результате чего образуются узлы;
- гормональные нарушения — в 70% случаев миома обнаруживается у женщин старше среднего возраста после наступления климакса;
- нарушение кровообращения в органах малого таза, вызванное малоподвижным образом жизни;
- повышенный индекс массы тела, ожирение;
- эндокринные заболевания;
- сахарный диабет;
- нарушения менструального цикла, болезненность и позднее начало менструации;
- невынашивание беременности до положенного срока.
Существует прямая связь между формированием миомы и гормональным фоном женщины. Гинекология чутко реагирует на все нарушения в работе эндокринной системы.
В случае недостатка эстрогенов вероятность появления миомы увеличивается, в случае переизбытка прогестерона — уменьшается. Сбалансированная выработка эстрогенов и прогестерона не является гарантией отсутствия миомы, но снижает возможность ее возникновения. Часто миома обнаруживается у женщин с геморрагическим синдромом, нарушением свертываемости крови, поэтому женщины с таким заболеванием должны особенно внимательно относиться к своему самочувствию. Очень маленькие миомы практически не вызывают никаких симптомов, поэтому для обнаружения следует применить УЗИ. В профилактических целях во время планового осмотра у гинеколога женщинам старше 45 лет следует настаивать на УЗИ, особенно если их тревожат изменения характера менструации. Исходя из каких признаков можно заподозрить миому?
Вернуться к оглавлению
Виды миомы матки по количеству новообразований подразделяются на:
Профилактические осмотры у гинеколога рекомендуется проводить раз в полгода всем женщинам старше 35 лет — только так можно обнаружить миому на раннем этапе формирования опухоли. При увеличении размеров узла признаки будут различаться в зависимости от конкретного типа опухоли.
Пролиферирующая миома матки — это разновидность узлов, которые за счет своего клеточного состава растут быстрее других, то есть их развитие осуществляется за счет очень быстрого деления клеток опухоли. Классификация миомы матки по месту расположения:
- Субмукозная. Опухоль располагается близко к поверхности мышечной ткани, обладает тонкой ножкой, может распространяться из полости матки в шейку, а затем во влагалище. Рост узлов может происходить и только внутри матки, не покидая ее полость. По причине опухоли менструальный цикл удлиняется и сопровождается повышенным объемом выделений. Часто перед началом менструации женщины ощущают сильную боль внизу живота, по своему характеру напоминающую схватки.
- Интерстициальная. Опухоль залегает глубоко в слоях мышечной ткани. Негативное влияние этой разновидности миомы приводит к удлинению менструального цикла и делает месячные более обильными. Поражение тела матки препятствует нормальному сокращению во время менструации, что приводит к чувству боли, спазмов и дискомфорта.
- Субсерозная. Опухоль прикрепляется снаружи мышечного корсета матки со стороны брюшной полости. В большинстве случаев узел крепится на длинной ножке, которая может перекрутиться, что спровоцирует отмирание тела опухоли. Это создает опасность некроза непосредственно в брюшной полости. Без своевременной диагностики и лечения при некрозе миомы развивается перитонит, который создает угрозу для жизни женщины.
- Интралигаментарная миома. Обычно это множественные мелкие узлы в тканях широкой связки матки.
- Миома шейки. Все узлы располагаются только в шейке, в том числе и главный узел.
По степени распространенности 60% всех диагностированных миом обнаруживаются в глубоких слоях мышечного корсета. Существует также смешанная разновидность миомы, при которой множественные узлы имеют различное расположение. Этиология и патогенез миомы матки позволяют сделать вывод о том, что только своевременное медицинское вмешательство может остановить рост опухолей и уберечь женщину от таких осложнений, как перитонит. Лечение народными методами является потерей времени, которое можно было бы использовать для реальной помощи. Каковы самые распространенные жалобы при миоме матки?
- болезненный и удлиненный ПМС;
- боль при начале и во время менструации;
- боль даже в отсутствие менструации;
- характер боли: тянущий, ноющий, спазматический, острый, колющий, пульсирующий;
- во время перекручивания ножки боли становятся очень интенсивными и острыми;
- присутствие опухоли увеличивает длительность цикла;
- объем выделений возрастает;
- большие по размерам узлы оказывают давление на мочеиспускательный канал, что приводит к затруднению полного опорожнения мочевого пузыря;
- узлы могут оказывать давление на стенку прямой кишки, что приводит к сужению просвета и затрудняет дефекацию;
- присутствие множественных узлов затрудняет прикрепление яйцеклетки, по этой причине развивается бесплодие;
- геморрагический синдром в сочетании с повышенным объемом менструального кровотечения приводит к анемии.
У нерожавших женщин за счет меньшей эластичности стенок матки часто встречаются жалобы на ощущение давления внизу живота или дискомфорта от присутствия какого-то объекта.
Любое изменение характера менструации по сравнению с обычным должно быть поводом для консультации у гинеколога.
При подозрении на миому следует обратиться к квалифицированному врачу, а не применять способы народной медицины. Регресс опухоли, если он возможен, происходит при изменении гормонального фона. Коррекция осуществляется только под наблюдением компетентного специалиста.
Вернуться к оглавлению
Самым опасным для жизни осложнением является некроз тела опухоли, который может развиться из-за сдавливания или перекручивания ножки или из-за снижения объема крови, питающей опухоли. Сужение сосудов вызывает кислородное голодание, а затем отмирание тканей. В результате начинается разложение опухоли непосредственно рядом с живыми тканями организма.
Продукты распада попадают в кровь, вызывают симптомы интоксикации и провоцируют воспалительный процесс. Если опухоль расположена снаружи матки, развивается перитонит, который требует срочной госпитализации в отделение реанимации. Если опухоль располагается в шейке или в полости матки, некроз сопровождается обильным кровотечением и сильной болью, в таком случае женщину госпитализируют в гинекологическое отделение. Некроз может спровоцировать развитие сепсиса. В каких случаях следует немедленно обратиться в скорую помощь?
- если внизу живота появляется острая боль;
- если открывается массивное кровотечение;
- если температура повышается выше 39 градусов, сопровождается тошнотой, головной болью, слабостью и болью в нижней части живота;
- если женщина, которая жаловалась на боли в животе, внезапно теряет сознание, и ее не удается привести в чувство.
Большая часть летальных исходов вызваны тем, что женщины не обращаются к врачу за помощью при первых признаках миомы. Значительные по размеру опухоли создают серьезный дискомфорт при мочеиспускании и дефекации. Возникает застой мочи, поскольку мочевой пузырь опорожняется не до конца. На фоне сдавливания прямой кишки регулярно появляются запоры, каловые массы скапливаются в кишечнике, что приводит к вторичному всасыванию и интоксикации. Крупные по размерам опухоли следует устранять как можно скорее, чтобы обеспечить нормальное выведение мочи и кала из организма. Другое распространенное осложнение, которое способствует выявлению миомы, это невозможность забеременеть. Для прикрепления яйцеклетки к стенке матки требуется гладкое и богатое кровеносными сосудами место, которое могло бы обеспечить плод всеми необходимыми питательными веществами.
Если стенки слизистой поражены узлами, яйцеклетка не обнаруживает подходящей площадки для прикрепления и покидает полость матки вместе с плановыми месячными. Если в течение года регулярной половой жизни без контрацепции женщине не удается забеременеть, следует обратиться к гинекологу и выяснить причину бесплодия. По статистике, большинство мелких миом матки обнаруживаются именно тогда, когда пациентки обращаются с жалобой на отсутствие беременности.
Вернуться к оглавлению
Некоторые опухоли по неизвестным причинам самостоятельно останавливают свой рост, иногда возникает даже регресс на фоне изменений гормонального состояния женщины. Другие опухоли отличаются агрессивным и быстрым ростом. Составить прогноз в каждом конкретном случае поможет лечащий врач. Все гормональные препараты, которые назначаются для уменьшения миомы, подбираются строго индивидуально. Длительность курса определяется реакцией со стороны опухоли, дозировка подбирается в зависимости от особенностей течения заболевания. Для диагностики используются следующие методы:
- УЗИ;
- компьютерная томография;
- лапароскопия;
- гистероскопия;
- биопсия и гистологическое исследование.
Заболевание устраняется либо консервативно, либо оперативно. Если женщина планирует беременность, рекомендуется быстрая и щадящая операция — миомэктомия.
В этом случае повреждения мышечного корсета матки будут минимальными. При множественных и больших по размерам узлах проведение миомэктомии либо невозможно, либо затруднено.
Миомэктомия проводится с помощью малоинвазивного доступа через стенку брюшной полости. Послеоперационное восстановление всегда включает в себя обезболивающие и нестероидные противовоспалительные средства, которые могут снизить вероятность осложнений.
Все изъятые из организма ткани отправляются в лабораторию для проведения гистологического исследования. Заключение специалистов позволяет достоверно подтвердить, что опухоль является именно доброкачественной миомой.
Пожилым женщинам, которые не планируют беременность, обычно назначается консервативное лечение гормональными средствами. Зачем нужно лечить миому, если женщина не планирует беременность?
- Никто не может предсказать, насколько быстро будет происходить разрастание опухоли;
- при неблагоприятном расположении отмирание опухоли представляет опасность для жизни женщины любого возраста, особенно пожилой;
- множественные и крупные узлы миомы отрицательно сказываются на здоровье кишечника, мочевого пузыря, всех органов малого таза, что сокращает время жизни и ухудшает ее качество.
Вернуться к оглавлению
Пожилые женщины часто не доверяют достижениям современной медицины и начинают самостоятельно лечить миому лекарственными травами, святой водой, гомеопатическими препаратами.
Любые альтернативные способы воздействия на опухоль, особенно если их клиническая эффективность не доказана, могут применяться только с одобрения квалифицированного врача.
В противном случае ни один специалист не может дать гарантии, что у пациентки не будет таких осложнений, как заражение крови.
Оцените статью:
(Нет голосов) Загрузка...lecheniemiomy.ru
Современные аспекты этиологии и патогенеза миомы матки
Меглей Сергей
Бендеры, Молдавия
megley@rambler.ru
Одним из самых распространенных в гинекологической практике невоспалительных заболеваний является миома матки. Согласно современным представлениям, миома матки не является истинной опухолью. По мнению Е. В. Коханевич и соавт. (1998, 1999), ее следует рассматривать как доброкачественную, гормонально контролируемую гиперплазию мышечных элементов мезенхимального происхождения. От 20 до 40% женщин в возрасте старше 35 лет врач сообщает этот диагноз при очередном осмотре. Более половины оперативных вмешательств в гинекологических отделениях выполняются по поводу миомы матки.
Е.М. Вихляева и соавт. (1997) выделяют следующие факторы риска, способствующие возникновению миомы матки: позднее менархе, обильные менструации, высокая частота медицинских абортов, наличие экстрагенитальной патологии (особенно сердечно-сосудистой) и гинекологических заболеваний.
В литературных источниках приводятся следующие данные о сочетании миомы матки с экстрагенитальными заболеваниями: ожирение - в 64% наблюдений, заболевания сердечно-сосудистой системы - 60%, нарушения со стороны желудочно-кишечно-печеночного комплекса - 40%, гипертоническая болезнь - у 19% больных, неврозы и неврозоподобные состояния - 11%, эндокринопатии - в 4,5% наблюдений. Исследования, проведенные B.T. Kamioski et al. (1993), показывают, что избыточный вес в сочетании с низкой физической активностью и высокой частотой стрессов относятся к факторам, способствующим развитию данного заболевания. При оценке риска возникновения миомы матки прослеживается генетическая предрасположенность к развитию данного заболевания .
Морфологическому изучению миомы матки посвящено большое количество исследований. Согласно классическим работам по морфологии женской репродуктивной системы, проведенным еще в 30-е годы К.П. Улезко-Строгановой, образование зачатков миоматозных узлов происходит на эмбриональном этапе, что подтверждается последними исследованиями. По данным S. Fujii (1992) развитие систем гладкомышечных клеток мезодермального происхождения (мюллеров проток) в течение внутриутробного периода происходит до 30 недель, в то время как дифференцировка гладкомышечных клеток эндодермального происхождения (желудочно-кишечного тракта) заканчивается в 12 недель. Недифференцированные клетки, которые затем пролиферируют и дифференцируются в гладкомышечные клетки матки, в течение длительного периода внутриутробного развития могут подвергаться воздействию многочисленных факторов из организма матери (тропных гормонов, половых стероидов, факторов роста) и окружающей среды. Малодифференцированные клетки, подвергшиеся воздействию внешних факторов в течение внутриутробного развития, становятся предшественниками миом. Клетки-предшественники сохраняются в миометрии и начинают расти после менархе. Их рост продолжается в течение многих лет на фоне выраженной активности яичников под действием как эстрогенов, так и прогестерона. В то же время в результате некоторых исследований установлено, что образование зачатка миоматозного узла может происходить из трансформированных гладкомышечных клеток миометрия и мышечной оболочки сосудов матки. По мнению M.S. Rein et al. (1995), неопластическая трансформация миометрия в миому происходит под влиянием соматических мутаций нормального миометрия, половых стероидов и местных факторов роста. Несмотря на то, что миоматозные клетки проявляют морфологическое сходство с клетками миометрия, современные исследования выявили отличия в структуре метаболизма этих тканей.
Развитие миом происходит из зон роста, расположенных обычно вокруг тонкостенного сосуда. Изначальные клетки миомы дифференцируются в миофибробласты, которые затем трансформируются в миобласты и фибробласты.
В морфогенезе миомы матки выделяют три последовательные стадии соответственно особенностям ее структурных компонентов и характеристикам тканевого обмена: 1.образование активной зоны роста (зачатка) в миометрии с активированным клеточным метаболизмом; 2.рост опухоли без признаков дифференцировки; 3.рост опухоли с дифференцировкой и созреванием.
Возможно, что определенную роль в развитии заболевания играет нарушение нервно-мышечной регуляции миоматозных узлов. Г.А. Савицкий и соавт. (1986), проведя исследования узлов миом матки методом выявления холинэстераз, контактно-микроскопическим и флюоресцентным методами, установили, что в миоматозных узлах не обнаруживаются холин- и адренергические нервные структуры. Это дало авторам основание утверждать, что узел миомы матки является абсолютно денервированным образованием.
В настоящее время выделяют простые и пролиферирующие миомы матки, последние встречаются у каждой четвертой больной с миомой матки. Миогенные элементы в пролиферирующих миомах не атипичны, но более многочисленны в сравнении с миомами без признаков пролиферации. Отмечено, что в простых миомах митозы отсутствуют, а в пролиферирующих миомах митотическая активность повышена. В этой связи И.А. Яковлева и Б.Г. Кукутэ (1976; 1979) отмечают, что пролиферирующие миомы в два раза чаще встречаются у больных с быстрорастущими опухолями, чем при умеренном или медленном темпе роста опухоли. Авторы считают, что выделение двух форм миомы матки по особенностям гистогенеза имеет важное практическое значение, особенно при выборе врачебной тактики.
Г.А. Савицкий соавт. (1987) полагают, что увеличение массы миомы матки за счет митотического деления - процесс, встречающийся достаточно редко, поскольку даже в самых “подозрительных” пролиферирующих миомах митотический индекс не превышает 3%.
С целью объективной оценки темпов роста миомы, обусловленных процессом пролиферации гладкомышечных клеток, Г.А. Савицкий и соавт. (1994) провели анализ синтеза ДНК методами авторадиографии и цитофотометрии метода. Проведенные исследования позволили сделать следующее заключение: гипертрофия миоцитов миомы является одним из основных процессов, влияющих на скорость увеличения массы опухоли.
Несмотря на то, что миоматозные клетки проявляют сходство с клетками миометрия, современные исследования выявили отличия в структуре и метаболизме этих тканей .На основе исследования ультраструктуры миомы матки Г.И. Брехманом, А.А. Мироновым (1986) была предложена следующая трактовка процессов, происходящих в миоматозной матке: сначала расстройства микроциркуляции и нарастание тканевой гипоксии обусловливают компенсаторные изменения в гладкомышечных клетках (увеличение гладкой цитоплазматической сети, возрастание числа митохондрий, их набухание и др.), затем наступает декомпенсация (ишемические зоны в митохондриях, липидное перерождение, слипание миофибрилл, вакуолизация ядра, диффузный отек); в последующем развивается отек и начинается разрушение клеток. Дистрофические изменения в опухоли рассматриваются авторами не как осложнения в процессе развития последней, а как звенья единого процесса. Помимо этого имеются данные, что дистрофические изменения в ткани опухоли нарастают из-за денервации миоматозных узлов, в которых не обнаруживаются холин- и адренергические нервные структуры. Недавние исследования молекулярной биологии гладкомышечных клеток опухолей матки с использованием технологии анализа ДНК подтвердили их моноклональность .
Патогенез миомы матки остается спорным и вызывает много вопросов. Существующие теории развития заболевания опираются на результаты лабораторных исследований и объясняют в той или иной степени некоторые звенья патогенеза данной патологии.
Л. Н. Василевская (1980) выделяет три патогенетических варианта развития миомы матки: с вовлечением в патологический процесс гипоталамо-гипофизарной системы, с выраженными нарушениями функции яичников и преимущественными изменениями функции матки. У больных отмечается гиперсекреция ФСГ на 5–7-й день менструального цикла и ЛГ на 14-й день с одновременным снижением экскреции ЛТГ на 21–22-й день цикла, эстрогенов и прегнандиола — на протяжении всего менструального цикла. Участие в патологическом процессе гипоталамо-гипофизарной системы подтверждается частым сочетанием миомы матки с дисгормональными заболеваниями молочных желез и нарушением функции щитовидной железы. Определенную роль играют изменения функции печени, железодефицитная анемияи др. факторы.
В развитии миомы матки исключительное значение придается генетическим факторам (предполагается аутосомно-рецессивный тип наследования).
Различия в характере мутаций доброкачественных миом и лейомиосарком позволяют предположить, что развитие узла изначально идет по одному из двух гистологических путей, и этот принцип можно применить для ранней диагностики и прогнозирования роста опухоли.
Одно из центральных мест в проблеме патогенеза миомы матки занимает вопрос об особенностях гормонального статуса и функциональном состоянии репродуктивной системы по мере развития заболевания. Проведенные исследования показали, что у 2/3 больных гормональные параметры менструального цикла не отличаются от соответствующих нормативных показателей. У больных с недостаточностью лютеиновой фазы (НФЛ) и с ановуляторными циклами отмечаются изменения в содержании в крови ФСГ и ЛГ, зависящие в большей степени от функционального состояния репродуктивной системы, чем от наличия опухоли матки.
R. Maheux et al. (1988), M.N. Neuman et al. (1991), Y. Watanabe et al. (1992) сообщают, что назначение агонистов гонадолиберина (декапептид, образующийся в ядрах медиального гипоталамуса) приводит к существенному снижению уровней эстрогенов и прогестерона и уменьшению размеров миомы матки. Принято считать, что этот эффект обусловлен влиянием агонистов гонадолиберина на клетки-гонадотрофы аденогипофиза, секретирующие ФСГ и ЛГ. Однако в последние годы получены данные, в значительной мере дополняющие эту точку зрения. В своих исследованиях M. Marinaccio et al. (1994), обнаружили в ткани миоматозных узлов и нормального миометрия специфические точки связывания гонадолиберина, что указывает, по мнению авторов, на возможность прямого действия гонадолиберина и его агонистов на ткань миомы и миометрия.
Предполагается, что соматотропин (гормон роста) также может играть роль инициатора развития миомы матки. Это подтверждается тем, что у женщин с акромегалией чаще возникают миомы матки. Наличие мРНК-рецептора соматотропина в ткани миометрия и миомы подтверждает возможность действия соматотропина непосредственно на миометрий, а не через синтез в печени инсулиноподобного фактора роста 1.
В последние годы появляется все больше исследований, посвященных пролактину. Исследуя особенности выделения пролактина при миоме матки, Е.М. Вихляева и соавт. (1997), Г.А. Паллади (1986) установили, что у больных моложе 40 лет содержание пролактина в плазме находится в пределах доверительного интервала нормы здоровых женщин, а у больных старше 40 лет - в значительной мере превышает ее. Установлено, что клетки миомы матки также секретируют пролактин. Однако роль этого гормона в патогенезе миомы матки и его влияние на рост опухоли еще уточняются. По данным E.A. Stewart et al. (1996) блокатор прогестеронных рецепторов RU 486 подавляет синтез пролактина в миоматозных узлах и в нормальном миометрии. Авторы полагают, что поскольку RU 486 вызывает торможение роста миоматозных узлов у определенной группы больных, пролактин, наряду с прогестероном, может быть одним из факторов роста миоматозных узлов.
Традиционное мнение о ведущей роли эстрогенов в патогенезе миомы подтверждается данными современных исследований . Содержание рецепторов эстрадиола и прогестерона в ткани миомы выше, чем в неизмененном миометрии и подвержено циклическим изменениям. После длительного лечения (3 - 4 мес.) агонистами гонадолиберина (гипоталамический рилизинг-фактор) отмечается уменьшение объемов миоматозных узлов и значительное снижение содержания рецепторов эстрогенов в миометрии и тканях миомы, что подтверждает гипотезу о роли эстрогенов в патогенезе миомы. Cодержание эстрогенов при миоме матки изучалось многими исследователями, однако выводы, к которым они пришли, оказались противоречивыми. По мнению ряда исследователей значение имеет не столько количество выделяемых эстрогенов, сколько нарушение их экскреции и метаболического превращения, а также нарушение качественного соотношения между фракциями эстрогенов. Проведенные Г.А. Паллади и соавт. (1986) исследования показали, что экскреция эстрогенов в суточной моче у больных миомой матки зависит от величины опухоли и характера менструального цикла. При этом авторы отмечают, что преобладающей фракцией эстрогенов является эстриол, эта особенность значительно выражена у больных с тенденцией к росту опухоли. Авторы считают, что преобладание эстриола (E3) в сумме эстрогенов приводит к более выраженным изменениям миометрия, о чем свидетельствует появление быстрорастущих миом без нарушения менструального цикла. При повышенном содержании эстрадиола(E2) повреждается эндометрий и клиническая картина характеризуется небольшими размерами опухоли и кровотечениями.
В то же время за последние годы накоплены данные, что прогестерон наряду с эстрогенами стимулирует рост миомы матки. Оба этих гормона принимают участие в патогенезе миом, используя противоположные пути. В течение фолликулярной фазы эстрогены усиливают экспрессию генов, которые в норме активны в миометрии при развитии беременности. По данным Г.А. Савицкого и соавт. (1994) увеличение массы миометрия может происходить как за счет гиперплазии гладкомышечных клеток, которая инициируется эстрогенами, так и за счет гипертрофии этих клеток. Однако процесс гипертрофии ГМК, аналогичный процессу их гипертрофии во время беременности, может возникать только при сочетанном воздействии сравнительно высоких концентраций эстрадиола и прогестерона. В течение лютеиновой фазы прогестерон повышает митотическую активность миомы, особенно у молодых женщин. Кроме того, по мнению J. Аndersen (1996), прогестерон может воздействовать путем индуцирования продукции факторов роста и их рецепторов. По данным S. Lamminen et al. (1992) миомы наиболее активно пролиферируют в секреторную фазу менструального цикла. При этом индекс митотической активности в клетках пременопаузальных миом значительно выше, чем в постменопаузе. Японские ученые S. Casterday, D. Grimes, J. Ridds (1983), изучив влияние эстрадиола и прогестерона на ткань миомы сделали вывод, что прогестерон участвует в процессе дифференцировки гладкомышечной клетки миомы.
Ткань миомы содержит значительно больше рецепторов к эстрадиолу и прогестерону, чем нормальная ткань матки. Это указывает на этиопатогенетическую роль прогестерона в развитии миомы матки и подтверждается высоким митотическим индексом в клетках ткани миомы в лютеиновую фазу. По данным O. Sadan et al. (1988) содержание эстрогенных рецепторов в миоме и нормальном миометрии не имеет существенных отличий, но содержание прогестеронных рецепторов в миоме выше, чем в обычном миометрии. На основании проведенных исследований обнаружено, что все ткани матки у женщин, страдающих миомой матки, реагируют на колебания уровня половых гормонов изменением концентрации своих рецепторов; эстрадиол индуцирует образование сначала своих рецепторов, а подъем уровня прогестерона в крови приводит к снижению и эстрогенных и прогестеронных рецепторов. Отмечено, что величина индукции рецепторов в миометрии значительно меньше, чем в эндометрии. Авторы полагают, что это связано с тем, что эндометрий гораздо сильнее, чем миометрий, реагирует на гормональные влияния изменением своей массы. По особенностям концентрации рецепторов эстрадиола и прогестерона и их реакции на изменение гормональной стимуляции в течение цикла миома значительно ближе к эндометрию, чем к миометрию. Это, возможно, обусловливает ее большую, чем у миометрия, потенцию роста при одинаковом уровне гормонемии.
Присутствие эпидермального фактора роста (EFG), инсулиноподобного фактора роста-1 (IFG-1) и фактора роста тромбоцитов (PDGF AB) обнаруживается в тканях миомы вместе с их рецепторами. Повышенное содержание факторов роста и их рецепторов в миоматозной матке, регулирующих процессы васкуляризации, приводит к возникновению патологических кровотечений. Предположительно основную роль в этом процессе играют фактор роста фибробластов, сосудистый эндотелиальный фактор роста, трансформирующий бета-фактор роста, паратиреоидный гормоноподобный протеин и пролактин. Существующие схемы лечения женщин с кровотечениями, связанными с миомой, основываются главным образом на применении стероидных гормонов. По мнению М. Piva, О. Flieger, V. Rider (1996) факторы роста проявляют наивысшую пролиферативную активность в присутствии прогестерона. Углубленное понимание патогенеза данного патологического процесса, позволяет повысить эффективность лечения, направленного на коррекцию содержания факторов роста в ткани опухоли. Патологическим стимулом, способным нарушить баланс факторов роста, может быть очаг эндометриоза в миометрии, вокруг которого, особенно при очаговой и узловой форме, всегда выявляется гиперплазия мышечной ткани и довольно часто развивается миома матки.
По мнению А.Л. Тихомирова (1998) результаты морфологических и иммуногистохимических исследований тканей матки свидетельствуют, что формирование “зон роста” миомы происходит вокруг воспалительных инфильтратов и эндометриоидных эксплантатов в миометрии.
Многочисленные исследования указывают на изменения иммунного статуса женщин с миомой матки. Они касаются дифференцировки иммунокомпетентных клеток, синтеза интерлейкинов, интерферонов, активности системы комплемента и др. Активность гуморального и клеточного иммунитета снижена при быстром росте миомы, сопутствующих хронических инфекционных заболеваниях придатков матки, гиперпластических процессах в эндометрии, анемии и другой экстрагенитальной патологии. По данным H.Y. Huang et al. (1990) наблюдается достоверная отрицательная корреляционная связь между уровнем эстрадиола в сыворотке крови и активностью Т-киллеров. На основании этого, автор предполагает, что снижение активности клеточного иммунитета может играть определенную роль в патогенезе миомы матки.
Приводимая в публикациях частота сочетания миомы матки и гиперпластических изменений эндометрия колеблется от 30,1% до 58%. По данным Е.М. Вихляевой, Г.А. Паллади (1982) миома матки сочетается с железистой гиперплазией эндометрия у 25% больных, с атипической гиперплазией - у 10,7%, раком эндометрия - у 7% больных. Однако, по мнению Б.И. Железнова (1980), Д.В. Якубович и Н.И. Кондрикова (1980), гиперплазия эндометрия, относящаяся к числу наиболее распространенных патологических процессов матки, не может не сочетаться с миомой матки в том или ином проценте наблюдений. В соответствии с представленными данными возникает вопрос о том, следует считать сочетанную патологию эндо- и миометрия случайным совпадением различных процессов, либо рассматривать их единым состоянием репродуктивной системы, проявляющимся гиперпластическими изменениями гормонально-зависимых органов. Согласно мнению ученых, изучающих гиперпластические процессы гормонально-зависимых органов репродуктивной системы, однотипность преморбидного фона у пациенток с различными сочетаниями доброкачественных заболеваний эндо- и миометрия предполагает сходство патогенетических механизмов их развития. По мнению Е.В. Уваровой (1989) этим, вероятно, можно объяснить нередкое последовательное выявление указанных патологических состояний в течение жизни женщины. Приведенные в исследованиях Е.В. Уваровой (1989) доказательства системности поражения при сочетанных гиперпластических заболеваниях эндо- и миометрия могут быть дополнены данными литературы, свидетельствующими о выраженных изменениях гуморального и клеточного звеньев иммунитета у подобных больных. Оценивая состояние эндометрия у больных миомой матки, следует рассматривать комплекс факторов, способных приводить к патологическим изменениям. Последние отчасти связаны с формой и ростом опухоли, а в основном обусловлены возрастными и индивидуальными (преморбидными) особенностями организма, включая эндокринный статус. Частота возникновения гиперпластических процессов в слизистой матки зависит от длительности существования опухоли.
Фундаментальные исследования группы ученых под руководством Г.А. Савицкого, итогом которых явилось издание монографии “Миома матки. Патогенетические и терапевтические аспекты” (1994), показали, что решающим фактором, индуцирующим развитие гиперпластических процессов эндометрия и миомы матки, является локальная гиперэстрадиолемия, несбалансированная локальной гиперпрогестеронемией. По мнению авторов, миома матки в условии естественной ановуляции является фактором риска ускоренного развития гиперпластических процессов эндометрия. Вместе с тем, данные ряда исследований, выполненных в онкогинекологических клиниках, свидетельствуют, что в климактерическом и постменопаузальном периодах жизни женщины наличие миомы матки расценивается как фактор высокого риска малигнизации эндометрия.
Таким образом, современные исследования существенно расширяют наши представления о факторах риска и механизмах развития миомы матки. Комплексный подход в изучении миомы матки позволяет получить новые данные о распространенности и причинах данного заболевания.
Лечение:
Лечение миомы — консервативное и оперативное. По мнению C. R. Garsia et al. (1997), большинству пациенток хирургическое лечение не показано и «все, что нужно — это наблюдение до наступления менопаузы». Тогда рост опухоли прекращается и нередко наблюдается ее обратное развитие. Г. А. Савицкий (2000) считает, что «во многих странах миома матки стала основой коммерциализации гинекологических учреждений именно вследствие необычайной либерализации показаний для удаления детородного органа».
Поэтому весьма важно четко определить показания к оперативному лечению, которое может быть как консервативным (миомэктомия), так и радикальным (гистерэктомия, син. экстирпация матки). Согласно рекомендациям Американского общества акушеров-гинекологов, показания к консервативной миомэктомии имеются у пациенток, имеющих бесплодие или повторное невынашивание беременности. Такие миомы должны быть достаточно большими или иметь характерную локализацию, что потенциально может привести к описанным проблемам. Также должны отсутствовать более вероятные причины бесплодия и невынашивания. Перед выполнением данной операции необходимо исключить прочие причины бесплодия и невынашивания (проводится исследование полости матки и маточных труб, например, гистеросальпингография). Также следует объяснить пациентке (и оформить это документально!), что в случае распространенности патологического процесса и невозможности удаления узлов может возникнуть необходимость в гистерэктомии. В практической деятельности миомэктомии отдают предпочтение, если пациентка хочет сохранить репродуктивную функцию или «просто иметь матку». Большинство авторов считают миомэктомию более щадящей операцией, поскольку она предусматривает сохранение матки. Однако иногда при хаотическом расположении множественных узлов целесообразность сохранения органа весьма сомнительна. Кроме того, некоторые авторы считают, что миомэктомия сравнительно с гистерэктомией сопровождается большей кровопотерей и во время нее чаще возникает необходимость в гемотрансфузии (что, естественно, увеличивает общий риск вмешательства). После операции пациентки больше страдают от боли, дольше выздоравливают и требуют более продолжительной госпитализации. Хотя эти оценки в определенной мере дискутабельны. До 25% женщин, перенесших консервативную операцию, особенно при множественных узлах, в дальнейшем нуждаются в гистерэктомии в связи с повторным ростом опухоли. Даже при наилучших условиях миомэктомия сопровождается риском развития рубцовых изменений матки и других органов малого таза, что может вызвать бесплодие. При беременности, которая наступает впоследствии, повышен риск разрыва матки. У этих пациенток родоразрешение целесообразно осуществлять путем кесарева сечения, а интервал от операции до наступления беременности должен быть не менее 6 месяцев
Критерии к гистерэктомии при миоме матки (согласно рекомендациям Американского общества акушеров — гинекологов) определяют, что эта операция показана при наличии, по крайней мере, одного из следующих условий:
бессимптомные миомы больших размеров, которые пальпируются через живот и вызывают дискомфорт у пациентки;
выраженные маточные кровотечения:
-
профузное кровотечение, или выделение сгустков крови, или повторные затяжные менструации продолжительностью более 8 дней;
-
анемия, обусловленная острой кровопотерей;
-
дискомфорт в области малого таза, вызванный миоматозными узлами:
-
острая выраженная боль;
-
сопровождается постоянным ощущением давления внизу живота или в пояснице;
-
сопровождается давлением на мочевой пузырь с частыми позывами на мочеиспускание, не связанными c инфекцией мочевых путей.
Данная операция противопоказана, если женщина стремится сохранить репродуктивную функцию (в таких случаях целесообразна миомэктомия), и не рекомендуется при бессимптомных миомах размерами менее 12 недель беременности.
Резюмируя изложенное, следует согласиться с мнением большинства авторов, что при наличии безусловных показаний к оперативному лечению миомы его следует осуществлять, не тратя время и средства на консервативное лечение, которое либо вовсе не поможет, либо даст временное улучшение. Если же в этой ситуации больная отказывается от операции, медикаментозная терапия становится вынужденной альтернативой операции. Когда отсутствуют показания к оперативному лечению, ведущее значение приобретает консервативная терапия, целью которой является торможение роста опухоли.
Согласно рекомендациям К. М. Малевича и П. С. Русакевича (1994), задачами лечения является: 1.восстановление нарушенных соотношений в гипоталамо-гипофизарной системе, 2.устранение (уменьшение) сопутствующего воспалительного процесса (Обязательно у всех пациенток необходимо брать мазок на выявление хламидий, микоплазм, уреаплазм и др. в связи с определенной ролью генитальной инфекции в патогенезе миомы матки), 3.нормализация функции яичников, 4.улучшение состояния миометрия. Консервативное лечение приемлемо и достаточно эффективно в любом возрасте до наступления менопаузы, но особенно в репродуктивном периоде. Оно должно быть комплексным и направленным на различные звенья патологического процесса с учетом выявленных нарушений. На всех этапах наблюдения и лечения больных с миомой матки необходимо соблюдение максимальной онкологической настороженности.
Показания к консервативному лечению миомы матки
Клинически малосимптомное и бессимптомное течение заболевания.
Расстройства менструального цикла типа менометроррагий, не приводящие к анемизации женщины.
Миома матки в сочетании с тяжелой экстрагенитальной патологией, являющейся противопоказанием к хирургическому лечению.
Сочетание миомы матки с хроническим воспалительным процессом внутренних гениталий, клетчатки малого таза при условии отсутствия гнойно-воспалительных образований, частых обострений и прогрессирующего течения воспаления.
Сочетание миомы матки с аденомиозом, эктоцервикальным эндометриозом шейки матки.
Особенности локализации опухоли и клинического течения:
а) интерстициальные, межмышечные и субсерозные миоматозные узлы на широком основании независимо от их величины;
б) множественная узловатая миома матки, по величине не превышающая 12–13 нед. беременности;
в) интерстициальные миоматозные узлы, пролаббирующие в полость матки, или субмукозные — на широком основании, не приводящие к анемизации больной;
г) одиночные субсерозные узлы на ножке без перекрута и нарушения питания в молодом возрасте, при нежелании подвергнуться операции.
Консервативное лечение как предварительный этап подготовки к предстоящей консервативной миомэктомии или как этап восстановительного лечения после удаления миомы матки.
Для консервативного лечения применяются медикаментозные препараты различных фармакологических групп:
-
антианемические препараты (препараты железа);
-
седативные препараты (растительные транквилизаторы валериана, новопассит, персен, малые нейролептики феназепам, френолон, комбинированные препараты белласпон, беллатаминал);
-
адаптогены и иммунокорректоры (экстракт элеутерококка, эхинацеи, метилурацил, продигиозан, декарис и др.);
-
ингибиторы простагландинсинтетазы (НПВС) — например, индометацин по 25 мг 2 раза в день после еды во 2 фазу менструального цикла курсами по 2 месяца с интервалами 6 месяцев);
-
витамины (А, С, Е, комбинированные поливитаминные препараты с микроэлементами, особенно с медью, цинком, йодом;
-
препараты йода (внутрь и в виде электрофореза 1–2% раствора калия йодида);
-
антибактериальная терапия по строгим показаниям — в период обострения воспалительного процесса; диета, фитотерапия, немедикаментозные методы лечения (аппаратная физиотерапия, бальнеотерапия, ЛФК и др.).
Одним из основных патогенетических методов консервативного лечения миомы матки является гормональная терапия.
Некоторое время назад предлагалось применение различных сочетаний андрогенов (тестостерона пропионат, метилтестостерон), гестагенов (прогестерон, прегнин) и тономоторных (питуитрин, гифотоцин, маммофизин) препаратов. В последнее время использование андрогенов значительно ограничено в силу частого возникновения выраженных побочных действий (вирильный синдром, аменорея, огрубение голоса и др.).
Значительно более эффективно применение комбинированных эстроген — гестагенных препаратов (КОК) по контрацептивной схеме кратковременными (по 3–4) месяца курсами или «чистых гестагенов» (норколут, примолют-нор, оргаметрил, дуфастон, утрожестан и др.). Отмечается уменьшение менструальной кровопотери, улучшение общего состояния, торможение роста и уменьшение размеров опухоли, нормализация водно-солевого обмена. При сохраненном менструальном цикле гестагены назначаются в дозе 5–10 мг/сут с 16-го по 25-й день цикла в течение 4–6 мес., в пременопаузе — в той же дозе в непрерывном режиме в течение 3 мес. Выраженным гестагенным эффектом обладает ОПК (17-оксипрогестерона капронат 12,5% масляный раствор), который назначают по 1–2 мл внутримышечно на 16–21-й или на 14–17–21-й дни менструального цикла в течение 4–6 мес. В пременопаузальном периоде ОПК применяется с целью прекращения менструальной функции и назначается по 125 мг (1 мл 12,5% раствора) на 5–14–17–21 дни менструального цикла. Медроксипрогестерона ацетат (МПА), выпускаемый в виде препаратов провера и депо-провера (депонированная форма), подавляет секрецию гонадотропинов, блокирует эстрогенные рецепторы матки, вызывает состояние выраженной гипоэстрогении, что приводит к атрофическим и псевдодецидуальным изменениям в эндометрии. МПА назначают в циклическом или непрерывном режиме в течение 3–9 мес.
При сочетании миомы матки с эндометриозом предпочтительнее назначение даназола, обладающего выраженным антигонадотропным эффектом без эстрогенных и гестагенных свойств. Механизм его действия связан с торможением секреции ФСГ и ЛГ из гипофиза по типу отрицательной обратной связи. Эффективные лечебные дозы —200–800 мг/сут.; продолжительность приема обычно 6 мес., иногда до 9–12 мес.
Сходное с даназолом по клиническому эффекту действие оказывает гестринон — производное 19 норстероидов. Назначается в дозе 2,5–5 мг два раза в неделю. Морфологический эффект проявляется выраженными инволютивными изменениями железистого эпителия.
Препарат RU-486 (мифепристон — антагонист прогестерона) также может уменьшить размеры миоматозных узлов путем снижения концентрации прогестерона. В частности, в одном из исследований при суточной дозе мифепристона 25 мг объем миом уменьшался на 50%.
В последнее время много внимания уделяется изучению аналогов гонадолиберина, вызывающих состояние «обратимого гипогонадизма». Непрерывное введение аналогов ГнРГ, синтезированных искусственным путем, вызывает глубокую блокаду секреции гонадотропинов. Наиболее изученными являются препараты трипторелин (декапептил) и гозерелин (золадекс), которые вводятся парентерально один раз в 28 дней в течение 3–12 мес. Лечение агонистами ГнРГ приводит к существенному уменьшению объема матки (в среднем на 53%) с исчезновением патологической симптоматики. Однако это лечение является весьма дорогостоящим и имеет временный эффект, в связи с чем рекомендуется в качестве предоперационной подготовки и при противопоказаниях к хирургическому лечению. Следует учитывать и наличие достаточно выраженных побочных эффектов, которые напоминают симптомы перименопаузы: приливы жара, головная боль, сухость влагалища, диспареуния (болезненность при половом акте), утомляемость, бессонница. Также имеет значение тот факт, что лишение организма женщины воздействия эстрогенов на 3–6 мес., в большинстве случаев вызывает резорбцию костной ткани.
Таким образом, очевидной является необходимость сугубо индивидуального подхода к выбору метода лечения каждой больной. Совершенно недопустимо противопоставление консервативного и хирургического методов.
Литература:
1. А.Л. Тихомиров, Ч.Г. Олейник, Д.М. Лубнин (Кафедра акушерства и гинекологии
ФПДО МГМСУ, Москва) “Современный алгоритм комплексного консервативного лечения больных миомой матки”.
2. Я.З. Зайдиева, Ю.И. Липатенкова (Научный центр акушерства, гинекологии и перинатологии РАМН (дир. - акад. РАМН, проф. В.И. Кулаков), Москва, “Влияние заместительной гормонотерапии на миому матки у женщин в климактерии”.
3. М. В. Майоров (Женская консультация Харьковской городской клинической многопрофильной больницы № 8) “Миома матки:
хирургический экстремизм или медикаментозный консерватизм?”
4. М.М. Умаханова, С.Ш. Гасанова (Кафедра акушерства и гинекологии стоматологического факультета МГМСУ)” СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О МОРФО- И ПАТОГЕНЕЗЕ МИОМЫ МАТКИ”.
www.eurolab.ua