Серозный рак яичников выживаемость
Рак яичников
Рак яичников является 9-ой наиболее часто встречаемой онкологической патологией у женщин (за исключением рака кожи) и занимает 5-е место как причина женской смертности.

Риск приобретения инвазивного рака яичников за время жизни у женщин составляет приблизительно 1 случай из 71. Риск смерти за время жизни от инвазивного рака яичников ― 1 на 95 случаев.
Ежегодно, в США регистрируется около 21550 новых случаев заболевания раком яичников и 14600 летальных исходов. Однако в различных регионах мира определяются разные значения показателей заболеваемости раком яичников; на территории Европейского союза в 2004 году было зарегистрировано 42700 новых случаев заболеваемости, а показатель смертности составил 12 случаев на 100 тыс. женщин в год. Большая часть зарегистрированных летальных исходов от рака яичников характеризовалась наличием серозного гистологического типа опухоли, и у половины заболевших женщин рак яичников был диагностирован в возрасте 60 лет и старше. Таким образом, рак яичников ― это социальная проблема, имеющая важное значение в западных странах, хотя ежегодно в развивающихся странах регистрируется более 50% новых случаев болезни.
Факторы риска
Прослеживается связь рака яичников с несколькими факторами риска, такими как ожирение, использование пудры из талька и некоторыми препаратами для лечения бесплодия.
Не выявлено явной корреляции между развитием рака яичников и бедным репродуктивным анамнезом, продолжительностью репродуктивного периода. Считается, что раннее наступление менархе и позднее наступление менопаузы увеличивает риск возникновения рака яичников.
К другим факторам риска, имеющим важное значение для рака яичников, относят генетическую предрасположенность у женщин, носительниц мутаций генов BRCA1 или BRCA2. Риск развития у женщин за время жизни рака молочной железы при наличии мутации BRCA1 и BRCA2 составляет от 60% до 85%, для рака яичников от 26% до 54% при мутации BRCA1, и 10% ― 23% ― при мутации BRCA2.
К факторам, связанным с низким риском развития рака яичников, относятся использование оральных контрацептивов, кормление грудью, двусторонняя перевязка труб или гистерэктомия, профилактическая овариоэктомия.
Морфологическая характеристика
Исходя из современных представлений, под раком яичников подразумевают группу заболеваний различных по своему происхождению, биологическим и клиническим свойствам, в связи с чем в настоящее время признано, что пред ложить универсальную, многофакторную систему стадирования для всех ви дов аденокарцином яичников является сложной задачей.
В 90% случаев первичное озлокачествление опухолей яичников имеет эпителиальное происхождение (аденокарцинома). Полагают, что в большинстве случаев злокачественный рост возникает из поверхностного эпителия яичников или производных Мюллерова протока, включая дистальные отделы фаллопиевых труб; перитонеальные опухоли овариального типа стадируются как первичный рак яичников.
По классификации опухолей яичников Всемирной организации здравоохранения (ВОЗ) различают 6 главных гистологических типов: серозный, муцинозный, эндометриоидный, светлоклеточный, переходноклеточный и плоскоклеточный. Опухоли каждого типа в дальнейшем подразделяются на три соответствующие категории по прогностическому признаку: доброкачественные, злокачественные и промежуточные (позже были названы как пограничные опухоли или опухоли с низким злокачественным потенциалом) и атипичные пролиферативные опухоли. Исходя из архитектоники клеток, аденокарциномы подразделяют на 3 степени по процентному соотношению менее 5%, 5%-50% и более 50% солидного роста в железистом и сосочковом компоненте (классификация FIGO ― Международная Организация Гинекологов и Акушеров).
Муцинозные опухоли состоят из двух подгрупп, так называемого эндоцервикальноподобного муцинозного типа опухоли (серозно-муцинозные или Мюллеровы), обычно относящегося к пограничным видам опухоли и подобного пограничной серозной опухоли, и интестинального типа, встречающегося в последнее время все чаще. При проведении гистологического исследования этого подтипа опухоли важным является отличие ткани метастатической аденокарциномы от тканей верхних отделов желудочно-кишечного тракта (включая желчные пути), поджелудочной железы и шейки матки, а также от первичной муцинозной опухоли яичников. Считается, что пограничные опухоли являются предшественниками серозной карциномы с последующим переходом к низкодифференцированной аденокарциноме. С меньшей частотой пограничные опухоли могут перейти в муцинозную и реже в эндометриоидную карциному.
Высокодифференцированные и низкодифференцированные серозные аденокарциномы считаются различными по своему происхождению видами опухоли. В западных странах приблизительно 80-85% аденокарцином яичников являются серозными. Более чем у 95% пациентов с III-IV стадиями по классификации FIGO выявляется серозная аденокарцинома, в то время как серозная аденокарцинома I стадии диагностируется редко. В основном при серозной аденокарциноме выявляется папиллярная, микропапиллярная архитектоника и солидный рост опухоли с типичными щелевидными пространствами; однако железистый, решетчатовидный и трабекулярный типы опухоли, являющиеся более распространенными при других видах аденокарцином, также могут встречаться. При проведенных недавно патологоанатомических и молекулярных исследованиях выявлено, что секреторные эпителиальные клетки Фаллопиевых труб могут быть источником высокодифференцированной аденокарциномы при наследственной форме рака яичников. В редких случаях низкодифференцированная серозная карцинома яичников характеризуется низкой степенью клеточной атипии и низкой митотической активностью, которая характерна для пограничной опухоли.
Эндометриоидная аденокарцинома считается вторым по распространенности субтипом карциномы яичников (около 10% от всех аденокарцином яичников). Светлоклеточная аденокарцинома составляет 5% от всех типов аденокарцином и в основном распространена среди женщин Японии. Большинство эндоме триоидных и светлоклеточных аденокарцином выявляются на I или II стадиях (FIGO), а эндометриоидная карцинома является самой распространенной опу холью, выявляемой на первой стадии.
Характеристики переходноклеточного рака являются общераспространенными, однако, большинство опухолей этого типа относятся к серозным высокодифференцированным опухолям с гистологическими характеристиками и иммунофенотипом (экспрессия WT1 и p53), характерными для серозной аденокарциномы. Аденокарциномы с переходноклеточными свойствами встречаются достаточно часто, тем не менее, большинство из них можно отнести к высокодифференцированным серозным опухолям с соответствующими свойствами и иммунофенотипом (экспрессия WTI и р53).
Группа опухолей, называемая Мюллерова муцинозная или эндоцервикальноподобная муцинозная или смешанная эпителиальная опухоль с муцинозным компонентом, проявляет незначительные сходства с серозными пограничными опухолями. Опухоль состоит из нескольких видов клеток: эндоцервикальных клеток с апикальными муцинозными (не бокаловидными клетками), реснитчатыми клетками и, так называемыми, недифференцированными клетками. Для этого типа опухоли характерна связь с наличием эндометриоза. Большинство недифференцированных карцином, происходящих из поверхностного эпителия яичников, имеют характеристики высокодифференцированной аденокарциномы.
Молекулярно-генетическая характеристика
Основанная на данных патологической анатомии и генетики, классификация, предложенная Курманом, разделяет опухолевые клетки на 2 группы: тип I и тип II.
Субстрат для возникновения опухоли первого типа хорошо изучен, и чаще всего данный тип опухоли возникает из пограничной опухоли. Часть клеток первого типа имеют изменчивые свойства, характерные для муцинозной, эндометриоидной и светлоклеточной аденокарциномы, тогда как остальные являются медленно растущими новообразованиями (низкодифференцированные серозные аденокарциномы). Опухоли первого типа характеризуются различными видами мутаций (включая KRAS, BRAF, PTEN и .-катенин) и являются сравнительно генетически стабильными. Низкодифференцированные серозные аденокарциномы и ранее им предшествующие изменения (серозные пограничные опухоли) характеризуются взаимно исключающей последовательностью мутаций в KRAS, BRAF и ERBB2 онкогенах. Считается, что мутации в KRAS и BRAF онкогенах встречаются на ранних этапах развития низкодифференцированной серозной пограничной опухоли, и при дальнейшем изучении эти же мутации онкогенов KRAS и ВRAF, определяемые в серозной пограничной опухоли, были выявлены в эпителиальной цистаденоме, прилегающей к серозному пограничному компоненту. Мутации KRAS и BRAF выявляются приблизительно в 10% эндометриоидных аденокарцином, мутация PTEN встречается в 20%. Схожие молекулярно генетические изменения при исследовании одного образца, включая утрату гетерозиготности в 10q23 хромосоме и PTEN мутации, наблюдались при эндометриозе, атипичном эндометриозе и эндометриоидной аденокарциноме яичников.
Опухоли второго типа являются высокодифференцированными биологически агрессивными опухолями, и ткани послужившие субстратом для возникновения данного типа опухоли не определены. Полагают, что эти опухоли возникают de novo из целомического эпителия, прототипом является серозная аденокарцинома. Данная группа опухолей включает: высокодифференцированную переходноклеточную аденокарциному, злокачественные смешанные мезо дермальные опухоли (MMMT) и недифференцированные аденокарциномы. Опухоли второго типа демонстрируют выраженную генетическую нестабиль ность и мутацию в гене TP53, при этом мутации, характерные для первого типа опухолей не были выявлены.
Наследственные опухоли, связанные с мутациями BRCA1 и BRCA2 относятся ко второму типу опухолей.
Диагноз
Наиболее часто встречаемыми симптомами рака яичников являются: дискомфорт в брюшной полости, невыраженные боли в животе, чувство переполнения, изменения в работе кишечника, ранняя насыщаемость, диспепсия и вздутие.
Заподозрить рак яичников возможно при обнаружении пальпируемого образования в малом тазу. Иногда рак яичников может манифестировать клиникой кишечной непроходимости вследствие наличия опухолевых масс интрабрюшинно или дыхательной недостаточностью вследствие накопления плеврального выпота.
На ранних стадиях болезни, пациентки, находящиеся в пременопаузальном периоде, отмечают нерегулярные менструации. При сдавлении опухолевыми массами мочевого пузыря или прямой кишки, могут появиться жалобы на частое мочеиспускание и/или запоры. В редких случаях, пациентки могут ощущать вздутие в нижних отделах живота, давление или боли во время полового акта. Вторичные боли, связанные с перфорацией или перекрутом опухоли, являются нехарактерными.
На поздних стадиях болезни, чаще всего появляются симптомы, связанные с накоплением асцита и увеличением живота в объеме вследствие наличия объемного образования в брюшной полости. Эти симптомы проявляются увеличением размеров живота, вздутием, запорами, тошнотой, анорексией или ранней насыщаемостью. При IV стадии болезни часто встречается дыхательная недостаточность вследствие наличия плеврального выпота. При метастазировании в лимфатические узлы, могут пальпироваться увеличенные паховые, надключичные и подмышечные лимфатические узлы.
Определение СА125 в сыворотке крови широко используется в качестве маркера при подозрении на эпителиальный рак яичников и для первичной прогностической оценки степени распространения опухоли. Не стоит забывать, что ложноположительные результаты могут быть получены при нескольких состояниях, в частности при возникновении воспалительных изменений в брюшной полости, таких как эндометриоз, аденомиоз, воспалительные заболевания в малом тазу, менструация, фиброма матки или доброкачественные кисты. При проведении ретроспективного анализа образцов сыворотки 5500 женщин, которые были внесены в регистр Швеции, выявлено повышение уровня СА125 у 175 женщин. В конечном счете, рак яичников был диагностирован у 6 из этих женщин, а также у 3 женщин был выявлен рак яичников с нормальным уровнем СА125. Специфичность данного теста составляет 98,5% для женщин старше 50 лет, но снижается до 94,5% для женщин моложе 50 лет (таким образом, имеет низкое прогностическое значение). При сравнении значений маркера СА125 у двух групп: женщин, с повышенным уровнем маркера СА125 и невыявленным раком яичников, и женщин, у которых данное заболевание было диагностировано, в последней группе существовала большая вероятность роста значения СА125 с течением времени.
Трансвагинальная ультразвуковая сонография часто включается в список исследований для оценки опухолевых масс в малом тазу. Явными признаками распространенного рака яичников является наличие опухолевых образований в области яичников, с солидным и кистозным компонентами, иногда встречаются внутренние перегородки и/или септы, асцит или признаки метастазирования по брюшине.
Скрининг, включающий определение СА125 и ультразвуковую сонографию является эффективным методом для выявления рака яичников на ранних стадиях. Было проведено крупное рандомизированное исследование, в котором 202638 женщин в постменопаузе (в возрасте 50 ― 74 лет) были распределены в 2 скрининговые группы, проходящие ежегодные обследования: в первой группе определялся уровень СА125 и выполнялась трансвагинальная УЗ-сонография, во второй группе ― только трансвагинальная УЗ-сонография. В исследовании было показано, что скрининговое обследование, включающее определение СА125 и трансвагинальную УЗ-сонографию является более специфичным методом, чем проведение только УЗИ, для выявления первичного рака яичников. Несмотря на многообещающие результаты, мультимодальный скрининг все еще не может называться золотым стандартом для раннего выявления рака яичников. Необходимы дальнейшие рандомизированные клинические исследования, доказывающие влияние мультимодального скрининга на продолжительность жизни пациентов больных раком яичников.
Дополнительные методы визуализации, такие как магнитно-резонансная томография (МРТ) или позитронно-эмиссионная томография (ПЭТ), могут дать дополнительную информацию, но не являются необходимыми исследованиями при проведении предоперационной оценки в рутинной практике. Целью визуализации при подозрении на рак яичников является отличие доброкачественного поражения придатков от тех изменений, которые в дальнейшем потребуют патологоанатомического исследования для выявления злокачественного роста. При сомнительных результатах по данным УЗИ, использование МРТ усиливает специфичность метода визуализации, тем самым снижая частоту вмешательств на доброкачественных новообразованиях. КТ используется для диагностики и планирования лечения при распространенном раке яичников. Использование ПЭТ/ КТ не рекомендуется для диагностики первичного рака яичников у женщин в постменопаузе в связи с большим числом ложноположительных результатов.
Стадирование и факторы риска
Хирургическое стадирование требует выполнения срединной лапаротомии с тщательным осмотром брюшной полости в соответствии с рекомендациями FIGO (Табл.1). При подозрении на рак яичников необходимо выполнить биопсию брюшины диафрагмальной поверхности, латеральных каналов, малого таза, полную или избирательную лимфаденэктомию тазовых и парааортальных лимфатических узлов, удаление большого сальника. Должны быть произведены смывы с 4-х областей брюшной полости (диафрагмы, правого и левого латеральных каналов и малого таза), а также выполнены тотальная гистерэктомия и двустороннее удаление придатков. При муцинозном типе опухоли должна быть выполнена аппендэктомия.
У 22% больных ранним раком яичников проведение хирургического стадирования приводит к выявлению распространенных форм заболевания. Young с соавторами представил систематическое последовательное повторное стадирование 100 пациенток оперированных в разных клиниках с изначально установленной I или II стадией болезни. У 31 (31%) из 100 больных стадия болезни оказалась выше ранее установленной ― III стадия болезни была выявлена у 23 (77%) из 31 пациенток. Ранее невыявленные очаги чаще всего определялись по брюшине малого таза, в асцитической жидкости, в других тканях малого таза, парааортальных лимфатических узлах и диафрагме.
Необходимость выполнения тазовой и парааортальной лимфодиссекции связана с высокой частотой вовлечения данных зон в патологический процесс у пациенток с предполагаемыми I и II стадиями болезни. Cass с соавторами показали, что у 96 пациенток с объемным образованием, ограниченным одним яичником, при микроскопическом исследовании в 15% случаев выявляется поражение лимфатических узлов. Среди этих пациенток, в 50% случаев отмечалось поражение тазовых лимфатических узлов, 36% ― парааортальных, и 14% ― поражение лимфоузлов в обеих зонах. У всех этих пациенток была верифицирована III стадия болезни. При распространенном раке яичников преимущество выполнения забрюшинной лимфаденэктомии остается спорным. Benedetti с соавторами показал влияние системной аортальной и тазовой лимфаденэктомии на безрецидивную и общую выживаемость по сравнению с резекцией пораженных лимфатических узлов у пациентов с IIIB-C и IV стадиями эпителиального рака яичников. Авторы продемонстрировали, что системная лимфаденэктомия увеличивает безрецидивную выживаемость, не влияя при этом на общую выживаемость [I].
Хирургическое вмешательство, по возможности, должно производиться онкогинекологом, который имеет достаточный опыт лечения рака яичников. Большинство общих хирургов мало знакомы с анатомией забрюшинного пространства, в частности с расположением кровеносных сосудов. Факты показывают, что вероятнее всего хирургическое стадирование будет выполнено общим хирургом неадекватно в 65% случаев по сравнению со стадированием, проведенным общим гинекологом (48%).
Первичная циторедуктивная операция является стандартным методом на первом этапе лечения больных распространенным раком яичников. Считается, что удаление максимально возможного объема опухоли влияет на увеличение продолжительности жизни. В действительности, уменьшение объема опухоли до проведения химиотерапии может синхронизировать клеточное деление, усилить эффект лекарственного лечения метастазов, уменьшить необходимое число курсов химиотерапии для уменьшения остаточной опухоли и снизить частоту развития лекарственной резистентности. Bristow с коллегами проанализировали 81 исследование, включающие 6885 пациенток, и показали, что увеличение числа пациенток, которым была выполнена максимальная циторедукция, на каждые 10% коррелировало с увеличением медианы продолжительности жизни на 5,5%.
Прогноз пациенток с субоптимальной циторедуктивной операцией остается неблагоприятным. В случаях, когда невозможно выполнить оптимальную циторедуктивную операцию, может быть выполнено промежуточное хирургическое вмешательство; факт уменьшения распространенности заболевания и удовлетворительные показатели общей выживаемости были продемонстрированы в некоторых ретроспективных исследованиях. В 1995 году, в проспективном рандомизированном исследовании, проведенном Гинекологической Онкологической Кооперированной группой (GCG) Европейской Организации по Исследованиям и Лечению Рака (EORTC), было показано, что промежуточное хирургическое лечение значительно увеличивает показатели безрецидивной и общей выживаемости.
Приблизительно в 15% случаев эпителиальный рак яичников диагностируется на IV стадии болезни. В целом, медиана продолжительности жизни пациентов с IV стадией болезни составляет 15-23 месяца, а предполагаемая 5-летняя выживаемость ― 20%. В ретроспективном анализе 360 больных с IV стадией болезни, получивших хирургическое лечение с последующей химиотерапией (6 курсов внутривенного введения паклитаксела и препаратов платины) было показано, что пациенты с микроскопическими признаками резидуальной опухоли после оперативного лечения имели наилучшие результаты лечения, тогда как у пациентов с резидуальной опухолью 0,1 ― 1,0 и 1,1 ― 5,0 см наблюдались схожие показатели общей и безрецидивной выживаемости. Таким образом, радикальная циторедуктивная операция может быть обоснована в случае достижения микроскопической резидуальной опухоли.
Таблица №1. Стадирование рака яичников
I Опухоль ограничена яичниками
IA Опухоль ограничена одним яичником, асцита нет. Нет опухолевых проявлений на внешней поверхности яичника, капсула интактна
IB Опухоль ограничена двумя яичниками, нет асцита. Нет опухоли на внешней поверхности, капсулы интактны
IC Опухоль, такая же, как при стадиях IA и IB, но с наличием опухоли на поверхности одного или обоих яичников, или нарушением капсулы, или имеется асцит, и/или обнаруживаются опухолевые клетки в перитонеальном смыве
II Опухоль вовлекает один или оба яичника и распространяется в полость малого таза
IIA Опухоль характеризуется распространением и/или метастазами в матку и/или маточные трубы
IIB Распространение на другие ткани малого таза
IIC Опухоль такая же, как в стадиях IIA и IIB, но имеется опухоль на поверхности одного или обоих яичников, или отмечается разрыв капсулы, или асцит, и/или обнаруживаются опухолевые клетки в перитонеальном смыве
III Опухоль вовлекает один или оба яичника с перитонеальными имплантами и/ или метастазами в забрюшинные и паховые лимфатические узлы. Метастазы по поверхности печени. Распространение ограничено областью малого таза, но с верифицированными метастазами в большой сальник
IIIA Опухоль ограничена областью малого таза, нет метастазов в лимфатические узлы, но имеются гистологически доказанные микроскопические метастазы по брюшине и брюшной полости
IIIB Опухоль одного или обоих яичников с гистологически доказанными метастазами по брюшине, диаметр которых не превышает 2 см; в лимфатических узлах метастазов нет
IIIC Метастазы в брюшную полость диаметром более 2 см и/или метастазы в забрюшинные либо паховые лимфатические узлы
IV Опухоль одного или обоих яичников с отдаленными метастазами. Плеврит с цитологически обнаруживаемыми опухолевыми клетками, паренхиматозные метастазы в печени.
Лечение
Объем хирургического вмешательства и послеоперационной химиотерапии определяется стадией заболевания и другими клинико-морфологическими прогностическими факторами.
Ранние стадии (I и IIa стадии по FIGO)
Если опухолевый процесс у пациентов ограниченным только малым тазом и нет дополнительных проявлений метастатического процесса в брюшной полости хирургическое стадирование становится важным этапом для прогнозирования результатов лечения и является независимым прогностическим фактором, оказывающим влияние на продолжительность жизни.
Оперативное вмешательство должно включать тотальную абдоминальную гистерэктомию и двустороннюю сальпингоофорэктомию с удалением большого сальника, выполнение смывов с брюшной полости, биопсию брюшины, ревизию брюшной полости и забрюшинного пространства для оценки состояния тазовых и парааортальных лифатических узлов. Пациентам, желающим сохранить детородную функцию, возможно выполнение односторонней сальпингоофорэктомии с адекватным стадированием на основании консилиума.
С появлением минимально инвазивной хирургической техники, стало возможным выполнять лапароскопически или с помощью роботизированной техники адекватный объем хирургических вмешательств для комплексного стадирования, включая лапароскопическую забрюшинную лимфаденэктомию и оменэктомию. В дальнейшем необходимо проведение крупных исследований с оценкой безрецидивного интервала и продолжительности жизни для сравнения лапароскопического и лапаротомического методов хирургического стадирования.
Типичные клинические и патологоанатомические прогностические факторы, такие как степень дифференцировки опухоли, стадия FIGO, гистологический тип, асцит, разрыв опухоли до проведения хирургического лечения, экстракапсулярный рост и возраст пациентки, были определены с помощью многофакторного анализа как независимые прогностические факторы при эпителиальном раке яичников. Verote с соавторами показали на большом количестве пациенток с ранней стадией болезни, что степень дифференцировки опухоли является наиболее важным фактором, оказывающим влияние на безрецидивную выживаемость. Затем следуют разрыв опухоли до хирургического лечения, разрыв опухоли во время проведения операции и возраст пациентки. На основании этих прогностических факторов и после проведения оптимального хирургического стадирования, пациентка может быть отнесена к низкому, среднему или высокому риску развития рецидива заболевания. К опухолям с низким риском относятся IA-IB стадия с низкой степенью дифференцировки (G1); промежуточному риску ― IA-IB и G2; к высокому риску ― IC c любой степенью дифференцировки, IB или IC и G2-G3, светлоклеточный рак.
Химиотерапия
Адъювантная химиотерапия при ранних стадиях рака яичников остается спорным вопросом. В последнем мета-анализе 5 крупных проспективных клинических исследований (в 4 из 10 исследований пациенты получали химиотерапию на основе производных платины) было показано, что проведение химиотерапии считается более эффективным методом, чем наблюдение за больными ранними стадиями рака яичников. У пациентов, получавших адъювантную химиотерапию на основе препаратов платины, была больше продолжительность жизни (HR 0,71; 95% CI 0,53-0,93) и время до прогрессирования (HR 0,67; 95% CI 0,53-0,84), чем у пациентов, не получавших адъювантное лечение. Даже если предположить, что у 2/3 пациентов, включенных в два крупных исследования, было проведено неадекватное стадированием болезни, нельзя исключить некоторое преимущество от назначения химиотерапии у пациентов с адекватным стадированием. Таким образом, разумно заключить, что адъювантная химиотерапия рекомендована не только пациентам с неадекватно проведенным стадированием болезни, но и при адекватном стадировании у пациентов с умеренным и высоким риском.
До сих пор остается спорным вопрос о продолжительности лечения. Только в одном рандомизированном исследовании (GOG 157) было показано, что назначение 6 курсов химиотерапии карбоплатином и паклитакселом не улучшает показатели общей и безрецидивной выживаемости при значительно большей токсичности по сравнению с 3 курсами терапии. Таким образом, основываясь на данных мета-анализа, рекомендовано проведение 6 курсов монохимиоте рапии карбоплатином в качестве адъювантного лечения ранних стадий рака яичников у пациентов с промежуточным и высоким риском.
Распространенная болезнь (IIb ― IIIc стадии по FIGO)
В группу распространенного рака яичников была включена IIb стадия, поскольку по данным классификации FIGO на этой стадии болезни в процесс вовлекаются другие ткани малого таза, вследствие чего ухудшается прогноз, показатели 5-летней выживаемости снижаются с 71%-90% при ранних стадиях до 65% при IIb стадии.
Стандартным лечением распространенного рака яичников является проведение циторедуктивной операции и последующее назначение химиотерапии с использованием препаратов платины.
С 1986 года оптимальной считается циторедуктивная операция с резидуальными очагами .1 см в наибольшем измерении, также показано, что выполнение операции без видимых проявлений резидуальной болезни увеличивает продолжительность жизни. По данным литературы, у пациентов, которым была выполнена оптимальная циторедуктивная операция, медиана продолжительности жизни составляет 39 мес., по сравнению с 17 мес. у пациентов с субоптимальными остаточными образованиями. В нескольких последовательных исследованиях продемонстрировано, что оптимальное хирургическое вмешательство чаще всего может быть выполнено квалифицированными хирургами, онкогинекологами, нежели общими хирургами.
Больным, у которых по каким-либо причинам максимальная циторедукция на первом этапе не была произведена, показано выполнение промежуточной циторедуктивной операции при наличии положительной динамики или стабилизации болезни на фоне химиотерапии [IIB]. Оптимальным является выполнение промежуточной циторедуктивной операции после 3 курсов химиотерапии и назначение еще 3 курсов терапии после оперативного вмешательства.
Химиотерапия
После проведения циторедуктивной операции, дальнейшее лечение больных распространенным раком яичников включает химиотерапию с использованием препаратов платины.
С 1996 года стандартом лечения является комбинация препаратов платины и паклитаксела. В исследовании GOG 111 было продемонстрировано статистически достоверное преимущество комбинации препаратов платины и паклитаксела по сравнению со стандартным режимом с использованием производных платины и циклофосфамида у первично нелеченных больных распространенным раком яичников III и IV стадии. По данным GOG 114, замена цисплатина на карбоплатин не влияет на отдаленные результаты лечения, однако стоит отметить меньшую частоту токсических эффектов и более простой режим введения карбоплатина [I]. Длительное наблюдение за больными в исследованиях GOG 111 и OV.10 показало, что 6-летняя безрецидивная выживаемость составила только 18%. Попытки улучшить столь низкие отдаленные результаты стали причиной разработок экспериментальных стратегий с добавлением третьего препарата к различным комбинациям, который не должен обладать перекрестной резистентностью к препаратам платины и таксанам.
В крупнейшее исследование III фазы, инициированное Гинекологической онкологической Интергруппой (GCIG), было включено 4312 больных и исследовано 5 различных режимов лечения. Каждый режим включал 8 курсов хи миотерапии: две группы получали лечение с использованием трех препаратов (карбоплатин, паклитаксел, гемцитабин и карбоплатин, паклитаксел, липосо мальный доксорубицин), другие две группы получали последовательно 4 кур са химиотерапии с использованием двух препаратов (карбоплатин-топотекан и карбоплатин-гемцитабин) и 4 поддерживающих курса с включением кар боплатина и паклитаксела; контрольная группа получила 8 курсов стандарт ного лечения карбоплатином и паклитакселом. Не было отмечено никакого статистически достоверного преимущества или клинического улучшения от использования комбинации трех химиопрепаратов по сравнению с контроль ной группой [I].
В настоящее время нет данных, рекомендующих 2-х и 3-х компонентные схемы лечения, поэтому паклитаксел и карбоплатин все еще остаются препаратами выбора.
В трех рандомизированных исследованиях было проанализировано влияние длительности химиотерапии (количество курсов) на общую выживаемость. Ни в одном из исследований не было различий по медиане продолжительности жизни, тогда как длительность химиотерапии оказывала влияние на развитие токсичности (особенно на течение полинейропатии). По результатам данного исследования стандартом лечения было определено проведение 6 курсов химиотерапии.
Характерной особенностью эпителиального рака яичников является распространение роста опухоли по поверхности брюшины в пределах брюшной полости. Проведение внутрибрюшинной химиотерапии считается локально направленным лечением на зону распространения болезни, при этом уменьшаются проявления системной токсичности. Результаты, доложенные Национальным институтом рака (NCI) в январе 2006 года, показали, что проведение внутрибрюшинной химиотерапии совместно с системным лечением увеличивает продолжительность жизни больных после оптимальной циторедуктивной операции по сравнению только с системной химиотерапией (общая выживаемость составила 65,6 мес. и 49,7 мес. соответственно, при этом относительный риск смерти снизился на 21,6%). Однако внутрибрюшинная химиотерапия, как лечебный метод, требует дальнейшего исследования и обсуждения, поскольку остаются нерешенными вопросы токсичности и переносимости (менее половины пациентов смогли получить запланированное лечение ― 42% из 205 больных).
В недавно проведенном мета-анализе было показано, что при использовании внутрибрюшинной химиотерапии относительный риск прогрессирования (HR 0,792; 95% CI 0,688-0,912; P = 0,001) и относительный риск смерти (HR 0,799;95% CI 0,702 ― 0,910; P = 0,0007) снижаются на 21%. Эти данные стали основанием для внедрения внутрибрюшинной химиотерапии с использованием препаратов платины в качестве первой линии лечения больных III стадией рака яичников после проведения оптимальной циторедуктивной операции. Достижение компромисса между выживаемостью и переносимостью является поводом для проведения дальнейших больших межгрупповых исследований III фазы по оценке внутрибрюшинной химиотерапии в первой линии лекарственной терапии больных распространенным раком яичников [I].
Рецидивная болезнь
Выбор адекватной тактики лечения при рецидивах заболевания зависит от сроков возникновения и распространенности патологического процесса, а также длительности промежутка от окончания предыдущей линии химиотерапии.
Пациентам с платиночувствительной болезнью и длительным интервалом без лечения (например, >24 мес.), особенно при наличии единичного рецидивного очага и хорошем общем статусе может быть предложена хирургическая опера ция. В последнем мета-анализе было показано, что наиболее важным прогно стическим фактором, оказывающим влияние на продолжительность жизни больных после проведения повторной циторедуктивной операции, является оптимальная циторедукция. Как оказалось, что пропорциональное увеличение на 10% числа больных, которым была выполнена повторная оптимальная ци торедуктивная операция, приводит к удлинению на 3,0 мес. медианы продол жительности жизни. Стоит отметить, что роль повторных циторедуктивных операций была изучена только в ретроспективных и проспективных нерандо мизированных исследованиях, поэтому очевидна необходимость проведения рандомизированных исследований для определения преимущества повтор ных циторедукций.
Если прогрессирование заболевания выявлено во время проведения химиотерапии с использованием препаратов платины, то такое течение болезни считается платинорефрактерным, при развитии рецидива в течение 6 месяцев от окончания химиотерапии ― платинорезистентным, а при развитии рецидива через 6 месяцев и более ― платиночувствительным течением болезни.
При развитии стойкого длительного эффекта после проведения платиносодержащей химиотерапии, высока вероятность повторного ответа на режимы лечения с платиновыми производными. Выбор между цисплатином и карбоплатином зависит от ранее использованного цитостатика, переносимости препарата и остаточной токсичности. Эффективность комбинации паклитаксела и карбоплатина у больных с платиночувствительным рецидивом была изучена в двух крупных исследованиях ICON4 и OVAR 2.2. В этих параллельных исследованиях сравнивались 6 курсов химиотерапии препаратами платины и комбинация паклитаксела с платиновыми производными у 802 больных с платиночувствительными рецидивами (почти 50% пациенток получали ранее паклитаксел и платиновые производные), промежуток без лечения составлял >6 мес. (OVAR2.2) и >12 мес. (ICON4). Относительный риск прогрессирования и риск смерти снижался на 23% при использовании комбинации паклитаксела и производных платины (p=0.006). Выраженность эффекта не зависела от таких показателей, как рандомизация в группы, время до возникновения рецидива, схемы первой линии химиотерапии, количества линий химиотерапии, возраста и общего состояния пациентов. Таким образом, у больных с платиночувствительными рецидивами данный режим химиотерапии улучшает продолжительность жизни и безрецидивную выживаемость по сравнению с использованием только платиновых производных [I].
Учитывая влияние на кумулятивную нейротоксичность как паклитаксела, так и карбоплатина, риск возникновения выраженной токсичности у больных с рецидивами рака яичников после первой линии химиотерапии с использованием этих препаратов резко возрастает, если повторное лечение начинается в течение 12 мес. от окончания первой линии химиотерапии. Частота клинически значимой остаточной нейротоксичности стала основной причиной для поиска платиносодержащих комбинаций, не вызывающих токсичность данного вида. В исследовании AGO-OVAR продемонстрировано значительное увеличение времени до прогрессирования и объективного противоопухолевого эффекта без ухудшения качества жизни у 356 больных с платиночувствительными рецидивами после 6 курсов химиотерапии гемцитабином и карбоплатином в сравнении с применением одного карбоплатина. Безрецидивная выживаемость в исследуемой группе оставила 8,6 мес. (95% CI 7,9-9,7) и в контрольной группе ― 5,8 мес. (95% CI 5,2-7,1), (p=0,0031). Частота ответов на лечение составила 47,2% и 30,9% соответственно. При оценке общей выживаемости не было получено статистически значимых различий.
На последнем ежегодном конгрессе ASCO было представлено многоцентровое исследование III фазы по изучению эффективности и безопасности комбинации карбоплатина и пегилированного липосомального доксорубицина в сравнении с карбоплатином и паклитакселом у 976 больных с платиночувствительными рецидивами эпителиального рака яичников. Исследование показало, что в экспериментальной группе показатель безрецидивной выживаемости оказался не хуже, чем в группе контроля (11,3 мес. и 9,4 мес. соответственно; HR=0,821, 95% CI 0,72-0,94; P=0,005), и отмечалась низкая частота тяжелой и отсроченной токсичности. Этот режим может быть предложен в качестве стандартного для лечения больных с подобными характеристиками болезни.
Химиотерапия пациентов с платинорефрактерной болезнью обычно характеризуется низким противоопухолевым эффектом и короткой продолжительностью жизни [C]. При повторном введении платиносодержащих схем лечения противоопухолевый эффект наблюдается в ~10% случаев. Аналогичная эффективность выявляется при использовании других противоопухолевых препаратов при развитии рефрактерной болезни на паклитаксел и платиновые производные (топотекан, доцетаксел, пероральный этопозид, липосомальный доксорубицин, гемцитабин, ифосфамид и гексаметилмеламин). Стойкий ответ на лечение может быть достигнут в редких случаях или почти невозможен, поэтому главной целью терапии этой группы больных является паллиативное лечение. Особое внимание должно быть уделено побочным эффектам используемых препаратов. Пациентов с хорошим общим статусом и мотивацией на дальнейшее лечение следует рассматривать как потенциальных кандидатов на участие в экспериментальных исследованиях с новыми препаратами.
Повторные операции с паллиативной целью могут рассматриваться у больных с признаками кишечной непроходимости, получавших две и более линии химиотерапии без особого эффекта. Критериями отбора пациентов для проведения паллиативного хирургического вмешательства (резекция опухоли, наложение обходного анастомоза) являются предполагаемая продолжительность жизни, общий объективный статус пациента, наличие асцита, желание жить, местные проявления болезни и подозрение на кишечную непроходимость.
Наблюдение
Динамическое наблюдение после первичного лечения до конца не определено и должно включать тщательный сбор анамнеза, общий осмотр и обследование малого таза с периодичностью 1 раз в 3 мес. на протяжении первых двух лет, 1 раз в 4 мес. в течение третьего года, 1 раз в 6 мес. в течение 4 и 5 года или до прогрессирования заболевания.
Исследование значений онкомаркера СА125 во время химиотерапии используется для оценки эффективности проводимого лечения. Согласно критериям GCIG,прогрессирование или рецидив болезни устанавливается при выявлении последовательного роста значений маркера СА125 в сыворотке крови. Прогрессирование болезни должно быть подтверждено двумя повышенными значениями маркера СА125, измеренными с интервалом в одну неделю. Датой маркерного прогрессирования считается дата впервые зарегистрированного повышения СА125. Оценка болезни по изменениям маркера СА125 не может быть произведена у пациенток, получающих мышиные антитела и при выполнении хирургических и медицинских вмешательств, затрагивающих брюшину и плевру в течение 28 дней до даты анализа. После того, как было доказано прогностическое значение маркера СА125 для выявления рецидива, определение его в сыворотке крови стало активно использоваться в период динамического наблюдения после завершения химиотерапии.
В случае раннего выявления рецидива болезни по показателю онкомаркера, пациентам часто начинают лечение при отсутствии клинических признаков болезни, однако вопрос об эффективности такой терапии остается открытым. На ASCO 2009 были представлены результаты крупного исследования III фазы по оценке клинического преимущества раннего начала химиотерапии, основанного только на повышении маркера СА125, и дальнейшего наблюдения за больными, и началом лечения после появления клинических признаков болезни. В исследование было включено 527 больных с полной ремиссией и нормальными значениями маркера СА125 после первой линии химиотерапии, содержащей препараты платины. Пациентам, попавшим в группу незамедлительного лечения, химиотерапия второй линии была проведена на 4,8 мес. раньше и третья линия на 4,6 мес., по сравнению с группой, оставленной под наблюдение до появления клинических признаков рецидива. При медиане наблюдения 49 мес. и 351 зарегистрированном летальном исходе, в обеих исследуемых группах не отмечена разница в значениях продолжительности жизни (HR = 1,01; 95% CI 0,82-1,25; P=0,91). Качество жизни было ниже в группе больных, начавших лечение до появления клинических признаков болезни, по-видимому, это связано с использованием более интенсивных режимов лечения и длительностью периода лечения.
В заключение следует отметить, что нет преимущества в раннем определении значений маркера СА125 для выявления рецидива. Даже при выявленном росте маркера, химиотерапию следует начинать только при появлении клинических симптомов рецидива болезни [I]. Однако важно информировать женщин о выборе тактики динамического наблюдения и иметь в виду тот факт, что рост маркера СА125 может отражать наличие потенциально резектабельных макроскопических рецидивов.
КТ следует выполнять при наличии клинических и лабораторных (повышение СА125) признаков прогрессирования болезни. ПЭТ-КТ может быть более информативным методом по сравнению с КТ для выявления очагов болезни, особенно поражения лимфатических узлов, метастазов по брюшине и очагов по капсуле печени. При планировании хирургического лечения, ПЭТ позволяет более точно выявить потенциальных кандидатов для проведения вторичного хирургического вмешательства.
www.zdorovieinfo.ru
Карцинома яичников: виды, симптомы, лечение
Карцинома яичников – это онкологическое заболевание, начинающее свое развитие в эпителиальной ткани этих органов. Недуг стоит на третьем месте по степени распространенности среди всех видов рака женской половой системы. Он диагностируется у 10-12 из 1000 женщин, чаще всего встречается в зрелом и пожилом возрасте.
Данное заболевание имеет несколько видов, в зависимости от чего будет отличаться степень его опасности и скорость прогрессирования. Рассмотрим наиболее часто встречающиеся формы рака.
Формы карциномы
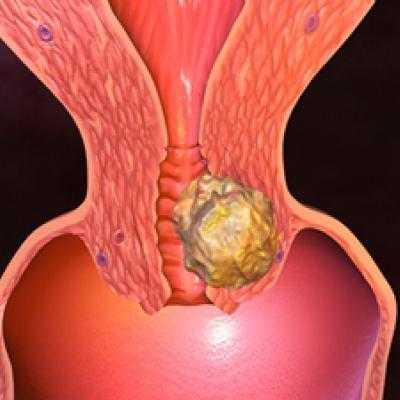
Здесь мы рассмотрим классификацию болезни в зависимости от гистологического строения. Наиболее часто встречающейся является серозная карцинома яичников. На ее долю приходится около 75% от общего количества случаев. Она отличается многокамерной кистозной структурой поверхности органа, является достаточно агрессивной формой онкологии. Размеры опухоли достигают больших показателей, в большинстве случаев поражаются оба яичника. По степени дифференцирования болезнь протекает в разных вариантах. У подавляющего количества пациенток с таким недугом развивается асцит.
Прогноз при серозной форме раковой патологии яичников зависит от стадии, на которой диагностировано заболевание. Чаще всего оно выявляется уже при наличии метастазирования. Метастазы поражают преимущественно органы брюшной полости, могут проявляться в большом количестве.
На второе место по степени распространения можно поставить слизеобразующую карциному яичников или муцинозную, как ее еще называют. Данная форма также достаточно агрессивна, а размеры опухоли могут быть очень большими. Несмотря на то, что чаще всего новообразование не прорастает в капсулу яичников, оно дает многочисленные метастазы, усложняющие процедуру лечения.
Намного реже встречается такой вид заболевания как мелкоклеточная раковая патология яичников. Несмотря на это, данная форма также отличается высокими показателями агрессивности, а соответственно – смертности. Обычно она диагностируется уже на сложных стадиях, что затрудняет лечение.
Еще реже врачам приходится иметь дело с недифференцированным раком яичников. На его долю приходится около 1% случаев от общего количества РЯ, но сложность заключается в том, что патологически измененные клетки достаточно сложно дифференцировать на фоне здоровых. Соответственно, тут тоже следует говорить о высоком риске для здоровья и жизни пациентки.
Симптомы рака
Вне зависимости от того, о какой форме заболевания идет речь, шансы на успешное его излечение повышаются в разы при условии ранней диагностики. Даже, несмотря на то, что на ранних стадиях рак практически никак себя не проявляет, будучи внимательным к своему здоровью, женщина, с высокой вероятностью, сможет его заметить.
Симптомы карциномы яичников изначально будут достаточно размытыми, только со временем увеличивая свою яркость. Они заключаются в следующем:
- нарушение менструального цикла, изменение интенсивности выделений;
- боли и чувство тяжести, ощущаемые внизу живота;
- дискомфорт и боли во время полового акта;
- появление кровянистых межменструальных выделений;
- нарушение мочеиспускания, затрудненная дефекация.
Если замечена хотя бы часть из перечисленных выше симптомов, необходимо сразу обратиться к гинекологу. Только своевременная и точная диагностика позволит поставить правильный диагноз, улучшить прогноз при серозной форме раковой патологии яичников и любом другом виде онкологического заболевания.
Как диагностируется рак
Первоначально женщина должна пройти гинекологический осмотр, в ходе которого могут появиться подозрения на онкологию. Но, визуально выявить рак достаточно сложно, поэтому в любом случае окончательный диагноз будет поставлен после обследования.
- Лабораторные анализы крови.
- УЗИ ОМТ.
- КТ или МРТ.
- Иссечение ткани для гистологического анализа.
В ходе обследования докторам удается определить место локализации и размеры новообразования, наличие метастазов и особенности их расположения. Также можно точно установить тип рака и ни с чем не перепутать карциному яичника, что играет важную роль в последующем лечении.
Тактика лечения рака яичников
Важно! Выбор тактики терапии будет зависеть от множества факторов. Это форма болезни, ее стадия, размеры и особенности расположения опухоли. Также обязательно учитывается общее состояние пациентки.
 Главным методом лечения остается хирургическое вмешательство. В зависимости от размеров опухоли будут определены его масштабы. Если опухоль имеет маленькие размеры, не осложнена метастазами, то врачи будут говорить об удалении одного или нескольких яичников. В тех же случаях, когда онкологическое поражение более масштабное, докторам приходится удалять и матку с сальниками.
Главным методом лечения остается хирургическое вмешательство. В зависимости от размеров опухоли будут определены его масштабы. Если опухоль имеет маленькие размеры, не осложнена метастазами, то врачи будут говорить об удалении одного или нескольких яичников. В тех же случаях, когда онкологическое поражение более масштабное, докторам приходится удалять и матку с сальниками.
В комплексе с оперативным лечением серозной карциномы яичников или другой формы недуга обязательно проводится химиотерапия. Обычно используется один противоопухолевый препарат, дозировка и курс терапии определяется врачом. Но, в некоторых случаях может требоваться сочетание нескольких лекарственных средств, тогда речь идет о полихимиотерапии.
Химиотерапия проводится до и после хирургического вмешательства. Первый вариант актуален, если размеры новообразования достаточно большие, требуется остановить его рост, в максимальном количестве уничтожить раковые клетки. После операции терапию противоопухолевыми препаратами проводят всегда – это позволяет исключить появление рецидива в результате не полного уничтожения патологически измененных клеток.
Если говорить про выживаемость при раковой патологии яичников, то в большей степени она зависит от стадии самого заболевания и распространения метастазов. Например, не первой стадии выживаемость достигает максимально высоких показателей, составляя 85-90%. Если же карцинома или аденома яичников протекают в сложной форме, понадобится обеспечить к лечению более масштабный подход, используя все имеющиеся возможности.
assuta-agency.ru
Рак яичников - Медицинский портал
По материалам Международного Агентства по Изучению Рака (Лион) в 2002 году в мире было зарегистрировано 204000 больных РАК ЯИЧНИКОВ и умерло от этого заболевания 125000 – 4% от всех новых случаев рака и 4,2% от всех онкологических смертей у женщин.
Мировое соотношение числа умерших к числу вновь регистрированных – 0,61. РАК ЯИЧНИКОВ занимает 6-0е место в мире по заболеваемости среди всех форм рака и 7 -ое место среди причин онкологической смертности у женщин. Размахи стандартизованных показателей заболеваемости и смертности от РАК ЯИЧНИКОВ составляют 5 и 4-х кратные различия в Европе и Китае, Европе и Африке. (Заболеваемость в северной Европе – 13,3/100000, в Китае – 3,2/100000, в северной Африке – 2,6/100000. Смертность в западной и северной Европе – 6,3-7,9/100000, в Китае – 1,8/100000, в северной и средней Африке 1,8-2,3/100000).
В США на РАК ЯИЧНИКОВ приходится 3% от всех форм рака у женщин, эта опухоль занимает 2-0е место среди гинекологических форм рака (после рака тела матки). В 2005 году зарегистрировано 22220 больных, умерло 16210.
Смертность от РАК ЯИЧНИКОВ выше, чем от рака шейки матки и рака тела матки вместе взятых. Соотношение числа умерших ко вновь выявленным больным в этой стране равно 0,73. В 1985-2001 П. в США зафиксировано снижение заболеваемости РАК ЯИЧНИКОВ на 0,8% в год. 5-летняя выживаемость больных РАК ЯИЧНИКОВ в США выросла с 37% в 1974-78 гг. до 41% в 1983-85 годы и 44% в 1995-2000 годах.
Отчетливо обозначена зависимость выживаемости больных РАК ЯИЧНИКОВ от стадии заболевания во время первичной диагностики – больные с локализованной опухолью выживают в 94% случаев, при региональном распространении в 69%, при отдаленных метастазах в 29%. К сожалению, локализованный РАК ЯИЧНИКОВ встречается весьма редко, он выявляется в США в 19 % случаев. Один год после постановки диагноза выживают 77% больных РАК ЯИЧНИКОВ. Выживаемость женщин моложе 65 лет в 1,7 раза выше, чем пациенток более старшего возраста (соответственно 50% и 29%).
В России в 2003 году зарегистрировано новых больных 11966 (6-0е место в структуре опухолей у женщин, после рака молочной железы, толстой кишки, желудка, тела и шейки матки). В стандартизованных показателях заболеваемость РАК ЯИЧНИКОВ – 10,3/100000. За 10 лет с 1993 по 2003 год заболеваемость увеличилась на 9,4%. Средний возраст заболевших – 58,7.
Молекулярные изменения при спорадическом РАК ЯИЧНИКОВ
Также как и при других опухолях, ключевую ответственность за мультишаговый процесс канцерогенеза в яичниках несут мутации нормальных генов, регулирующих рост и дифференцировку клеток. 60 онкогенов были идентифицированы при РАК ЯИЧНИКОВ, значение не всех их в патогенезе этих опухолей уточнено. Мутации протоонкогенов, превращающие их в онкогены, могут иметь различное выражение: инсерция (вставка нуклеотидов), инверсия (замена порак яичниковдка локусов на обратный в хромосомах), делеция, транслокация (перемещение генетического материала), амплификация, гипометилирование.
3 основных категории генов причастны к возникновению РАК ЯИЧНИКОВ – протоонкогены, которые являются промоторами роста и дифференцировки клеток, супрессорные гены – негативные регуляторы роста клеток и гены, отвечающие за исправления дефектов ДНК.
Наиболее значимы из онкогенов при РАК ЯИЧНИКОВ – гены KiRAS, HRAS.
KiRAS кодирует белок р21 (гуанозин трифосфат, который в норме взаимодействует с рецепторами тирозин киназ и активирует сигнальную трансдукцию). Особенно часто описывается мутация гена KiRAS при муцинозном РАК ЯИЧНИКОВ.
Мутации гена H-RAS встречаются реже. Они ответственны за усиление транскрипционных сигналов через ER, рецепторы глюкокортикоидов.
АКТ2 – ген, кодирующий серин-треонин протеин киназу, его амплификация отмечается в 10-15% случаев спорадического РАК ЯИЧНИКОВ. Встречаются мутации этого гена главным образом у больных с III и IV стадиями и никогда при доброкачественных и пограничных опухолях. Мутации АКТ-2 ведут к активации и гиперэкспрессии EGF, IGF, PDGF, FGF (эпидермального, инсулиноподобного, выделенного из тромбоцитов и фибробластного факторов роста).
РiК3СА амплифицирован у 58% пациенток, активация этого гена влияет на неблагоприятный прогноз РАК ЯИЧНИКОВ.
Амплификация или оверэкспрессия гена ЕгЬ В2 (Her2\neu) наблюдается в 26% случаев рака яичников, материалы по поводу прогностической значимости дефектов этого гена овариальных опухолей противоречивы.
При РАК ЯИЧНИКОВ обнаружены мутации или потерак яичников экспрессии следующих супрессорных генов р53 (в 50%): VHL, EN1J; RASSFIA, p27k;P;, РАН и др.
Характерными для РАК ЯИЧНИКОВ являются потерак яичников гетерозиготности, делеции аллелей (отмечаются в 3,6,7,9, 11, 17, 18, 19 и 22 хромосомах). Мутации или потерак яичников суп рессорных генов ведет к ослаблению их сдерживающего влияния на пролиферацию, дезрегулируют физиологическую гибель клеток.
Морфология
Сложной Сложной считается гистологическая классификация новообразований яичников, поскольку кроме традиционно рассматриваемых доброкачественных и злокачественных опухолей разных органов в этой патологии описаны и так называемые пограничные опухоли с низким злокачественным потенциалом.
Опухоли в яичниках возникают из эпителия, стромы, примитивных герминогенных клеток (ооцитов).
РАК ЯИЧНИКОВ построен из малигнизированных клеток целомического, мезотелиального эпителия, покрывающего яичники, их крипты и кисты.
Морфологическая классификация рассматривает среди эпителиальных новообразований серозные, муцинозные, эндометриоидные, эпителиальностромальные, светлоклеточные, переходноклеточные, смешанные эпителиальные опухоли.
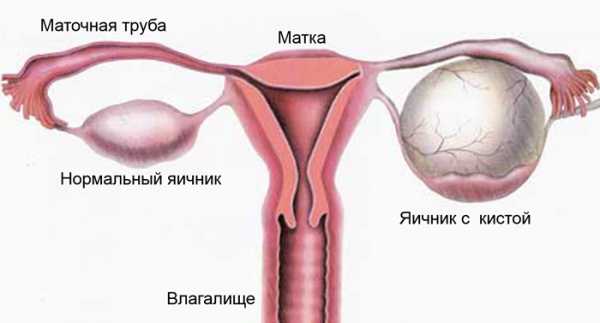
На долю серозных опухолей приходится 25% от всех новообразований яичников. 60% серозных опухолей – это доброкачественные серозные цистоаденомы и аденофибромы.
Пограничные цистоаденомы отмечаются в 10%, в одной трети случаев они двухсторонние, обычно они больше по размеру, чем доброкачественные, иногда мультикистозны с прозрачной или ослизненной жидкостью. Присутствуют при микроскопии некоторые признаки ядерной атипии и редко микроинвазии, в части случаев отмечаются перитонеальные имплантанты.
Серозные аденокарциномы составляют 30% от всех серозных опухолей.
Этот вариант самый часто встречающийся среди злокачественных опухолей яичников (87%). Серозные аденокарциномы в 2/3 случаев возникают в обоих яичниках. Опухоли могут быть солидными и кистозными или папиллярными с участками некрозов и кровоизлияниями. Они отличаются от пограничных новообразований ядерной атипией, большим числом митозо13, инвазией стромы. Псаммомные тельца и папиллярные структуры чаще наблюдаются при высокодифференцированных опухолях и наоборот, отсутствие псаммомных телец и солидная структура свойственны низкодифференцированным опухолям.
Муцинозные эпителиальные опухоли яичников также могут быть доброкачественными, пограничными и злокачественными, они встречаются в 15% случаев.
70% этих опухолей – доброкачественная муцинозная цистоаденома, в 95% односторонняя, продуцирующая муцин опухоль представлена однородным эпителием без признаков атипии.
В 10% случаев муцинозные цистоаденомы относят к пограничным опухолям. Структурно они могут быть представлены мультикистозными полями, с образованием нескольких клеточных слоев со слабыми признаками атипии ядер, повышением числа митозов. Обычно прогноз при этих опухолях благоприятный.
В 15-20% ОПУХОЛИ ЭТОЙ ГРУППЫ – МУЦИНОЗНЫЕ аденокарциномы. Они могут быть солидными или кистозными С частыми кровоизлияниями и некрозами. Стромальная инвазия также как клеточная атипия отличают эту категорию новообразований от пограничных муцинозных цистоаденом. В опухолях может преобладать кишечная или эндоцервикальная дифференцировка эпителия. В l-ой стадии выживают 95% больных.
Эндометриоидные опухоли составляют 5% от всех яичниковых новообразований. Доброкачественные эндометриоидные цистоаденомы крайне редки, морфологически они трудно различимы от эндометриоза. Встречаются эндометриоидные аденофибромы.
Характерным отличием эндометриоидных пограничных опухолей является отсутствие стромальной инвазии.
Эндометриоидные аденокарциномы составляют основную часть опухолей этой клеточной дифференцировки. От всех злокачественных опухолей яичников на их долю приходится 20%.
Микроскопически эндометриоидные аденокарциномы похожи на рак тела матки, представлены колоннообразным эпителием с выраженной инвазией стромы, иногда с плоскоклеточной метаплазией, в одной пятой случаев эта форма сочетается с эндометриозом. 5-летняя выживаемость в 1 стадии ниже, чем при серозных и муцинозных аденокарциномах – 75%.
Светлоклеточный рак – самый агрессивный вариант опухолей яичников, отмечается в 6% всех опухолей этого органа. Двухстороннее поражение наблюдается в 10%. Микроскопически эти опухоли состоят из клеток со светлой цитоплазмой и анаплазированными ядрами. 5 лет выживают 70% больных с 1 стадией. В половине случаев эта опухоль сочетается с РТМ или эндометриозом.
Злокачественная смешанная мюллеровская опухоль регистрируется в 1 % случаев, в одной трети билатеральна. Микроскопически построена из эпителиальных и стромальных элементов. Опухоль выглядит как карциносаркома. Эпителиальный компонент может напоминать серозную, муцинозную или эндометриальную аденокарциному, стромальный компонент гомологический и тогда напоминает мезенхимальную ткань или гетерологичный с элементами, встречающимися при тератомах – кости, жировая ткань, храк яичниковщ, мышцы.
Опухоль Бреннера (переходноклеточный рак) составляет 2-3% от всех злокачественных опухолей яичников. Обычно опухоль связана с муцинозными или дермоидными кистами. Опухоли небольшого размера
4anosia.ru
Карцинома яичника: симптомы, лечение, прогноз
Карцинома яичника – нередко встречающееся злокачественное новообразование, которое поражает женщин в позднем репродуктивном и начальном постменопаузальном возрасте.
Карцинома яичника относится к генитальным формам рака и в структуре заболеваемости занимает до 25% от всех онкологических процессов репродуктивной системы женщины.
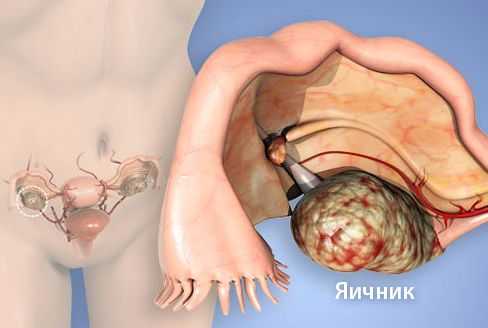
Карцинома яичника – злокачественная опухоль, локализующаяся в стромальной или паренхиматозной ткани яичников женщины и имеющая первичное или вторичное происхождение. Поражение яичников занимает до четверти из всех форм генитальной карциномы. В 70% случаев рак яичника носит первичный характер, т.е. развивается непосредственно из клеток органа.
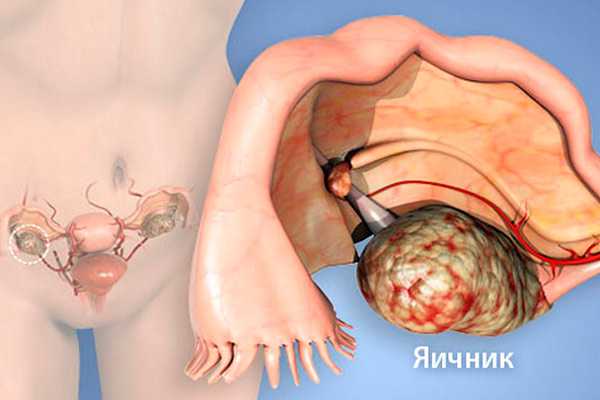
Самой распространенной гистологической формой карциномы яичника является серозный вариант опухоли, который выявляется в 50% случаев. На втором месте по частоте встречаемости находится эндометриоидная форма, а на третьем месте стоит муцинозная форма рака.
В целом карцинома яичника числится на втором месте по частоте встречаемости среди опухолей женской репродуктивной системы, уступая лишь злокачественным новообразованиям матки. В структуре смертности опухоли яичника занимают пятое место, что характеризует их как одну из ведущих причин женской смертности в онкологии.
Причины
Существуют неспецифические причины развития онкологического процесса, а также специфические, т.е. конкретные для каждого определенного вида опухоли. К неспецифическим причинам относят все внешние факторы среды, которые снижают резистентность организма к патогенам и ослабляют иммунный статус.
В случае с карциномой яичника имеется ряд характерных причин оказывающих непосредственное влияние на развитие злокачественного новообразования:
- Отсутствие родов в анамнезе – одна из активно исследуемых причин. Несмотря на недостаточность данных о патогенетическом механизме, прослеживается определенная корреляция между частотой встречаемости карциномы и отсутствием беременностей в анамнезе.
- Давно замечена еще одна зависимость, применение комбинированных оральных контрацептивов значительно повышает риск развития злокачественных новообразований в яичниках, как и наоборот – отсутствие приема оральных контрацептивов является фактором образования карциномы.
- Наследственная предрасположенность – несмотря на то, что практически при всех онкологических заболеваниях наследственный фактор играет большую роль – в случае с карциномой яичника прослеживается отчетливая связь между выявлением заболевания и отягощенностью семейного анамнеза.
Также к весомым факторам риска образования карциномы можно отнести систематичную гонадотропную стимуляцию, сопутствующее наличие миоматозных узлов в матке, хронические воспалительные процессы, протекающие во внутренних половых органах и позднее начало менопаузы.
Стадийность процесса

Международная ассоциация акушеров-гинекологов FIGO разработала свою классификацию стадийности онкологического процесса при раке яичников, которая полностью сочетается с международной универсальной классификацией TNM, однако имеет ряд ценных в практике онкогинекологов делений в классификации:
-
I стадия – Опухоль локализована непосредственно в одном или обоих яичниках.
I А – Онкологический процесс с одной стороны.
I В – В онкологический процесс вовлечены оба органа.
I С – Опухоль определяется на наружной поверхности, наличие экссудативного выпота в брюшную полость.
-
II стадия – Распространение злокачественного процесса на брюшину и органы малого таза.
II А – Опухоль поражает матку или маточные трубы.
II В – Инвазия или инфильтрация мочевого пузыря или различных отделов толстого кишечника.
II С – Вовлечение в процесс брюшины, выраженный асцит.
-
III стадия – Метастатическое поражение органов брюшной полости. Распространение метастазов в печеночную ткань, брюшные и паховые лимфатические узлы.
III А – Поражение подвздошных, парааортальных групп лимфатических узлов, обсеменение брюшины без выхода за пределы малого таза.
III В – Определение метастазов с размерами не более 2 см.
III С – Метастазы размером более 2 см и поражением ретроперитонеальных лимфоузлов.
- IV стадия – Наличие отдаленных метастазов.
Карцинома яичника имеет несколько видов гистологического строения, что зависит от сочетания патогенетических факторов. Онкогинекологи выделяют следующие виды злокачественных новообразований яичников:
- Опухоль из серозной ткани;
- Эндометриоидная опухоль;
- Муцинозная опухоль;
- Эндометриоидная стромальная саркома;
- Опухоль Бреннера;
- Неклассифицируемые низкодифференцируемые эпителиальные опухоли.
Частота встречаемости всех вышеперечисленных опухолей расположена в порядке убывания.
Классификация по локализации
Местное поражение при карциноме яичника соответствует I стадии онкологического процесса. При достаточно высоко дифференцированных злокачественных опухолях прогрессия опухолевого роста может занимать довольно длительный временной промежуток, характерно это для опухолей серозного происхождения. При местном поражении прогноз остается благоприятным.
Распространение опухолевого процесса на малый таз, а точнее на его брюшину, соответствует II стадии и сопровождается выраженной экссудацией жидкости в брюшную полость, что носит название – асцит. Асцитическая жидкость может скапливаться в больших объемах, что может привести к растяжению передней брюшной стенки из-за повышенного внутрибрюшного давления.
Вам уже исполнилось 18 лет? Если да – нажмите сюда для просмотра фото.
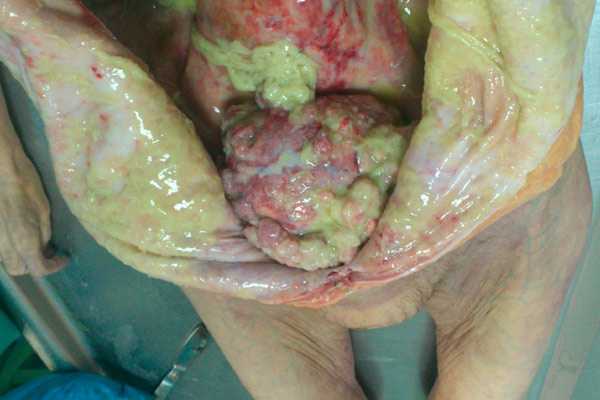
Фото: рак придатков 4 стадии, в брюшной полости находилось около 6 литров воды
stoprak.info