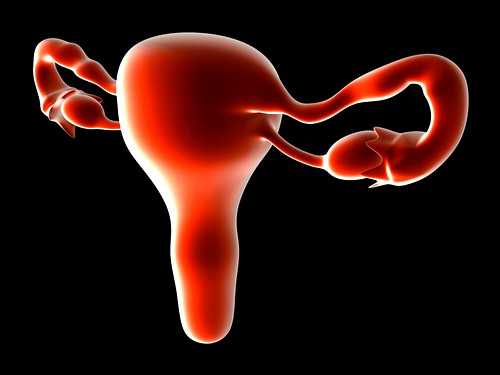
Циторедукция при раке яичника
Лечение рака яичников
Лечение рака яичника может быть различно, в каждом случае необходим индивидуальный подход. Врач-онколог при этом учитывает стадию опухоли, возраст женщины, состояние ее здоровья и желание родить в будущем.
Хирургическое лечение рака яичников
Подходы к хирургическому лечению распространенного рака яичников отличаются от основных принципов хирургического лечения рака других локализаций.
Иногда операция может быть предпринята в качестве заключительного этапа диагностики, и если диагноз рака яичников на ней подтверждается, то сразу проводится его лечение.
Операция при первой стадии опухоли включает следующие этапы:
- - удаление яичника, пораженного опухолью и маточной трубы с этой же стороны
- - биопсия яичника с другой стороны для исключения наличия рака и в нем
- - удаление большого сальника, так как часто поражается метастазами, даже микроскопическими
- - удаление региональных лимфоузлов (тазовых и парааортальных)
- - при необходимости проводится биопсия других органов и тканей для исключения их ракового поражения
Детальнее о лечении рака яичников в начальной стадии можно прочитать здесь.
Целью хирургического вмешательства при II-IV стадиях рака яичников является максимально возможное удаление опухолевых масс, даже при невозможности удаления всей опухоли, то есть так называемая максимальная циторедукция. Зачастую объем циторедуктивных операций включает пангистерэктомию с бисальпингоофоректомией, оментектомию, удаления метастазов рака по брюшине, которое часто сопровождается удалением части кишки. Циторедукция создает условия для дальнейшей химиотерапии, позволяя преодолеть ряд фармакологических барьеров. При больших размерах опухоли ее кровоснабжение плохое, химиопрепарат не достигает всех частей опухоли. Удаление этих частей обеспечивает циторедуктивная операция. Именно циторедуктивная хирургия в комбинации с химиотерапией производными платины позволили добиться ощутимого успеха в лечении рака яичников.
Химиотерапия
Химиотерапия чаще всего проводится после хирургического вмешательства. Но часто 3-4 цикла предоперационной химиотерапии увеличивают операбельность процесса. Наиболее эффективными для лечения рака яичников считаются комбинации паклитаксела с производными платины, а также цисплатина или карбоплатина с циклофосфамидом. Лечение проводится в течение 6 циклов при оптимальной циторедукции. При неоптимальной циторедукции после химиотерапии выполняется повторная попытка уменьшить объем опухолевых масс. Необходимость повторных операций обусловлена тем, что опухолевые очаги, которые остаются после химиотерапии, резистентны к примененным химиопрепаратам. Удаление их целесообразно для улучшения эффективности последующих циклов химиотерапии и даже с паллиативной целью - как профилактика кишечной непроходимости. Следовательно, больные раком яичников оперируются в среднем 2-3 раза с обязательным проведением химиотерапии между операциями.
Лучевая терапия
Лучевая терапия рака яичников проводится при наличии единичного метастаза или рецидива, которые локализуются в нижней части брюшной полости. Особенно, когда возможности хирургического и химиотерапевтического лечения рака яичников исчерпаны.
Лечение в домашних условиях
Лечение рака яичников не все время проводится в больнице, большая его часть проходит в домашних условиях. В таких условиях женщине приходится самостоятельно справляться с возможными побочными эффектами и осложнениями лечения. Обязательно следует придерживаться рекомендаций вашего онколога. Общие рекомендации можно сгруппировать так:
- - нужно постараться максимально сохранить свои привычки, которые были до болезни
- - питание должно быть сбалансированным
- - достаточный и регулярный сон
- - умеренные физические нагрузки
Наиболее распространенными нежелательными эффектами лечения рака яичников есть нарушения со стороны желудка и кишечника: тошнота, рвота, запор, понос. При появлении тошноты или рвоты врач назначает специальные препараты, угнетающие рвотный рефлекс. Если они не помогают, нужно обязательно сообщить об этом своему врачу. Если вас беспокоят поносы, нужно попытаться нормализовать стул с помощью диеты. В случае неэффективности нужно обратиться к врачу для назначение медикаментозного лечения. Если вы страдаете запорами – старайтесь употреблять больше жидкостей в виде соков, увеличьте в рационе количество клетчатки, фруктов и овощей. Слабительные нельзя использовать не проконсультировавшись предварительно со специалистом.
Также могут встречаться расстройства сна, которые можно решить четким режимом сна и бодрствования. Для уменьшения утомляемости нужно больше бывать на свежем воздухе и уменьшить количество нервных стрессов. Выпадение волос часто сопровождает химиотерапию, и от этого никуда не денешься. Для более быстрого восстановления волос нужно использовать мягкие щадящие шампуни.
Результаты
Результаты лечения рака яичников зависят от многих факторов: стадии болезни, типа опухоли, степени дифференциации, от проводимого лечения, оптимальности циторедукции, интенсивности доз примененной химиотерапии и тщательности наблюдения. Пятилетняя выживаемость больных составляет 30%, что соответствует проценту процессов, диагностированных на I и II стадии заболевания. Эти данные подтверждают значение ранней диагностики рака яичников.
alloncology.com
241. Диагностические мероприятия.
241.1 Лабораторные исследования:
группа крови и резус-фактор;
серореакция на сифилис;
HbSAg,
общий анализ крови;
общий анализ мочи;
биохимическое исследование крови (общий белок, мочевина, креатинин, билирубин, глюкоза, АсАТ, АлАТ, щелочная фосфатаза);
опухолевые маркеры (СА 125);
при подозрение на неэпителиальную опухоль яичников наряду с СА 125 опухолевые маркеры АФП, бета-хорионический гонадотропин, NSЕ (нейрон-специфическая энолаза);
коагулограмма (АЧТВ, ПВ, ТВ, фибриноген) — на этапе предоперационной подготовки.
241.2. ЭКГ.
Гинекологическое вагинальное и ректовагинальное исследование.
Раздельное диагностическое выскабливание матки с последующим гистологическим исследованием.
УЗИ органов брюшной полости и малого таза.
Рентгенологическое исследование органов грудной клетки.
Обследование органов ЖКТ с целью исключить метастатический характер поражения яичников (ФГДС обязательна, колоноскопия по показаниям).
КТ и/или МРТ органов брюшной полости и малого таза выполняется по показаниям.
При наличии асцита, вызывающего компрессию органов брюшной полости, показан лапароцентез и эвакуация асцита с цитологическим исследованием асцитической жидкости.
При наличии плеврита показан торакоцентез с цитологическим исследованием жидкости на наличие опухолевых клеток. Наличие плеврита без морфологической верификации диагноза не дает оснований установить IV стадию заболевания. При подозрении на метастазы в легких показана диагностическая торакоскопия (торакотомия) с верификацией этих метастазов.
При подозрении на метастазы в пальпируемых лимфатических узлах (регионарных или отдаленных) показана их биопсия (тонкоигольная аспирационная, инцизионная, эксцизионная, трепан-биопсия).
242. Общие принципы лечения.
242.1. Эпителиальные опухоли яичников. Рак яичников.
Все больные, у которых предполагается рак яичников, подлежат лапаротомии, целью которой является точное установление диагноза и распространенности опухолевого процесса, а также максимально возможное удаление опухолевых масс. Следует постоянно иметь в виду, что именно размеры наибольшей из остаточных опухолей после исходной операции определяют прогноз лечения в целом, поскольку современная химиотерапия позволяет излечивать значительное число больных с диссеминированным опухолевым процессом, и доля излеченных больных тем выше, чем меньше размеры резидуальной опухоли.
В случаях, когда в ходе ревизии брюшной полости предполагается распространенность опухоли, соответствующая I–II стадии FIGO, проводятся многочисленные (до нескольких десятков) биопсии участков париетальной и висцеральной брюшины; при позитивных результатах стадия заболевания меняется, как и тактика лечения. При очевидном опухолевом поражении, выходящем за пределы малого таза, нет необходимости в биопсии визуально неизмененных участков париетальной и висцеральной брюшины.
Процедура хирургического стадирования у больных раком яичников.
Шаг 1. В тех случаях, когда имеется асцитическая жидкость, как можно большее ее количество должно быть взято для цитологического исследования. При отсутствии асцитической жидкости необходимо получить смывы для цитологического исследования из полости таза, обоих боковых каналов и обеих поддиафрагмальных поверхностей.
Шаг 2. Определить, является ли опухоль злокачественной. Если опухоль злокачественная, выполняется стандартная операция (гистерэктомия c двусторонней сальпинго-оофорэктомией и удаление большого сальника).
Шаг 3. Тщательно обследуется тазовая брюшина. При наличии опухолевых образований следует удалить их в максимально возможном объеме и взять биоптаты из тех образований, которые не могут быть удалены. В тех случаях, когда отсутствуют видимые глазом опухолевые образования, производится забор биоптатов как минимум из брюшины боковых стенок таза, брюшины мочевого пузыря, брюшины ректосигмоидного отдела толстой кишки и брюшины Дугласова кармана.
Шаг 4. Обследуются боковые карманы и удаляются все видимые образования. В тех случаях, когда видимых опухолевых образований нет, производится биопсия брюшины с каждой стороны в виде полоски ткани 13 см.
Шаг 5. Обследуется сальник и удаляются все участки, имеющие видимые опухолевые образования (включая малый сальник, если он вовлечен в опухолевый процесс). Если видимых опухолевых образований нет, производится тотальное (субтотальное) удаление большого сальника.
Шаг 6. Осматриваются и пальпируются обе гемидиафрагмы, поверхность печени и селезенки. При наличии опухолевых образований производятся их удаление в максимально возможном объеме и биопсия всех тех образований, которые не удалось иссечь. Если видимых образований нет, выполняется биопсия брюшины правой гемидиафрагмы в виде полоски 12 см (только брюшины, во избежание пневмоторакса).
Шаг 7. Начиная от ректосигмоидного отдела, либо от слепой кишки тщательно обследуется весь толстый кишечник с удалением/биопсией всех подозрительных образований на поверхности кишки или брыжейки.
В случае наличия муцинозной цистаденокарциномы и отсутствия остаточной опухоли более 1 см следует выполнить апендэктомию.
Если для выполнения циторедукции в полном или оптимальном объеме необходима резекция того или иного участка кишки, ее следует выполнить.
Шаг 8. Начиная с илеоцекального клапана или связки Трейтца, тщательно обследуется весь тонкий кишечник и брыжейка с удалением/биопсией всех подозрительных образований.
Если для выполнения циторедукции в полном или оптимальном объеме необходима резекция того или иного участка кишки, ее следует выполнить.
Шаг 9. Если после всех вышеперечисленных процедур не осталось опухолевых образований размерами больше 1 см, необходимо выполнить биопсию тазовых и парааортальных лимфатических узлов, если они визуально не изменены, либо забрюшинную или тазовую лимфодиссекцию при наличии макроскопически определяемых опухолевых образований.
При раке яичников IIB-IV стадии выполняют циторедуктивные операции.
Операция должна включать в себя: тотальную гистерэктомию, билатеральную сальпинго-оофорэктомию, оментэктомию, по возможности, удаление всех опухолевых диссеминатов брюшины. При необходимости, выполняется перитонэктомия, резекция пораженных участков тонкой и толстой кишки, удаление малого сальника, спленэктомия, дистальная панкреатэктомия, резекция мочевыводящих путей, диафрагмы, паховая, тазовая, забрюшинная лимфаденэктомия.
По размеру резидуальной опухоли хирургические вмешательства делятся на следующие категории:
Полная циторедукция — остаточной опухоли визуально не определяется.
Оптимальная циторедукция — размер остаточной опухоли (каждого очага, размер не суммируется) не более 1 см.
Субоптимальная циторедукция — размер остаточной опухоли равен или более 1 см и менее 2 см.
Неоптимальная циторедукция — размер остаточной опухоли 2 см и более.
Эксплоративная лапаротомия — опухоль не удалялась, выполнена только биопсия.
По времени выполнения хирургические вмешательства делятся на следующие категории:
Первичная циторедукция — специальное лечение начато с операции.
Промежуточная (интервальная) циторедукция — лечение начато с химиотерапии, либо на начальном этапе была выполнена эксплоративная лапаротомия, либо циторедукция в неоптимальном или субоптимальном объеме, а потом проводилась химиотерапия. Как правило, промежуточная циторедукция назначается после 3 курсов химиотерапии (2-4). Перед операцией необходимо оценить эффект от терапевтического воздействия (гинекологический осмотр, УЗИ/КТ/МРТ, анализ крови на СА 125). Показания к выполнению промежуточной циторедукции определяются индивидуально в зависимости от эффекта химиотерапии.
Вторичная циторедукция — операция выполняется по поводу рецидива заболевания. Установлено, что вторичная циторедукция себя оправдывает в том случае, если рецидив возник более чем через 6 месяцев после окончания предыдущего блока лечения.
В протоколе операции необходимо четко указывать тип циторедукции в зависимости от размеров остаточной опухоли и времени выполнения.
242.1.1. I стадия.
Для этой категории больных принципиально значение имеет определение группы риска.
К низкому риску относятся IA-IВ стадии с высокой степенью дифференцировки опухоли (G1).
К промежуточному риску – IA-IВ стадии с умеренной степенью дифференцировки опухоли (G2).
К высокому риску — IC любой степени дифференцировки, а также IA–IВ G3, а также светлоклеточный вариант опухоли.
242.1.1.1. Для группы низкого риска после хирургического вмешательства, заключающегося в гистерэктомии с придатками, оментэктомии и хирургического стадирования рекомендуется наблюдение.
Консервативная тактика, направленная на сохранение детородной функции (односторонняя аднексэктомия с резекцией второго яичника, оментэктомия), в виде исключения возможна у молодых больных раком яичников IA стадии, желающих сохранить фертильность, при высокодифференцированных карциномах, когда реально тщательное диспансерное наблюдение. После рождения ребенка или окончания детородного возраста следует планировать удаление противоположных придатков и матки.
242.1.1.2. В остальных случаях (группы промежуточного и высокого риска) необходимо проведение адъювантного лечения. После хирургического вмешательства, включающего гистерэктомию с придатками, оментэктомию, а при необходимости и комбинированных операций с целью максимальной циторедукции, обязательно проведение адъювантной химиотерапии (6 курсов).
242.1.1.3. В случаях, когда при I стадии рака яичников изначально выполнено неадекватное хирургическое лечение (в общелечебной сети), при котором не было проведено хирургического стадирования, в онкологическом стационаре выполняется повторная операция, включающая в себя все стандартные процедуры при раке яичников (хирургическое рестадирование). Если стадия после операции не изменяется, не смотря на это, а также на степень дифференцировки опухоли и ее распространенность, назначается химиотерапия.
242.1.1.3.1. Схемой выбора в настоящее время считается комбинация карбоплатина и паклитаксела:
паклитаксел 175 мг/м2 внутривенная 3-часовая инфузия на фоне премедикации в 1-й день;
карбоплатин из расчета AUC 5 – 7,5 внутривенно (после введения паклитаксела) в течение 30 мин в 1-й день. Интервал между курсами 3 недели, всего 6 курсов.
242.1.1.3.2. Возможно применение и других комбинаций химиопрепаратов:
паклитаксел 175 мг/м2 внутривенная 3-часовая инфузия в 1-й день на фоне премедикации,
цисплатин 75 мг/м2 внутривенная инфузия (после введения паклитаксела) со скоростью не менее 1 мг/мин с пред- и постгидратацией в 1-й день. Интервал между курсами 3 недели, всего 6 курсов.
242.1.1.3.3. В отсутствие таксанов возможно проведение комбинированной химиотерапии по следующим схемам:
242.1.1.3.3.1. Цисплатин 75 – 100 мг/м2 внутривенная инфузия со скоростью не менее 1 мг/мин с пред- и постгидратацией в 1-й день;
циклофосфамид 750 – 1000 мг/м2 внутривенно в течение 20-30 мин в 1-й день. Интервал между курсами 3 недели, всего 6 курсов.
242.1.1.3.3.2. Карбоплатин из расчета AUC 5-7 (или 300-360 мг/м2) внутривенно в течение 30 мин в 1-й день;
циклофосфамид 500 мг/м2 внутривенно в течение 20-30 мин в 1-й день. Интервал между курсами 3 недели, всего 6 курсов.
Оправданным для ранних стадий (I-IIA) рака яичников считается монотерапия (6 курсов) препаратами платины в больших дозах (например, карбоплатин AUC 5-7).
242.1.2. II-IV стадия.
Потенциально всем больным II-IV стадии рака яичников должна быть выполнена циторедуктивная операция.
Больным раком яичников II-IV стадии после хирургического вмешательства, включающего полную или оптимальную циторедукцию, проводится стандартная полихимиотерапия, включающая производные платины и таксаны (как и при I стадии).
При IV стадии заболевания наличие опухолевого плеврита не меняет тактику лечения. В тех случаях, когда выявляются большие нерезектабельные метастазы в печени, метастазы в паренхиме легких, массивное поражение средостения, значительных размеров метастазы в надключичных лимфоузлах, циторедуктивная операция в полном или оптимальном объеме невозможна. В таких случаях нет необходимости в тяжелых комбинированных операциях в пределах брюшной полости и таза с целью резецировать все видимые опухолевые образования. При КТ в пределах брюшной полости также могут быть выявлены признаки того, что выполнение циторедуктивной операции в полном или оптимальном объеме сомнительно. Это вовлечение в опухолевый процесс ворот печени, необходимость супраренальной лимфаденэктомии. Наличие несмещаемых опухолевых масс в малом тазу не является признаком нерезектабельности.
В настоящее время проводятся многоцентровые рандомизированные исследования с целью оценить эффективность неоадъювантной (предоперационной) химиотерапии в лечении больных, которым оптимальная циторедукция на первом этапе лечения технически невыполнима. Тем не менее, до получения результатов этих исследований лечение всех больных распространенным раком яичников следует начинать с хирургического вмешательства во всех случаях, когда такое вмешательство возможно.
При лечении рака яичников возможно использование лучевой терапии. Показания к лучевой терапии (тазово-абдоминальное облучение используется, если по каким-либо причинам химиотерапия не назначена):
состояние после полной циторедукции,;
размеры наибольшего очага остаточной опухоли в брюшной полости не превышают 2 см.
При наличии метастазов в регионарных и отдаленных (надключичных, подмышечных) лимфоузлах и отсутствии возможности их удаления и/или неэффективности химиотерапии вопрос проведения лучевой терапии решается индивидуально консилиумом с участием хирурга, химиотерапевта, радиолога.
242.1.3. Лечение рецидивного рака яичников.
Прогноз для больных, у которых возникает рецидив рака яичников после цисплатинсодержащей химиотерапии, зависит от сроков возникновения рецидива.
242.1.3.1. Химиотерапия по тем же схемам, что и исходная, оправдана в тех случаях, когда интервал между окончанием первичного лечения и рецидивом составил более 6 месяцев. Лечение тем эффективнее, чем больше этот интервал.
Повышение уровня СА 125 без клинического и инструментального (УЗИ, КТ, МРТ) подтверждения не является основанием для проведения химиотерапии. В этом случае необходимо исследование маркера в динамике. При наличии клинической и инструментальной верификации рецидива по возможности выполняется вторичная циторедукция, затем назначают химиотерапию.
242.1.3.2. В тех случаях, когда прогрессирование опухолевого процесса началось уже в ходе первичного лечения или сразу после его окончания, показано изменение режима химиотерапии. Если на первом этапе не использовались таксаны, показано применение паклитаксела в режиме монотерапии (175 мг/м2 с интервалом между курсами 21 день).
242.1.3.3. В остальных случаях возможно применение:
242.1.3.3.1. Гемцитабин 1000 мг/м2 внутривенно 1 раз в неделю;
242.1.3.3.2. винорельбин 25-30 мг/м2 внутривенно 1 раз в неделю или 60-80 мг/м2 внутрь 1 раз в неделю;
242.1.3.3.3. ифосфамид 1500 мг/м2 внутривенно в 1–5-й дни + месна 300 мг/м2 в 1–5 дни;
242.1.3.3.3. тамоксифен по 20 мг внутрь ежедневно.
Предпочтение отдается наименее токсичным препаратам, в первую очередь тем, введение или прием которых не требуют госпитализации.
242.1.4. Пограничные опухоли яичников.
Крайне важным является тщательное гистологическое исследование всей удаленной опухоли с выполнением срезов через 1 см.
В тех случаях, когда при размерах опухоли в рамках I стадии желательно сохранение репродуктивной функции, возможна односторонняя сальпинго-оофорэктомия с клиновидной резекцией контрлатерального яичника и оментэктомия. В случаях полного удаления опухоли у больных с локальными формами заболевания и установления диагноза по результатам изучения удаленной опухоли повторная операция не требуется. Химиотерапия либо лучевая терапия не показаны.
При распространенном процессе (II-III стадии) выполняется хирургическое вмешательство в объеме гистерэктомии с придатками, оментэктомии и циторедуктивные мероприятия, аналогичные тем, что проводятся при раке яичников. Проведение химиотерапии показано в тех случаях, когда в ходе хирургического вмешательства выявлены инвазивные имплантаты опухоли (даже в случае их полного иссечения). Используются те же схемы химиотерапии, что и при лечении рака яичников.
242.2. Неэпителиальные опухоли яичников.
Наиболее часто в клинической практике встречаются герминоклеточные опухоли и опухоли стромы полового тяжа (3–7% всех злокачественных новообразований яичников). В отличие от собственно рака яичников, эти опухоли чаще встречаются в молодом возрасте, нередко поражают только один яичник и более благоприятны в прогностическом плане. С учетом изложенного, особое внимание уделяется срочному гистологическому исследованию в ходе хирургического вмешательства — для определения возможности лечения с сохранением фертильности. Органосохраняющее лечение при технической возможности (при желании женщины) может выполняться в случаях, когда при срочном морфологическом исследовании ставится диагноз герминогенной опухоли любой стадии либо опухоли стромы полового тяжа I стадии. В этих случаях особое внимание следует уделить состоянию контралатерального яичника с биопсией в случае подозрения на опухолевое поражение, а также состоянию забрюшинных лимфоузлов. При наличии в них метастазов даже при органосохранном лечении выполняется забрюшинная лимфаденэктомия. Больным, не желающим сохранять фертильность, выполняется хирургическое вмешательство в том же объеме, что и при собственно раке яичников. Особое внимание уделяется стадированию с необходимым количеством биоптатов. Резекции мочевыводящих путей, а также резекции больших участков тонкой или толстой кишки при герминогенных опухолях нецелесообразны.
242.2.1. Герминоклеточные опухоли яичников.
Герминогенные опухоли составляют 5% всех опухолей яичников, но у лиц молодого возраста составляют более 75% опухолей. Наиболее часто встречаются дермоидные кисты (зрелые тератомы), обычно являющиеся доброкачественными опухолями составляющими около 20% всех опухолей яинчиков.
242.2.1.1. Классификация:
Дисгерминома
Опухоль желточного мешка (эндодермального синуса)
Эмбриональный рак
Полиэмбриома
Хорионкарцинома
Тератома:
Зрелая
Незрелая
Дермоидная киста (зрелая кистозная тератома) или дермоидная киста с малигнизацией
Монодермальная или высокоспециализированная тератома: яичниковый зоб, злокачественный яичниковый зоб и карциноид
Смешанные формы
242.2.1.2.Дополнительно к объему обследования, выполняемому при собственно раке яичников, необходимо определение бета-хорионического гонадотропина, альфа-фетопротеина и лактатдегидрогеназы. В тех случаях, когда планируется проведение блеоцин-содержащей химиотерапии, целесообразно определение функции внешнего дыхания.
242.2.1.3. Больные, у которых диагностируется дисгерминома IА стадии либо незрелая тератома G1 после полного хирургического удаления опухоли могут наблюдаться. Во всех остальных случаях показано проведение 3-4 курсов полихимиотерапии по схеме ВЕР. В отдельных случаях у больных дисгерминомой IВ–III стадии может быть проведено 3 курса химиотерапии по схеме ЕР. Имеются данные в пользу того, что во всех случаях I стадии герминоклеточных опухолей яичников возможно наблюдение с проведением химиотерапии только в случае рецидива, однако такой подход требует особенно тщательного подхода к стадированию опухолевого процесса и наблюдению за пациентом после хирургического лечения.
В тех случаях, когда у больных исходно был повышен уровень бета-хорионического гонадотропина или альфа-фетопротеина, систематическое определение этих маркеров показано как для оценки эффективности химиотерапии, так и для наблюдения в случае достижения полной клинической регрессии.
Больным, у которых нормализовался уровень опухолевых маркеров, но определяется остаточная опухоль, показано либо хирургическое удаление резидуального образования, либо наблюдение.
Больным, у которых не достигнута нормализация опухолевых маркеров, либо выявлено прогрессирование опухолевого процесса в ходе лечения, либо диагностирован рецидив опухоли, проводится химиотерапия второй линии по схемам VIP (цисплатин, ифосфамид, цисплатин), TIP (паклитаксел, цисплатин, ифосфамид), лучевая терапия.
242.2.1.4. Схемы химиотерапии.
242.2.1.4.1. ВЕР:
цисплатин 20 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией в 1–5-й дни;
этопозид 100 мг/м2 внутривенная инфузия в течение 30–60 мин, 1–5-й дни;
блеомицин 30 мг внутривенно в течение 10–15 мин, 2-й, 9-й и 16-й дни.
Очередной курс начинается на 22-й день.
242.2.1.4.2. ЕР:
цисплатин 20 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией, 1–5-й дни;
этопозид 100 мг/м2 внутривенная инфузия в течение 30–60 мин, 1–5-й дни.
Очередной курс начинается на 22-й день.
242.2.1.4.3. VIP:
этопозид 75 мг/м2 внутривенная инфузия в течение 30–60 мин, 1–5-й дни.
ифосфамид 1,2 г/м2 в течение 60 мин с пред- и постгидратацией, 1–5-й дни. Месна 400 мг/м2 внутривенно струйно за 15 мин до введения ифосфамида, затем по 400 мг/м2 внутривенно струйно каждые 8 часов в 1–5-й дни.
цисплатин 20 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией, 1–5-й дни.
Очередной курс начинается на 22-й день.
242.2.1.4.4. TIP:
паклитаксел 250 мг/м2 внутривенная 24-часовая инфузия на фоне премедикации, 1-й день.
ифосфамид 1,2 г/м2 в течение 60 мин с пред- и постгидратацией, 2–6-й дни. Месна 400 мг/м2 внутривенно струйно за 15 мин до введения ифосфамида, затем по 400 мг/м2 внутривенно струйно каждые 8 часов в 2–6-й дни.
цисплатин 20 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией, 2–6-й дни.
Обязательно введение гемопоэтического колониестимулирующего фактора через 24 часа после окончания введения цитостатиков до отстройки кроветворения: кол-во нейтрофилов 1000/мл3.
242.2.2. Опухоли стромы полового тяжа и стромальные опухоли яичников.
Это редко встречающиеся опухоли, составляющие 5% всех новообразований яичников и 7% злокачественных новообразований яичников. Среди доброкачественных опухолей в этой группе наиболее часто встречается фиброма, среди злокачественных — гранулезоклеточная опухоль.
Клинически их манифестация не имеет отличительных признаков, но некоторые из них являются функциональными и могут вызвать вирилизацию или симптомы избыточной продукции эстрогенов, проявляющиеся гиперплазией эндометрия или постменопаузальным кровотечением.
242.2.2.1. Классификация:
Гранулезоклеточные опухоли:
Взрослый тип
Ювенильный тип
Опухоли из группы теком-фибром:
Текома
Фиброма
Фибротекома
Опухоли из клеток Сертоли-Лейдига:
Опухоли из клеток Сертоли
Опухоли из клеток Лейдига
Опухоли из клеток Сертоли-Лейдига
Гонадобластома
Стероидноклеточные опухоли
Опухоли стромы полового тяжа с кольцевидными трубочками
Неклассифицируемые опухоли
242.2.2.2. В тех случаях, когда после хирургического стадирования в ходе лапаротомии (процедура аналогична той, что рекомендуется для собственно рака яичников) устанавливается I стадия стромальной опухоли яичников, решение о тактике лечения принимается индивидуально. Возможно наблюдение, однако при наличии ряда факторов риска:
разрыв капсулы опухоли,
низкая степень дифференцировки,
размер опухоли более 10 см,
стадия IC,
может быть проведена лучевая терапия либо цисплатин-содержащая химиотерапия (схемы, аналогичные тем, что применяются при лечении герминогенных опухолей, либо комбинация карбоплатин/паклитаксел). Больным с опухолью II–IV стадии после хирургической циторедукции проводится либо химиотерапия по тем же схемам, либо лучевая терапия (при локальном опухолевом процессе). В случае рецидивов целесообразны повторные циторедуктивные операции.
studfiles.net
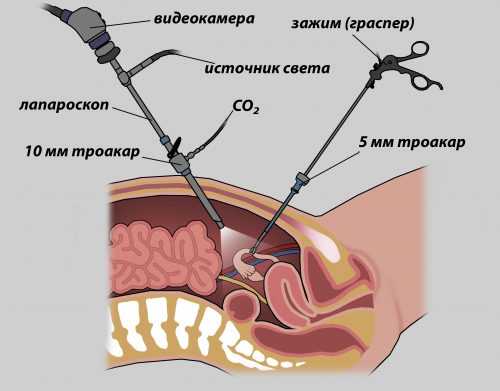
Как проводится лечение методом HIPEC с циторедукцией
Горячая внутрибрюшинная химеотерапия с циторедуктивной операцией обычно состоят из 4 фаз:
- Обследования
- Циторедукция
- HIPEC
- Реконструкция
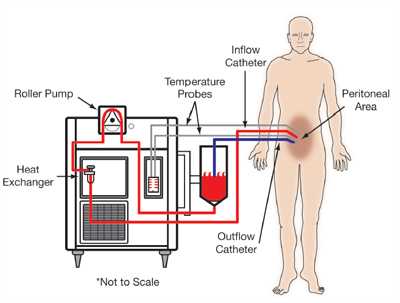
Операция начинается с всестороннего обследования брюшной полости хирургической командой, в течение которого определяется степень распространенности опухоли по брюшине. Для определения степени осеменения брюшины злокачественными клетками применяют понятие уровней, наиболее распространенный из которых — Индекс Перитонеального Канцероматоза (PCI). Индекс Перитонеального Канцероматоза имеет ступени от 0 до 12. Уровень PCI коррелирует с прогнозом лечения после HIPEC. Более высокие значения индекса соответствуют худшему прогнозу. В большинстве клиник есть максимальный уровень, для которого пациенту может быть показана циторедуктивная операция и внутрибрюшная химеотерапия. Если индекс PCI оценен по критической границе, то циторедуктивное лечение и HIPEC не проводится, поскольку ожидаемый эффект от процедуры не столь хорош, чтобы рисковать ее проведением. Максимальный PCI разнится для разных диагнозов перитонеального канцероматоза. После определение индекса перитонеального канцероматоза, хирургическая команда оценивает, можно ли удалить все узлы и сгустки видимой опухоли. Процедура продолжается только, если врачи соглашаются во мнении, что все видимые участки опухоли могут быть хирургически удалены.
Хирургическое иссечение всех видимых участков опухоли брюшной полости получило название циторедуктивной операции или циторедукции. Циторедуктивная операция- критическая часть всей процедуры, от которой зависит результат лечения, она включает как удаление всех видимых опухолевых тканей канцероматоза, так и удаление пораженных опухолью внутрениих органов. Эти ткани могут быть, например, частями тонкого или толстого кишечника, мочевого или желчного пузыря, селезенкой. Обьем удаления варьируется в зависимости от того, какие органы поражены канцероматозом. На практике, хирурги стараются отчистить от раковых клетов поверхность всех органов, насколько это возможно. Это очень травматичная и сложная процедура, которая может быть выполнена только командой хирургов, специализирующихся на данном виде лечения. Процесс выздоровления после операции сопряжен со многими рисками для здоровья, в силу огромной площади хирургического вмешательства.
После того, как все видимые участки опухоли удалены хирургическим путем, на поверхности органов брюшной полости остаются микроскопические кусочки мукозной ткани, которая может снова начать злокачественный рост. Для удаления этих невидимых глазом раковых клеток, брюшная полость наполняется подогретым до 42 градусов цельсия горячим раствором высокодозной химеотерапии. В данных целях могут быть использованы несколько видов препаратов: цисплатин, митомицин-С и оксалиплатин. Нагревание раствора также повышает эффективность лечения. С помощью специального устройства раствор циркулирует по брюшной полости, охватывая все возможные локализации злокачественных клеток, это называется перфузией. В зависимости от протокола лечения, перфузия продолжается в течение 30-90 минут. Именно эта часть процедуры называется гипертермической интерперитонеальной химеотерапией HIPEC, но несмотря на это, иногда методом HIPEC называют все 4 фазы процедуры. Эффективность достигается за счет того, что локально используется более высокодозная и агрессивная химеотерапия с большим уничтожающим опухоль эффектом, по сравнению с внутривенной.
После циторедуктивной операции и внутрибрюшинной химеотерапии необходимо восстановить целостность кишечника там, где это возможно. Однако, временная либо постоянная колоноэктомия может потребоваться. Большинство пациентов получают несколько катетеров, в том числе в желудок, в мочевой пузырь и в брюшную полость. Эти катетеры будут удалены через несколько дней после операции в зависимости от состояния здоровья пациента. Поскольку лечение методом циторедукции и hipec очень длинное и радикальное, многие пациенты проводят следующие сутки в палате интенсивной терапии, для наблюдения за их жизненными функциями. Выздоровление после процедуры длительное и занимает от 1 месяца до полугода.
cancer-care.ru
Возможности повторных оптимальных циторедуктивных операций в комбинированном лечении рака яичников. Клинический случай
СЛУЧАЙ ИЗ КЛИНИЧЕСКОЙ ПРАКТИКИ
DOI: 10.21294/1814-4861-2017-16-3-99-103 УДК: 618.11-006.6-089-059
Для цитирования: Молчанов С.В., КоломиецЛ.А., Шпилева О.В. Возможности повторных оптимальных циторедуктивных операций в комбинированном лечении рака яичников. Клинический случай. Сибирский онкологический журнал. 2017; 16 (3): 99-103. DOI: 10.21294/1814-4861-2017-16-3-99-103. For citation: Molchanov S.V., Kolomiets L.А., Shpilyeva О.V. Repeated optimal cytoreductive surgeries in combined modality treatment of ovarian cancer. Case report. Siberian Journal of Oncology. 2017; 16 (3): 99-103. DOI: 10.21294/1814-4861-2017-16-3-99-103.
ВОЗМОЖНОСТИ ПОВТОРНЫХ ОПТИМАЛЬНЫХ ЦИТОРЕДУКТИВНЫХ ОПЕРАЦИЙ В КОМБИНИРОВАННОМ ЛЕЧЕНИИ РАКА ЯИЧНИКОВ. КЛИНИЧЕСКИЙ СЛУЧАЙ
С.В. Молчанов, Л.А. Коломиец, О.В. Шпилева
Научно-исследовательский институт онкологии, Томский национальный исследовательский медицинский центр Российской академии наук, г Томск 634009, г. Томск, пер. Кооперативный, 5. E-mail: SergeyMolchanov1980@gmail.com
Аннотация
На сегодняшний день четко не разработан алгоритм лечения рецидива рака яичников, до конца не разработаны критерии отбора пациентов для выполнения вторичных циторедуктивных операций. При этом показана эффективность данного рода оперативных вмешательств при условии отсутствия остаточной опухоли в результате проведенного вмешательства. В ряде исследований разработаны прогностические модели возможности выполнения полных вторичных циторедукций. Приводим собственное наблюдение - случай неоднократных вторичных циторедуктивных оперативных вмешательств в сочетании с химиотерапией по поводу рецидивов рака яичников. Описанный клинический пример указывает на возможности выполнения неоднократных вторичных циторедуктивных вмешательств у больных с рецидивами рака яичников при локальной форме рецидива, оптимальных предшествующих циторедукциях, отсутствии асцита, удовлетворительном состоянии пациенток.
Ключевые слова: рак яичников, BRCA, комбинированное лечение, циторедуктивные операции.
Рак яичников (РЯ) занимает первое место в структуре смертности среди онкогинекологической патологии. В большинстве случаев выявляется рак яичников III-IV стадий, поэтому, несмотря на проводимое специальное лечение, в 75 % случаев отмечается рецидив заболевания [1, 2].
Роль вторичной циторедуктивной операции при рецидиве РЯ до конца не ясна [3, 4]. В ретроспективном исследовании у пациенток с полной вторичной циторедукцией медиана выживаемости составила 62 мес [5]. Три исследования были посвящены выявлению предикторных факторов выполнения таких операций у пациенток с рецидивом рака яичников. Ретроспективное исследование DESKTOP I под эгидой Arbeitsgemeinschaft Gynäkologische Onkologie (AGO) выявило 3 про-
гностических фактора оптимальной циторедукции: хороший общий статус пациентки, отсутствие или малый объем асцита (0 >16 ыл
Рис. 3. Эндофото. Рецидивные образования малого таза при лапароскопии
контрастное вещество, в полости малого таза слева определялось объемное образование с бугристыми контурами, размерами 65*44*57 мм, которое тесно прилегает к нисходящему отделу толстой кишки. При анализе на наличие мутации BRCA1 выявлен положительный BRCA-статус. Принято решение в начале противорецидивной химиотерапии провести химиотерапию по схеме СС (карбоплатинAUC5 + циклофосфан 600мг/м2 в 1-й день, интервал 3-4 нед). Проведено 4 курса химиотерапии по указанной схеме, из осложнений отмечена лейкопения II ст., анемия I ст. При обследовании наблюдалось снижение уровня СА-125 до 8,99 Ед/мл, по данным МРТ малого таза определялось уменьшение размеров образования в области сигмовидной кишки до 44*16 мм, изменение его характера на жидкостное, а также уменьшение образования в селезенке до 18*11 мм по данным СКТ брюшной полости.
25.03.11 выполнена операция. При ревизии в малом тазу в области брыжейки сигмовидной кишки осумкованная жидкость до 40 мм в диаметре, солидного компонента нет. Произведено удаление образования малого таза, спленэктомия (рис. 1). Учитывая отсутствие видимой остаточной опухоли, операция носила характер полной циторедук-ции. Гистологическое заключение (№ 6467-74/11, 4.04.11): метастаз серозной аденокарциномы в селезенку, лечебный патоморфоз IIстепени. Послеоперационный период протекал удовлетворительно, осложнений не наблюдалось. В послеоперационном периоде проведено 3 курса химиотерапии по схеме СС, отмечалась лейкопения Iст., анемия I ст. При контрольном обследовании уровень СА-125 - 7,23 Ед/мл, при УЗИмалого таза и брюшной полости, МРТ малого таза и СКТ брюшной полости объемных образований не выявлено.
В июле 2013 г. при очередном обследовании (время до прогрессирования - 24 мес) по данным УЗИ малого таза выявлено образование 42*24 мм с четкими неровными контурами, неоднородной структуры с наличием солидного пристеночного компонента по латеральной стенке малого таза с выраженным кровотоком, относительно однородной структуры. По данным МРТ в левых отделах малого таза ближе к боковой стенке визуализировалось опухолевое образование кистозно-солидного строения, размерами 41*20*38мм, оттесняющее сигмовидную кишку медиально, граница между образованием и кишкой на протяжении 40 мм была не видна. Уровень СА-125 - 35,4 Ед/мл, НЕ-4 -76,5 нг/мл. Проведено 5 курсов химиотерапии по схеме СС. При контрольном обследовании уровень СА-125 - 21,1 Ед/мл, НЕ-4-70,2 нг/мл. При УЗИ в полости малого таза слева сохранилось изоэхоген-ное образование 41*20 мм с неровными, местами нечеткими контурами, неоднородной структуры за счет точечных и линейных гиперэхогенных включений с умеренно выраженным кровотоком. В
феврале 2014 г. выполнена повторная оптимальная циторедуктивная операция по поводу локального рецидива рака яичников в объеме лапаротомии, резекция сигмовидной кишки, т.к. при интраопе-рационной ревизии выявлено, что рецидивное образование до 2 см в диаметре интимно спаяно со стенкой сигмовидной кишки (рис. 2).
Гистологическое заключение (№ 3538-45/14, 26.02.14): серозная папиллярная аденокарцинома умеренной степени дифференцировки с врастанием в кишку до слизистого слоя. Послеоперационный период протекал удовлетворительно, осложнений не наблюдалось. В послеоперационном периоде проведено 3 курса химиотерапии по схеме СС, отмечалась лейкопения I ст. При контрольном обследовании уровень СА-125 - 6,41 Ед/мл, при УЗИ малого таза и брюшной полости, МРТ малого таза и СКТ брюшной полости объемных образований не выявлено.
В марте 2015 г. (время до прогрессирования -10 мес) при плановом обследовании, при УЗИ обнаружены объемные образования малого таза 16*11 и 40*33 мм с четкими ровными контурами, анэхогенным содержимым, с солидным пристеночным компонентом. Значения СА-125 и НЕ-4 оставались в пределах нормы - 10,5 Ед/мл и 80,2 рМ соответственно. По данным МРТ малого таза определялось жидкостное образование 33*31*35 мм с наличием пристеночного солидного компонента, медиальнее выявлено аналогичное образование 24*12*16 мм. При СКТ брюшной полости дополнительных образований не обнаружено. Противорецидивное лечение начато с проведения 4 курсов химиотерапии по
ЛИТЕРАТУРА
1. Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2012 г. 2014; 226.
2. Ferrero A., Ditto A., Giorda G., Gadducci A., Greggi S., Daniele A., Fuso L., Panuccio E., Scaffa C., Raspagliesi F., Sismondi P., Biglia N. Secondary cytoreductive surgery for isolated lymph node recurrence of epithelial ovarian cancer: A multicenter study. Eur J Surg Oncol. 2014; 40: 891-8. doi: 10.1016/j.ejso.2013.11.026.
3. Chuang C.M., Chou Y.J., Yen M.S., Chao K.C., Twu N.F., Wu H.H., Wen K.C., Chen Y.J., Wang P.H., Lai C.R., Chou P. The Role of Secondary Cytoreductive Surgery in Patients with Recurrent Epithelial Ovarian, Tubal, and Peritoneal Cancers: A Comparative Effectiveness Analysis. Oncologist. 2012; 17: 847-855. doi: 10.1634/theoncologist.2011-0373.
4. Афанасьев С.Г., Добродеев А.Ю. Циторедуктивные операции (Нужно ли удалять первичную опухоль? Где предел разумной циторедукции? Практическая онкология. 2014; 15 (2): 93-100.
5. Bristow R.E., Puri I., Chi D.S. Cytoreductive surgery for recurrent ovarian cancer: a meta-analysis. Gynecol Oncol. 2009; 112: 265-274.
6. Harter P., Du Bois A., Hahmann M., Hasenburg A., Burges A., Loibl S., MuenstedtK. Surgery in recurrent ovarian cancer: the Arbeitsgemeinschaft Gynaekologische Onkologie (AGO) DESKTOP OVAR trial. Ann Surg Oncol. 2006; 13: 1702-1710.
схеме СС. При обследовании после химиотерапии по данным МРТ отмечалось уменьшение размеров рецидивных образований в полости малого таза до 26*24*26 мм и до 20*12*22 мм. Показатели СА-125 и НЕ-4 оставались в пределах нормы -4,55 Ед/мл и 47,2рМ. В сентябре 2015 г. проведена третья оптимальная циторедуктивная операция по поводу рецидива рака яичников. При лапароскопии обнаружены два образования в малом тазу - на серозной оболочке прямой кишки и боковой стенке таза до 20*20 и 20*30 мм соответственно (рис. 3). Выполнено удаление данных образований без нарушения целостности стенки прямой кишки.
Послеоперационный период протекал удовлетворительно, осложнений не было. Гистологическое заключение (№ 18402-06/15, 17.09.15): серозная папиллярная карцинома умеренной степени диффе-ренцировки без лечебного патоморфоза. Учитывая отсутствие лечебного патоморфоза, принято решение о смене схемы химиотерапии. Проведен 1 курс монохимиотерапии оксалиплатином (курсовая доза 135 мг/м2, интервал 3-4 нед), отмечалась лейкопения II степени. Пациентка на данный момент продолжает лечение.
Таким образом, клинический пример показывает целесообразность повторных циторедуктивных операций в сочетании с химиотерапией при лечении рецидива рака яичников, в том числе у пациенток с наличием мутации BRCA при условии удовлетворительного состояния пациентки, оптимального характера предыдущей циторедуктивной операции, локальной формы рецидива, отсутствия асцита и незначительного повышения опухолевых маркеров.
7. Harter P., Sehouli J., Reuss A., Hasenburg A., Scambia G., Cibula D., HankerL. Prospective validation study of a predictive score for operability of recurrent ovarian cancer: the Multicenter Intergroup Study DESKTOP II. A project of the AGO Kommission OVAR, AGO Study Group, NOGGO, AGO-Austria, and MITO. Int J Gynecol Cancer. 2011; 21: 289-295. doi: 10.1097/IGC.0b013e31820aaafd.
8. Tian W.J., Chi D.S., Sehouli J., Trope C.G., Jiang R., Ayhan A., Rabbitt C.A. A risk model for secondary Cytoreductive surgery in recurrent ovarian cancer: an evidence-based proposal for patient selection. Ann Surg Oncol. 2012; 19: 597-604. doi: 10.1245/s10434-011-1873-2.
9. Sammartino P., Cornali T., Framarino dei Malatesta M., Piso P. Cytoreductive surgery after recurrent epithelial ovarian cancer and at other timepoints. World J Obst Gynecol. 2013; 2: 101-107. doi: 10.5317/ wjog.v2.i4.10.
10. Eisenkop S.M., Friedman R.L., Spirtos N.M. The role of secondary surgery in recurrent ovarian cancer. Cancer. 2012;, 88 (1): 144-153.
Поступила 5.08.16 Принята в печать 15.01.17
СВЕДЕНИЯ ОБ АВТОРАХ
Молчанов Сергей Валериевич, кандидат медицинских наук, научный сотрудник отделения гинекологии, Научно-исследовательский институт онкологии, Томский национальный исследовательский медицинский центр Российской академии (г. Томск, Россия). E-mail: SergeyMolchanov1980@gmail.com. SPIN-код: 2719-3289.
Коломиец Лариса Александровна, доктор медицинских наук, профессор, заслуженный деятель науки РФ, заведующая отделением гинекологии, Научно-исследовательский институт онкологии, Томский национальный исследовательский медицинский центр Российской академии (г Томск, Россия). E-mail: kolomietsla@oncology.tomsk.ru. SPIN-код: 6316-1146.
Шпилева Ольга Владимировна, младший научный сотрудник отделения гинекологии, Научно-исследовательский институт онкологии, Томский национальный исследовательский медицинский центр Российской академии (г Томск, Россия). E-mail: Lela2009@sibmail.ru. SPIN-код: 1441-0681.
Авторы данной статьи подтвердили отсутствие финансовой поддержки / конфликта интересов, о котором необходимо сообщить
REPEATED OPTIMAL CYTOREDUCTIVE SURGERIES IN COMBINED MODALITY TREATMENT OF OVARIAN CANCER.
CASE REPORT
S.V. Molchanov, L-А. Kolomiets, О-V. Shpilyeva
Cancer Research Institute, Tomsk National Research Medical Center of the Russian Academy of Medical
Sciences, Tomsk, Russia
5, Kooperativny str., 634009-Tomsk, Russia.
E-mail: SergeyMolchanov1980@gmail.com
Abstract
To date, the algorithm for the treatment of recurrent ovarian cancer and the criteria for selecting patients for performing secondary cytoreductive surgeries have not been fully developed. Although the role of secondary surgery in recurrent ovarian cancer remains controversial, most retrospective studies showed better survival in patients for whom maximal cytoreduction was achieved. Several studies have developed prognostic models for the feasibility of performing complete secondary cytoreduction. We report a rare case of repeated cytoreductive surgeries in combination with chemotherapy for recurrent ovarian cancer. This clinical case indicates the feasibility of performing repeated cytoreductive surgeries in patients with localized recurrent ovarian cancer undergoing previous optimal cytoreductions and having no ascites.
Key words: ovarian cancer, BRCA, combined modality treatment, cytoreductive surgery.
REFERENCES
1. Davydov M.I., Axel Е.М. Statistics of cancer in Russia and CIS countries in 2012. 2014; 226. [in Russian]
2. Ferrero A., Ditto A., Giorda G., Gadducci A., Greggi S., Daniele A., Fuso L., Panuccio E., Scaffa C., Raspagliesi F., Sismondi P., Biglia N. Secondary cytoreductive surgery for isolated lymph node recurrence of epithelial ovarian cancer: A multicenter study. Eur J Surg Oncol. 2014; 40: 891-8. doi: 10.1016/j.ejso.2013.11.026.
3. Chuang C.M., Chou Y.J., Yen M.S., Chao K.C., Twu N.F., Wu H.H., WenK.C., Chen Y.J., Wang P.H., Lai C.R., Chou P. The Role of Secondary Cytoreductive Surgery in Patients with Recurrent Epithelial Ovarian, Tubal, and Peritoneal Cancers: A Comparative Effectiveness Analysis. Oncologist. 2012; 17: 847-855. doi: 10.1634/theoncologist.2011-0373.
4. AfanasyevS.G., Dobrodeev A.Ju. Cytoreductive surgery (Should the primary tumor be removed? (What is the optimal cytoreduction?). Practical oncology. 2014; 15 (2): 93-100. [in Russian]
5. Bristow R.E., Puri I., Chi D.S. Cytoreductive surgery for recurrent ovarian cancer: a meta-analysis. Gynecol Oncol. 2009; 112: 265-274.
6. Harter P., Du Bois A., Hahmann M., Hasenburg A., Burges A., Loibl S., MuenstedtK. Surgery in recurrent ovarian cancer: the Arbeitsgemeinschaft Gynaekologische Onkologie (AGO) DESKTOP OVAR trial. Ann Surg Oncol. 2006; 13: 1702-1710.
7. Harter P., Sehouli J., Reuss A., Hasenburg A., Scambia G., Cibula D., HankerL. Prospective validation study of a predictive score for operability of recurrent ovarian cancer: the Multicenter Intergroup Study DESKTOP II. A project of the AGO Kommission OVAR, AGO Study Group, NOGGO, AGO-Austria, and MITO. Int J Gynecol Cancer. 2011; 21: 289-295. doi: 10.1097/IGC.0b013e31820aaafd.
8. Tian W.J., Chi D.S., Sehouli J., Tropé C.G., Jiang R., Ayhan A., Rabbitt C.A. A risk model for secondary Cytoreductive surgery in recurrent ovarian cancer: an evidence-based proposal for patient selection. Ann Surg Oncol. 2012; 19: 597-604. doi: 10.1245/s10434-011-1873-2.
9. Sammartino P., Cornali T., Framarino dei Malatesta M., Piso P. Cytoreductive surgery after recurrent epithelial ovarian cancer and at other timepoints. World J Obst Gynecol. 2013; 2: 101-107. doi: 10.5317/ wjog.v2.i4.10.
10. Eisenkop S.M., Friedman R.L., Spirtos N.M. The role of secondary surgery in recurrent ovarian cancer. Cancer. 2012;, 88 (1): 144-153.
Received 5.08.16 Accepted 15.01.17
ABOUT THE AUTHORS
Molchanov Sergey V., MD, PhD, Department of Gynecology, Cancer Research Institute, Tomsk National Research Medical Center of the Russian Academy of Sciences (Tomsk, Russia). E-mail: SergeyMolchanov1980@gmail.com. SPIN-code: 2719-3289. Kolomiets Larisa A., MD, DSc, Professor, Head of the Department of Gynecology, Cancer Research Institute, Tomsk National Research Medical Center of the Russian Academy of Sciences (Tomsk, Russia). E-mail: kolomietsla@oncology.tomsk.ru. SPIN-code: 6316-1146. Shpilyeva Olga V., MD, Researcher, Department of Gynecology, Cancer Research Institute, Tomsk National Research Medical Center of the Russian Academy of Sciences (Tomsk, Russia). E-mail: Lela2009@sibmail.ru. SPIN-code: 1441-0681.
Authors declare lack of the possible conflicts of interests
cyberleninka.ru