Патоморфоз 4 степени при раке молочной железы
Гистологическая оценка ответа опухоли на химио-/лучевую терапию | Клиническая онкология
Резюме. Оценка ответа опухоли на лечение (ОО) является важным критерием эффективности химио-/лучевой терапии и прогноза онкологического заболевания. Лучевые и клинические методы, предоставляя ценную информацию, все же не дают полной характеристики ОО и должны быть дополнены гистологическим исследованием, которое, кроме детальной оценки эффективности терапии, значительно повышает достоверность прогноза. Основным гистологическим параметром при оценке ОО на сегодня является объем сохранивших жизнеспособность опухолевых элементов. Однако понимание того, что для характеристики ОО важна не только оценка объема резидуальных опухолевых элементов, но и других признаков, заставляет исследователей искать пути для создания систем многофакторного анализа ОО, пригодных для широкого повседневного использования в медицинской практике.

Ответ опухоли на лечение (ОО) представляет собой комплекс индуцированных противоопухолевой терапией альтеративно-деструктивных изменений в новообразовании. Его оценка имеет особое значение для определения эффективности неоадъювантной терапии, завоевавшей принципиально важное место при лечении злокачественных новообразований [38, 49]. Она улучшает выживаемость больных с резектабельными и помогает конвертировать часть пациентов с исходно неоперабельными опухолями до резектабельного статуса [22, 56]. Предоперационная лучевая/химиотерапия может изменить Т и N статус заболевания. Это достигается за счет уменьшения, в той или иной степени, размеров и инвазии опухоли вплоть до полной элиминации ее элементов, в том числе и в лимфатических узлах. Такая регрессия опухоли со снижением по сравнению с предоперационной T/N-категории используется для оценки ОО [41, 50, 51, 70]. Уменьшение размеров опухоли стали рассматривать в качестве признака ее радио- или химиочувствительности, а также как важный прогностический фактор [24, 31, 35, 54, 63], коррелирующий с выживаемостью онкологических больных [62, 72].
Для оценки ОО используют прежде всего лучевые методы, с помощью которых регистрируют уменьшение размеров опухоли, а также могут применять методы выявления в крови онкомаркеров [1, 3] и ряда других показателей (лактатдегидрогеназы [6, 60], кальция [7, 46], фосфора [18]).
В 1981 г. ВОЗ была принята клиническая классификация степеней ОО, основанная на изменении линейных размеров новообразования, определяемых лучевыми методами исследования [57]. В 2000 г. она была пересмотрена и представлена как критерии оценки ответа солидных опухолей (Response Evaluation Criteria In Solid Tumors — RECIST), в которой стали использовать двухмерные измерения вместо трехмерных, уменьшено количество измеряемых очагов, сняты критерии прогрессии [71]. В соответствии с этой классификацией различают:
- полный ответ (Complete Response — CR) — полное исчезновение всех опухолевых поражений в течение 4 нед с момента документации полного ответа;
- частичный ответ (Partial Response — PR) — уменьшение, по сравнению с исходным на 50% и более, суммы измерений 2 больших перпендикулярных диаметров, что определяется в 2 наблюдениях по крайней мере в течение 4 нед. При этом должны отсутствовать признаки прогрессирования заболевания;
- прогрессирование заболевания (Progressive Disease — PD) — увеличение размеров опухоли, появление любого нового очага или нового выпота, или асцита, связанного с опухолью;
- стабилизация заболевания (Stable Disease — SD) — несоответствие критериям CR или PR при отсутствии PD.
Дальнейшая эволюция RECIST привела к созданию в 2008 г. ее новой версии 1.1 [37], которая отличается как граничными значениями количественных показателей, так и увеличением количества оцениваемых параметров, ранжировки их значимости. Так, RECIST 1.1 включает оценку основных (target lesions) и дополнительных (non-target lesions) очагов опухолевого поражения (роста).
Оценка основных очагов (количественная) осуществляется по критериям:
- CR: исчезновение всех основных очагов. Любой из увеличенных лимфатических узлов (основных или дополнительных) должен иметь короткую ось менее 10 мм;
- PR: уменьшение суммы диаметров основных очагов не менее чем на 30%;
- PD: увеличение на 20% и более суммы диаметров основных очагов, которая в абсолютном выражении составляет не менее 5 мм; появление одного или нескольких новых очагов;
- SD: несоответствие критериям CR или PR при отсутствии PD.
Оценка дополнительных очагов (качественная):
- CR: исчезновение всех дополнительных очагов и нормализация уровня опухолевых маркеров. Все лимфатические узлы должны иметь размер менее 10 мм по короткой оси;
- Non-CR/Non-PD: сохранение одного или нескольких основных очагов и/или сохранение уровня опухолевого маркера выше нормы;
- PD: однозначная прогрессия дополнительных очагов, появление одного или нескольких новых очагов.
Однако лучевые и другие методы оценки ОО ограничены в своей способности обеспечить точную информацию о Т и N категориях, и при ответе, расцененном как полный лучевыми методами, часто гистологически в операционном материале выявляются элементы опухоли [29, 45, 52, 65, 71].
При попытке показать наличие резидуальных опухолевых элементов при помощи биопсии, которая сравнительно легко осуществима и имеет мало осложнений, обнаружили их низкую достоверность [23, 52, 61]. Рядом исследователей продемонстрировано, что в 35–50% случаев, когда при ребиопсиях не выявляли опухолевых элементов, их обнаруживали в резецированном материале [27, 33, 64, 67].
Таким образом, лучевые и клинические методы, предоставляя ценную информацию, все же не подходят для определения полной ликвидации первичной опухоли, предполагающей полное отсутствие опухолевых клеток после неоадъювантной химио-/лучевой терапии. Кроме того, достоверность прогноза как при полной, так и неполной регресссии опухоли существенно повышается при гистологической оценке ОО. Следовательно, достоверная оценка ОО должна включать гистологическое исследование операционного материала.
Гистологическая оценка ОО на территории постсоветских государств чаще всего именуется лечебным патоморфозом [2, 4, 19].
С целью повышения информативности оценки ОО был разработан ряд гистологических систем, базирующихся на количественных или качественных критериях, а также их сочетании. В основу всех систем гистологической оценки ОО легло определение степени клеточности опухоли и распространенности в ней некротических изменений. К сожалению, некроз опухоли с трудом поддается количественному определению, и большинство исследователей не оценивает этот показатель. Несмотря на методологические различия предложенных классификаций, все авторы подчеркивают, что полный ОО означает полное отсутствие опухолевых клеток в исследуемом материале. Основное внимание в существующих шкалах оценки ОО, прежде всего, уделяется определению относительной части опухоли, сохранившей жизнеспособность, и/или степени ее повреждения. Прогноз же заболевания зависит не только от объема сохранившей жизнеспособность опухолевой ткани, но и от ее потенциальных биологических свойств.
При оценке ОО необходимо также учитывать, что в опухолях, не подвергшихся химио-/лучевой терапии, с минимальным поперечником 3 см и более дистрофические и некротические изменения могут охватывать 30% и более их объема. Это требует критического отношения к ОО в этих пределах и экстраполяции данных на подобные опухоли, не подвергшиеся антибластемному лечению.
Все гистологические классификации ОО требуют, чтобы оценка резидуальных опухолевых элементов осуществлялась на максимально информативном материале [4, 5, 27, 29, 33, 45, 52, 65, 67, 71]. Так, для первичной опухоли наиболее информативным является исследование образцов резекции. При этом максимального внимания и тщательного исследования заслуживают те случаи, в которых после лечения клиническими и лучевыми методами, а также при визуальной оценке резецированного материала опухоль не обнаруживается.
Одной из первых гистологических классификацией выраженности ОО (лечебного патоморфоза) была схема, предложенная Е.Ф. Лушниковым [11, 12, 13], согласно которой выделяют 4 степени лечебного патоморфоза, характеризующиеся следующими признаками:
- I (слабый) — дистрофические изменения отдельных опухолевых клеток;
- II (умеренный) — появление очагов некроза и дистрофические изменения опухолевых клеток;
- III (выраженный) — обширные поля некроза, резко выраженные дистрофические изменения опухолевых клеток, сохраняют жизнеспособность немногочисленные опухолевые клетки;
- IV (резко выраженный, полный) — отсутствие опухолевых элементов.
Одной из наиболее распространенных методик оценки лечебного патоморфоза на постсоветском пространстве стала схема Г.А. Лавниковой [8, 9, 10]. Она основана на учете изменения общей структуры опухоли на тканевом (соотношение строма/паренхима, структурная атипия) и клеточном уровне (степень дистрофии и полиморфизма клеток, митотическая активность). Данная классификация выделяет 4 степени ОО:
- I степень — более 50% опухолевой паренхимы сохранено;
- II степень — сохранено 20–50% опухолевой паренхимы;
- III степень — до 20% паренхимы опухоли сохранилось в виде отдельных очагов;
- IV степень — полное отсутствие опухолевой паренхимы.
Для объективизации оценки лечебного патоморфоза по Г.А. Лавниковой используется количественный показатель — индекс повреждения (ИП), рассчитываемый по формуле:
ИП = Пк−Пл/Пк×100, (1)
где:
Пк — средний объем жизнеспособной опухолевой паренхимы (без лечения);
Пл — средний объем жизнеспособной опухолевой паренхимы (после лечения);
ИП — индекс повреждения в процентах (от 100 до 0).
Для определения индуцированных лечением некрозов в опухолевой ткани используется формула:
А = В/С×100, (2)
где:
В — количество клеток в некрозе;
С — общее количество опухолевых клеток;
А — процент клеток в состоянии некроза по отношению ко всем опухолевым клеткам.
Для злокачественных опухолей костей A. Huvos [47, 48] была предложена 4-ступенчатая схема ОО, где:
- I степень: минимальные, преимущественно внутриклеточные, изменения в опухоли, общая площадь некротизированной опухолевой паренхимы не превышает 50%;
- II степень: некроз или организация некротизированной опухоли составляет 50–90% ее объема при наличии ее жизнеспособных участков;
- III степень: некроз или явления организации распространяются более чем на 90% объема опухоли при сохранении единичных опухолевых клеток или их групп, в том числе с выраженными дистрофическими изменениями;
- IV степень: тотальный некроз или организация опухоли без гистологически выявленных жизнеспособных опухолевых клеток.
Для оценки ОО пищевода была предложена схема A.M. Mandard и соавторов [55] (табл. 1), которая в последующем была успешно модифицирована для метастазов в печень [62]. Она включает 5 степеней регрессии опухоли (Tumor Regression Grade — TRG) в зависимости от наличия остаточных опухолевых клеток и степени фиброза. В отличие от классификации ВОЗ, которая делает различие только между полным ответом и регрессией опухоли более чем на 50%, эта система различает степени, при которых ограниченное число опухолевых клеток все еще идентифицируется. При оценке ОО также учитываются качественные изменения опухолевых клеток, такие как вакуолизация и/или эозинофилия цитоплазмы, явления пикноза ядер, некроз, а также степень воспалительной инфильтрации, в том числе наличие гигантских клеток.
Таблица 1 Степени регрессии опухоли в ответ на лечение по A.M. Mandard et al. (1994) [56]
| I степень регрессии опухоли (полная регрессия) (TRGl) — отсутствие опухолевых клеток, наличие очага фиброза на месте опухоли (возможно отсутствие фиброза [63]) | |
| II степень регрессии опухоли (TRG2) — сохранение немногочисленных опухолевых клеток на фоне фиброзных изменений | |
| III степень регрессии опухоли (TRG3) — большое количество сохраненных опухолевых клеток на фоне преобладания фиброза | |
| IV степень регрессии опухоли (TRG4) — опухолевые элементы преобладают над фиброзными изменениями | |
| V степень регрессии опухоли (TRG5) — отсутствие признаков регрессии опухоли, отсутствие фиброза |
Rubbia и соавторы [62], оценивая ответ метастазов печени на лечение, учитывали также относительную распространенность некроза: класс 0 соответствует отсутствию некроза, класс 1 — до 25%; класс 2 — 25–50%, класс 3 — 50–75%; класс 4 — более 75% площади опухоли в состоянии некроза. При множественных метастазах общая оценка осуществляется по худшему показателю. В качестве дополнительного показателя данные авторы обращают внимание на преимущественное распределение живых опухолевых клеток: в центре, диффузное по всему объему либо по периферии опухоли.
Классификация ОО по I.D. Miller и соавторам [58] была разработана с учетом показателей общей выживаемости пациентов в зависимости от степени патоморфологической регрессии опухоли, учитывающей при этом состояние лимфатических узлов. В классификации выделено пять степеней ОО, но только при полном отсутствии опухолевых клеток в первичной опухоли и в регионарных лимфатических узлах устанавливается полный ОО:
- I степень — малозаметные изменения отдельных опухолевых клеток без уменьшения их числа;
- II степень — незначительное уменьшение количества опухолевых клеток, но в целом клеточность опухоли остается высокой;
- III степень — сокращение числа опухолевых клеток вплоть до 90%;
- IV степень — на фоне выраженной (явной) регрессии опухоли выявляются лишь единичные небольшие гнезда опухолевых клеток;
- V степень — опухолевые клетки отсутствуют в первичной опухоли и лимфатических узлах.
Для количественной микроскопической оценки эффективности предоперационной (неоадъювантной) терапии больных со злокачественными новообразованиями предложена К.А. Галахиным и соавторами [4] семиступенчатая шкала, основанная на определении относительной доли жизнеспособной опухолевой ткани (ОДЖОТ):
- 0 степень — ОДЖОТ не менее 95% опухолевых клеток. Лечение неэффективно, результат плохой.
- I степень — ОДЖОТ от 75 до 95% опухолевых клеток. Лечение неудовлетворительное, результат несущественный.
- II степень — ОДЖОТ от 50 до 70% опухолевых клеток. Лечение низкой эффективности, результат посредственный.
- III степень — ОДЖОТ от 25 до 50% опухолевых клеток. Лечение средней эффективности, результат удовлетворительный.
- IV степень — ОДЖОТ от 10 до 25% опухолевых клеток. Лечение с эффектом выше среднего, результат хороший.
- V степень — ОДЖОТ менее 10% опухолевых клеток. Лечение высокой эффективности, результат очень хороший.
- VI степень — отсутствие сохранных опухолевых клеток. Лечение максимально высокой эффективности, результат отличный.
Кельнская система классификации регрессии опухоли (The Cologne Regression Classification System), основанная на принципах классификации ВОЗ и выделяющая 4 класса ОО, изначально предназначалась для оценки карциномы легких [26, 43]. Она базируется на измерении соотношения объема жизнеспособных и некротически измененных элементов опухоли, дополняемых качественными показателями изменений, вызванных терапией. Последние включают в себя главным образом выраженность фиброза, количество гистиоцитов, а в некоторых опухолях — наличие гигантских клеток резорбции. Эти и другие (неспецифические) явления, такие как присутствие лимфоцитов, гранулоцитов и эозинофилов оцениваются полуколичественно (слабая, умеренная и выраженная). Основными характеристиками классов регрессии опухоли являются:
- I класс — минимальная/отсутствие регрессии с сохранением более чем 50% жизнеспособных элементов опухоли;
- II класс — частичная регрессия с сохранением менее чем 50% и более чем 0% жизнеспособных опухолевых элементов;
- III класс — отсутствие жизнеспособных опухолевых элементов;
- IV класс — полная регрессия без каких-либо признаков опухолевого процесса.
Близкой по сути к Кельнской системе классификации регрессии является схема ОО, предложенная Shimosato и соавторами [66], в которой оценка ОО распространяется на лимфатические узлы:
- малая регрессия (классы I/II) с наличием метастазов в лимфатических узлах (ypN1);
- малая регрессия (классы I/II) без метастазов в лимфатические узлы (ypN0);
- выраженная регрессия (классы III/IV) с наличием метастазов в лимфатических узлах (ypN1);
- выраженная регрессия (классы III/IV) без метастазов в лимфатические узлы (ypN0).
Японским обществом исследований рака желудка (The Japanese Research Society for Gastric Cancer) разработана аналогичная классификации ВОЗ четырехуровневая система оценки ОО для рака пищевода, но с несколько иными критериями группировки [42, 68]:
- 1a — отсутствие резидуальных опухолевых элементов;
- 1b — сохранено менее 10% элементов опухоли;
- 2 — сохранено 10–50% элементов опухоли;
- 3 — сохранено 50% и более объема опухолевой ткани.
При ее использовании применительно к раку желудка [28, 66] и пищевода [42] было показано, что вероятность выживания значительно выше в случае регрессии опухоли более чем на ⅔.
Попытка объединить разные количественные и качественные признаки ОО и, таким образом, повысить объективность оценки лечебного патоморфоза и его прогностической значимости предпринята А.А. Суховерша и соавторами [20, 21]. Этот метод включает в себя определение объемов индуцированных терапией изменений опухоли, изменений объемов жизнеспособной, дистрофической и дискомплексированной ткани в остаточной опухоли, характеристики пролиферативной активности и апоптоза онкоцитов, характер и выраженность воспалительной реакции (табл. 2). Степень ОО по А.А. Суховерша и соавторам определяется по сумме балов: 0 степень — 0 баллов; I степень — 1–9 баллов; II степень — 10–18 баллов; III степень — 19–27 баллов. Такой многофакторный подход в оценке ОО, с точки зрения авторов, повышает объективность и прогностическую значимость метода, объясняет случаи ранней генерализации, местных рецидивов опухоли.
Таблица 2 Схема оценки лечебного патоморфоза опухоли по А.А. Суховерша и соавторам [20]
| Структура опухоли | Соотношение объемов индуцированных изменений и первичной опухоли, % | < 30 | 30–70 | > 70 |
| Объем жизнеспособной ткани в остаточной опухоли, % | > 70 | 30–70 | > 30 | |
| Объем дистрофической ткани в остаточной опухоли (нежизнеспособная), % | < 30 | 30–70 | > 70 | |
| Объем дискомплексированой ткани в остаточной опухоли (минимальныеизменения), % | < 30 | 30–70 | > 70 | |
| Качественныеизмененияостаточной опухоли | Количество опухолевых клеток-гигантов | 1 | 2–5 | > 5 |
| Митотическая активность | < 2 | 2 | > 2 | |
| Апоптоз онкоцитов | Единичные | Разрозненные | Многочисленные | |
| Воспалительнаяреакция в опухоли | Характеристика, тип реакции | Альтеративная | Продуктивная | Продутивно-гранулематозная |
| Степень | Очаговая | Диффузная | Диффузно-очаговая |
Гистологически в ОО можно выделить 2 основных этапа изменений — ранние и поздние [4]. Через 7 дней после начала антибластемного лечения в опухолях, независимо от их гистологической разновидности, можно наблюдать типичные дистрофические и альтеративные изменения паренхиматозных элементов на фоне выраженных сосудистых расстройств (стазы, резкое полнокровие, сладж-феномен, микротромбозы, плазмо- и геморрагии) и воспалительную инфильтрацию. Через 2 нед и более от начала неоадъювантной терапии очаги некроза окружаются волокнистой соединительной тканью, и возникает заместительный склероз, гиалиноз, миксоматоз. Вокруг групп опухолевых клеток образуются лимфоплазмоцитарные инфильтраты, появляются гигантские многоядерные клетки инородных тел и ксантомные клетки, образуются лимфоцитарные периваскулярные муфты. Следует особо отметить градиентный характер альтеративных изменений в опухоли, выраженность которых постепенно убывает от центра к ее периферии.
Описанные явления вполне можно характеризовать как стереотипную динамическую реакцию соединительной ткани на альтерацию опухолевой паренхимы, когда молодая пролиферирующая соединительная ткань замещает очаги некрозов и кровоизлияний (5–10-е сутки), а затем подвергается ремоделированию.
Доминирующей морфологической особенностью при умеренной и слабой степени ОО после неоадъювантной терапии злокачественных эпителиальных опухолей пищеварительной трубки является наличие больших площадей жизнеспособных опухолевых элементов, чередующихся с зонами некроза, с отсутствующими или незначительными участками фиброза. При высокой степени ОО с выраженными явлениями фиброза характерно резкое уменьшение или полное исчезновение опухолевых элементов. Это позволило выдвинуть концепцию [34, 39, 62], что некрозы опухолевой паренхимы, скорее всего, связаны с недостаточным кровоснабжением опухоли, в то время как цитотоксические эффекты химиотерапии реализуются с помощью других механизмов, таких как апоптоз.
Как уже упоминалось выше, в большинстве случаев ОО явления некроза или фиброза преобладают в центре, а жизнеспособные элементы опухоли располагаются преимущественно по ее периферии. Такая картина более заметна после химиотерапии в выростах по краям опухоли, где жизнеспособные опухолевые клетки соседствуют с неопухолевыми тканями [62]. Сохранность жизнеспособных опухолевых клеток на периферии новообразования может быть обусловлена более высоким гидростатическим давлением в этих участках и меньшей эффективностью лекарственной диффузии [44]. С практической стороны, обнаружение жизнеспособных клеток на периферии опухоли должно быть принято во внимание при определении объема резекции и может указывать на пределы одноигольной радиоабляции опухоли [69].
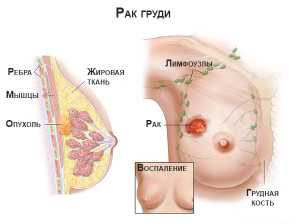
Оценка ОО подразумевает не только определение эффективности терапии, но и прогнозирование течения заболевания для планирования и коррекции последующих этапов лечения, а также определения целесообразности операции [30]. Четко показано, что в таких опухолях, как рак грудной железы [17, 25, 32, 34, 36] гистологический ответ на предоперационную химиотерапию прямо коррелирует с безрецидивной и общей выживаемостью. Высокая степень значимости гистологической оценки ОО как прогностического фактора подтверждена для опухолей двенадцатиперстной кишки, пищевода [55], карцином толстой кишки [31, 63] и ряда других новообразований.
Таким образом, оценка ОО является важным критерием в определении эффективности химио-/лучевой терапии и прогноза онкологического заболевания. Гистологическая оценка ОО на сегодня получила меньшее распространение, чем лучевые методы. Это связано, прежде всего, с трудоемкостью такого исследования и степенью объективности получаемых данных.
Гистологически исследуют лишь часть опухоли, а полученные данные экстраполируют на весь ее объем, предполагая, что изменения, индуцированные терапией, равномерно проявляются во всем ее объеме, что является весьма условным. Также не вполне объективной является оценка соотношения в опухоли жизнеспособной и некротической ткани, поскольку четкие границы между ними отсутствуют. Кроме того, учитывая то, что в опухоли могут наблюдаться спонтанные некрозы, оценка случаев, когда резидуальные опухолевые элементы после химио-/лучевой терапии составляют более 50%, является сомнительной для прогноза заболевания у конкретного пациента. Учет невысоких значений ОО представляет интерес при сравнении групп пациентов с опухолями одинаковой локализации, размеров и гистологического типа у пациентов, не получавших терапию.
Особо следует отметить, что поскольку опухоли различной органной принадлежности и гистологического типа обладают различными свойствами, то объемы резидуальных элементов в разных новообразованиях будут иметь различное прогностическое значение [47, 55, 62].
Основным гистологическим параметром ОО на сегодня является объемная доля сохранивших после лечения жизнеспособность опухолевых элементов. Другие параметры, такие как распространенность некроза, сосудистые изменения, воспалительную инфильтрацию, как правило, рассматривают как дополнительные факторы и оценивают качественно или полуколичественно. Однако понимание того, что для характеристики ОО важна не только оценка объема резидуальных опухолевых элементов, но и других факторов, заставляет исследователей искать пути для создания систем многофакторного анализа ОО.
Исходя из анализа данных литературы, а также опыта работы отдела патологической анатомии Национального института рака, наибольшую ценность гистологическая оценка ОО может иметь при случаях, когда с помощью лучевых методов не отмечают изменения размеров опухоли или это не возможно (внутрикостные опухоли); при резком уменьшении размеров опухоли для выявления остаточных мелких жизнеспособных опухолевых элементов; при сравнительной оценке различных способов терапии.
Если гистологическая оценка ОО проводится не непосредственно при микроскопии препарата наиболее доступными способами (например, с использованием окулярных сеток), то это резко увеличивает время для ее осуществления и приводит к значительному увеличению нагрузки на патолога. Особенно это касается использования систем многофакторной оценки ОО, таких как в методике А.А. Суховерша и соавторов [20, 21].
Учитывая, что при гистологической оценке ОО важным представляется целый ряд признаков, но их учет является крайне трудоемким и длительным, то широкое внедрение высокоэффективных многофакторных способов оценки гистологического ОО возможно лишь на базе автоматизированного анализа.
Исходя из известного факта, что в ряде случаев после достижения хорошего ОО через определенное время возникают рецидивы опухоли и отдаленные метастазы, которые бурно развиваются и проявляют высокую резистентность к терапии, по всей видимости, целесообразно уделять внимание биологическим свойствам резидуальных опухолевых клеток, выявляемых иммуногистохимическими, молекулярными и генетическими маркерами. Вместе с тем при рассмотрении современное состояние вопроса о гистологическом ОО, обращает на себя внимание аспект, что, несмотря на сегодняшнюю «эпоху развитой иммуногистохимии, бурно развивающейся молекулярной биологии и генетики», эти технологии практически не находят места в оценке состояния остаточных элементов опухоли после неоадъювантной терапии. Немногочисленные исследования в этом направлении (например [14, 15, 16, 25, 36, 40, 53, 59, 73]) фрагментарны и неубедительны. Однако в силу гетерогенности неопластических клеток в опухоли часть из них проявляет определенную резистентность к повреждению, а часть подвергается необратимым изменениям. В связи с этим, с нашей точки зрения, свойства резидуальных опухолевых элементов должны представлять интерес для прогнозирования течения онкологического заболевания.
Литература
1. Алексеева М.Л., Гусарова Е.В., Муллабаева С.М., Понкратова Т.С. (2005) Онкомаркеры, их характеристика и некоторые аспекты клинико-диагностического использования (обзор литературы). Проблемы репродукции, 3: 65–78.
2. Василенко И.В., Садчиков В.Д., Галахин К.А. и др. (2001) Предрак и рак желудка. Киев.: Книга-плюс, 229 с.
3. Винтизенко С.И., Слонимская Е.М., Усынин Е.А., Стуканов С.Л. (2009) Использование UBC-теста в качестве уринологического маркера рака мочевого пузыря. Бюллетень сибирской медицины, 2: 113–118.
4. Галахин К.А., Курик Е.Г. (2000) Лечебный патоморфоз злокачественных опухолей пищеварительного тракта. Киев.: Книга-плюс, 176 с.
5. Галахин К.А., Югринов О.Г., Курик Е.Г. и др. (2000) Химиотерапевтический патоморфоз злокачественных опухолей. Укр. хіміотерапевт., 4 (8): 8–11.
6. Журкина О.В. (2007) Лактатдегидрогеназа крови и мочи при доброкачественных и злокачественных новообразованиях почки. Казанский медицинский журнал, 3: 241–243.
7. Кондратьев В.Б. (2000) Метастазы в кости: осложненные формы, гиперкальциемия, синдром компрессии спинного мозга, медикаментозное лечение. Практическая онкология, 2: 41–45.
8. Лавникова Г.А. (1976) Некоторые закономерности лучевого патоморфоза опухолей человека и их практическое использование. Вестн. АМН СССР, 6: 13–19.
9. Лавникова Г.А., Гош Т.Е., Талалаева А.В. (1978) Гистологический метод количественной оценки степени лучевого повреждения опухоли. Мед. радиол., 3: 6–9.
10. Лавникова Г.А. (1979) Гистологический метод количественной оценки терапевтического повреждения опухоли. Москва.: Методические рекомендации, 13 с.
11. Лушников Е.Ф. (1976) Терапевтический патоморфоз опухолей человека в практическом и теоретическом аспектах. Вестник АМН СССР, 6: 7–12.
12. Лушников Е.Ф. (1977) Лучевой патоморфоз опухолей человека. М.: Медицина, 328с.
13. Лушников Е.Ф. (1993) Лечебный патоморфоз опухолей. В книге Патологоанатомическая диагностика опухолей человека. Под ред. Н.А. Краевского, А.В. Смолянникова, Д.С. Саркисова М.: Медицина, 560 с.
14. Мазурик В.К., Мороз Б.Б. (2001) Проблемы радиобиологии и белок р53. Радиационная биология. Радиоэкология. 41(5): 548–572.
15. Максимов С.Я., Гусейнов К.Д., Косников А.Г. и др. (2003) Факторы риска возникновения злокачественных новообразований органов репродуктивной системы женщин. Вопросы онкологии, 49(4): 496–498.
16. Петров С.В., Непомнящая Е.М., Гусарева М.А. (2008) Прогностическое значение некоторых маркеров в меланоме кожи при различных методах лечения. Вопросы онкологии, 6: 744–748.
17. Рошин Е.М., Зубанова А.А., Колядина И.В. и др. (2010) Лечебный патоморфоз как критерий эффективности лечения и прогноза рака молочной железы. Медицинский альманах. РОНЦ РАМН, 3 (12): 48–53.
18. Семенова А.И. (2006) Гиперкальциемия и синдром распада опухоли. Практическая онкология, 7(2): 101–104.
19. Серов В.В. (1997) Учение о патоморфозе: прошлое и настоящее. Арх. патол., 4: 3–5.
20. Суховерша О.А., Біленький І.В., Чекан С.М. (2006) Спосіб оцінки лікувального патоморфозу злоякісної пухлини. Деклараційний патент на корисну модель. № 23830. Опуб. 11.06.2007, бюл. № 8.
21. Суховерша О.А., Біленький І.В., Чекан С.М., Коссе В.А. (2007) Оцінка хіміотерапевтичного патоморфозу недрібноклітинного раку легенів. Морфологія, 1(2): 82–90.
22. Adam R., Delvart V., Pascal G. et al. (2004) Rescue surgery for unresectable colorectal liver metastases down staged by chemotherapy: a model to predict long-term survival. Ann Surg., 240 (4): 644–657.
23. Adelstein D., Rice T., Becker M. et al. (1997) Use of concurrent chemotherapy, accelerated fractionation radiation and surgery for patients with esophageal carcinoma. Cancer, 80: 1011–1020.
24. Ajani J.A., Mansfield P.F., Janjan N. et al. (2004) Multi-institutional trial of preoperative chemoradiotherapy in patients with potentially resectable gastric carcinoma. Journal of Clinical Oncology, 22 (14): 2774–2780.
25. Archer C.D., Parton M., Smith I.E. et al. (2003) Early changes in apoptosis and proliferation following primary chemotherapy for breast cancer Br J Cancer. 15; 89(6): 1035–1041.
26. Baldus S., Monig S., Schroder W. et al. (2004) Regression of oesophageal carcinomas after neoadjuvant radiochemotherapy: criteria of the histopathological evaluation. Pathologe, 25: 421–427.
27. Bates B., Detterbeck F., Bernard S. et al. (1996) Concurrent radiation therapy and chemotherapy followed by esophagectomy for localized esophageal carcinoma. J. Clin. Oncol., 14: 156–163.
28. Becker K., Mueller J., Schulmacher C. et al. (2003) Histomorphology and grading of regression in gastric carcinoma treated with neoadjuvant chemotherapy. Cancer, 98: 1521–1530.
29. Bertheau P., Lerebours F., Mounier N. et al. (2005) Prognostic significance of a combined clinicopathologic score for response to primary systemic therapy in locally advanced breast cancer. Oncol Rep., 14 (2): 513–520.
30. Bollschweiler E., Hölscher A.H, Metzger R. (2010) Histologic tumor type and the rate of complete response after neoadjuvant therapy for esophageal cancer. Future Oncology, 6 (1): 25–35.
31. Bouzourene H., Bosman F.T., Seelentag W. et al. (2002) Importance of tumor regression assessment in predicting the outcome in patients with locally advanced rectal carcinoma who are treated with preoperative radiotherapy. Cancer, 94 (4): 1121–1130.
32. Bramwell V.H. (1997) The role of chemotherapy in the management of non-metastatic operable extremity osteosarcoma. Semin Oncol., 24 (5): 561–571.
33. Brown W., Thomas J., Gotley D. et al. (2004) Use of oesophagogastroscopy to assess the response of oesophageal carcinoma to neoadjuvant therapy. Br. J. Surg., 91: 199–204.
34. Chang J., Ormerod M., Powles T.J. et al. (2000) Apoptosis and proliferation as predictors of chemotherapy response in patients with breast carcinoma. Cancer, 89 (11): 2145–2152.
35. Chollet P., Amat S., Cure H. et al. (2002) Prognostic significance of a complete pathological response after induction chemotherapy in operable breast cancer. Br J Cancer, 86 (7): 1041–1046.
36. Darcy K.M., Birrer M.J. (2010) Translational research in the Gynecologic Oncology Group: evaluation of ovarian cancer markers, profiles, and novel therapies. Gynecol Oncol.; 117(3): 429–39.
37. Eisenhauer E.A., Therasse P., Bogaerts J. et al. (2009) New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1). European journal of cancer, 45: 228–247
38. Fernandez F.G., Drebin J.A., Linehan D.C. et al. (2004) Five-year survival after resection of hepatic metastases from colorectal cancer in patients screened by positron emission tomography with F-18 fluorodeoxyglucose (FDG-PET). Ann Surg., 240 (3): 438–447.
39. Gourdier I., Crabbe L., Andreau K. et al. (2004) Oxaliplatin-induced mitochondrial apoptotic response of colon carcinoma cells does not require nuclear DNA. Oncogene, 23 (45): 7449–7457.
40. Grossman H.B., Tangen C.M., Cordon-Cardo C. et al. (2006) Evalution of Ki67, р53 and angiogenesis in patients enrolled in a randomized study of neoadjuvant chemotherapy with or without cystectomy: a Southwest Oncology Group Stydy. Oncol Rep. Oct; 16(4): 807–810.
41. Janjan N.A., Khoo V.S., Abbruzzese J. et al. (1999) Tumor downstaging and sphincter preservation with preoperative chemoradiation in locally advanced rectal cancer: The M.D. Anderson Cancer Center experience. Int J Radiat Oncol Biol Phys., 44: 1027–1038.
42. Japanese Society for Esophageal Diseases: Guidelines for the Clinical and Pathologic Studies on Carcinoma of the Esophagus (9th Edition). Kanehara and Co. Ltd, Tokyo, Japan (2001).
43. Junker K., Muller K., Bosse U. et al. (2003) Apoptosis and tumor regression in locally advanced non-small cell lung cancer with neoadjuvant therapy. Pathologe, 24: 214–219.
44. Heldin C.H., Rubin K., Pietras K. et al. (2004) High interstitial fluid pressure — an obstacle in cancer therapy. Nat Rev Cancer, 4 (10): 806–813.
45. Husband J.E., Schwartz L.H., Spencer J. et al. (2004) Evaluation of the response to treatment of solid tumours — a consensus statement of the International Cancer Imaging Society. Br J Cancer, 90(12): 2256–2260.
46. Huggia F.M. (1990) Overview of cancer related hypercalcemia: epidemiology and etiology. Semin. Oncol., 17: 3–9.
47. Huvos A.G., Rosen G., Dabska M., Marcove R.C. (1983) Mesenchymal chondrosarcoma a clinicopathologic analysis of 35 patients with emphasis on treatment. Cancer, 51 (7): 1230–1237.
48. Huvos A. G. (1991) Osteogenic sarcoma: pathologic assessment of preoperative (neoadjuvant) chemotherapy. In: Bone tumors: Diagnosis, treatment and prognosis. 2nd edition, W.B.Saunders, Philadelphia: 122–128.
49. Pawlik T.M., Scoggins C.R., Zorzi D. et al. (2005) Effect of surgical margin status on survival and site of recurrence after hepatic resection for colorectal metastases. Ann Surg., 241 (5): 715–722. discussion 722–724.
50. Picci P., Böhling T., Bacci G., Ferrari S. et al. (1997). Chemotherapy-induced tumor necrosis as a prognostic factor in localized Ewing’s sarcoma of the extremities. J Clin Oncol.,15 (4): 1553–9.
51. Kaminsky-Forrett M.C., Conroy T., Luporsi E. et al. (1998) Prognostic implications of downstaging following preoperative radiation therapy for operable T3–T4 rectal cancer. Int J Radiat Oncol Biol Phys., 42: 935–941.
52. Kwok H., Bissett I.P, Hill G.L. (2007) Preoperative staging of rectal cancer. Int J Colorectal Dis, 15: 9–20.
53. Lazar A.A., Cole B.F., Bonetti M., Gelber R.D. (2010) Evaluation of treatment-effect heterogeneity using biomarkers measured on a continuous scale: subpopulation treatment effect pattern plot. J Clin Oncol. 10; 28(29): 4539–44.
54. Licitra L., Locati L.D., Cavina R. et al. (2003) Primary chemotherapy followed by anterior craniofacial resection and radiotherapy for paranasal cancer. Ann Oncol., 14 (3): 367–372.
55. Mandard A.M., Dalibard F., Mandard J.C. et al. (1994) Pathologic assessment of tumor regression after preoperative chemoradiotherapy of esophageal carcinoma. Clinicopathologic correlations. Cancer, 73 (11): 2680–2686.
56. Mentha G., Majno P., Gervaz P. et al. (2006) Results of inverse strategy using systemic chemotherapy first, liver resection second and primary tumour resection last for patients with advanced synchronous liver metastases from colorectal cancer (SCRLM). Br J Surg., 93: 872–878.
57. Miller A., Hoogstraten B., Staquet M., Winkler A. (1981) Reporting results of cancer treatment. Cancer, 47: 207–214.
58. Miller I.D., Payne S., Ogston K.N. (2002) A new histological grading system to assess response of breast cancer to primary chemotherapy. Int J Oncol., 20 (4): 791–796.
59. Moreno Garcia V., Cejas P., Feliu J. et al. (2009) Immunohistochemical analysis of tumor regression grade for rectal cancer after neoadjuvant chemoradiotherapy. J Clin Oncol, 27 (suppl; abstr e22089).
60. Motzer R..J., Masumdar M., Bacic J. et al. (1999) Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma. J. Clin. Oncol., 17 (8): 2530–2540.
61. Ribeiro A., Franceschi D., Parra J. et al. (2006) Endoscopic ultrasound restaging after neoadjuvant chemotherapy in esophageal cancer. Am. J. Gastroenterol, 101: 1216–1221.
62. Rubbia-Brandt L., Giostra E., Brezault C. et al. (2007) Importance of histological tumor response assessment in predicting the outcome in patients with colorectal liver metastases treated with neo-adjuvant chemotherapy followed by liver surgery. Ann Oncol., 18 (2): 299–304.
63. Rullier A., Laurent C., Vendrely V. et al. (2005) Impact of colloid response on survival after preoperative radiotherapy in locally advanced rectal carcinoma. Am J Surg Pathol., 29 (5): 602–606.
64. Sarkaria I., Rizk N., Bains M. et al. (2009) Post-treatment endoscopic biopsy is a poor-predictor of pathologic response in patients undergoing chemoradiation therapy for esophageal cancer. Ann. Surg., 249: 764–767.
65. Schott A.F., Roubidoux M.A., Helvie M.A. et al. (2005) Clinical and radiologic assessments to predict breast cancer pathologic complete response to neoadjuvant chemotherapy. Breast Cancer Res Treat., 92 (3): 231–238.
66. Schneider P., Baldus S., Metzger R. et al. (2005) Histomorphologic tumor regression and lymph node metastases determine prognosis following neoadjuvant radiochemotherapy for esophageal cancer: implications for response classification. Ann. Surg., 242: 684–692.
67. Schneider P., Metzger R., Schaefer H. et al. (2008) Response evaluation by endoscopy, rebiopsy, and endoscopic ultrasound does not accurately predict histopathologic regression after neoadjuvant chemoradiation for esophageal cancer. Ann. Surg., 248: 902–908.
68. Shimosato Y., Oboshi S., Baba K. (1971) Histological evaluation of effects of radiotherapy and chemo-therapy for carcinomas. Jpn. J. Clin. Oncol., 1: 19–35.
69. Solbiati L., Livraghi T., Goldberg S.N. et al. (2001) Percutaneous radio-frequency ablation of hepatic metastases from colorectal cancer: long-term results in 117 patients. Radiology, 221 (1): 159–166.
70. Theodoropoulos G., Wise W.E., Padmanabhan A. et al. (2002) T-level downstaging and complete pathologic response after preoperative chemoradiation for advanced rectal cancer result in decreased recurrence and improved disease-free survival. Dis Colon Rectum, 45: 895–903.
71. Therasse P., Arbuck S.G., Eisenhauer E.A. et al. (2000) New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J Natl Cancer Inst, 92 (3): 205–216.
72. Yonemura Y., Kinoshita K., Fujimura T. et al. (1996) Correlation of the histological effects and survival after neoadjuvant chemotherapy on gastric cancer patients. Hepatogastroenterology, 43: 1260–1272.
73. Yuen P.W., Man M., Lam K.Y., Kwong Y.L. (2002) Clinicopathological significance of pi6 gene expression in the surgical treatment of head and neck squamosus cell carcinomas. J. Clin. Pathol., 55 (1): 58–60.
О.М. Грабовий, Т.О. Тарасова, М.В. Кошубарова
Національний інститут раку, Київ
Резюме. Оцінка відповіді пухлини на лікування (ВП) є важливим критерієм ефективності хіміо-/променевої терапії та прогнозу онкологічного захворювання. Променеві та клінічні методи, надаючи цінну інформацію, все ж не дають повної характеристики ВП і мають бути доповнені гістологічним дослідженням, яке, окрім детальної оцінки ефективності терапії, значно підвищує достовірність прогнозу. Основним гістологічним параметром при оцінці ВП сьогодні є об’єм пухлинних елементів, що зберегли життєздатність. Однак розуміння того, що для характеристики ВП важлива не тільки оцінка обсягу резидуальних пухлинних елементів, а й інших ознак, змушує дослідників шукати шляхи для створення систем багатофакторного аналізу ВП, придатних для широкого повсякденного використання в медичній практиці.
Ключові слова: відповідь пухлини на лікування, гістологія, лікувальний патоморфоз
A.N. Grabovoy, T.O. Tarasova, M.V. Koshubarova
National Cancer Institute, Kiev
Summary. Assessment of tumor response to treatment (TR) is an important criterion for the effectiveness of chemo-/radiation therapy and prognosis of oncological disease. Ray and clinical methods, providing valuable information, yet do not give the full characteristics of TR and should be supplemented by histological examination, which in addition to a detailed assessment of the effectiveness of therapy, significantly improves the accuracy of prediction of disease. The main histological parameter in the evaluation of TR today is the amount of viable tumor-treasured items. However, understanding what is important to characterize the TR is not only an estimate of the amount of residual tumor elements, but other features, makes the researchers look for ways to create a multivariate analysis, TR systems are suitable for a wide general use in medical practice.
Key words: tumor response to treatment, histology, treatment pathomorphosis.
www.clinicaloncology.com.ua
Лечебный патоморфоз злокачественных опухолей: клинические и морфологические критерии. Классификации. Прогностическое значение лечебного патоморфоза при раке молочной железы и других опухолях Текст научной статьи по специальности «Медицина и здравоохранение»
Лечебный патоморфоз злокачественных опухолей: клинические и морфологические критерии. Классификации. Прогностическое значение лечебного патоморфоза при раке молочной железы и других опухолях
А.А. Лисаева1, Я.В. Вишневская2, Е.М. Рощин1, Д.В. Комов1, И.В. Колядина3
Отделение диагностики опухолей,
2патологоанатомическое отделение ФГБУРОНЦ им. Н.Н. Блохина РАМН;
3кафедра онкологии РМАПО, Москва
Контакты: Ирина Владимировна Колядина irinakolyadina@yandex.ru
Патоморфоз — один из важнейших факторов прогноза рака молочной железы. В статье дано понятие патоморфоза и его вариантов, а также представлены наиболее распространенные классификации патоморфологических изменений в опухоли. Рассмотрены отдаленные результаты неоадъювантного лечения в зависимости от патоморфоза.
Ключевые слова: молочная железа, лечебный патоморфоз
Therapeutic pathomorphism of malignancies: Clinical and morphological criteria. Classifications. Prognostic value of therapeutic pathomorphism in breast cancer and other tumors
A.A. Lisayeva1, Ya.V. Vishnevskaya2, E.M. Roshchin1, D.V. Komov1, I.V. Kolyadina3
Department of Tumor Diagnosis, N.N. Blokhin Russian Cancer Research Center, Russian Academy of Medical Sciences;
2Department of Pathologic Anatomy, N.N. Blokhin Russian Cancer Research Center, Russian Academy of Medical Sciences;
3Department of Oncology, Russian Medical Academy of Postgraduate Education, Moscow
Pathomorphism is one of the most important prognostic factors for breast cancer. The paper gives the notion of pathomorphism an d its types and the most commonly used classifications of tumor pathomorphological changes. It also considers the long-term results of neoadjuvant treatment in relation to pathomorphism.
Key words: breast cancer, therapeutic pathomorphism
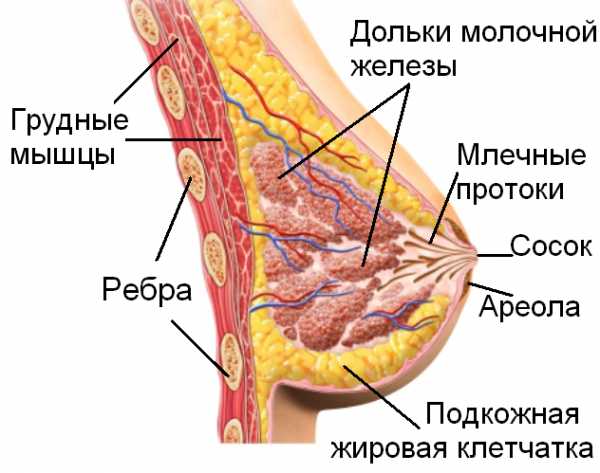
До середины 1960-х годов морфологическое исследование опухоли при раке молочной железы (РМЖ) проводилось в целях определения ее гистологического строения, а также состояния регионарных лимфатических узлов (ЛУ). Внедрение неоадъювант-ного метода в качестве нового подхода при местнораспространенном РМЖ (для уменьшения размеров опухоли, размеров и числа пораженных ЛУ, увеличения шансов на выполнение органосохраняющего лечения, элиминации субклинических микрометастазов) привело к расширению перечня изучаемых гистологических характеристик опухоли, появлению иммуноги-стохимических показателей и молекулярно-биологических маркеров, а также к обязательному изучению лечебного патоморфоза как показателя чувствительности опухоли к проведенному лечению и важнейшего фактора при планировании адъювантного лечения.
Лечебный патоморфоз — это типовые и стойкие изменения клинических и морфологических проявлений опухоли под воздействием лечения (Я.Л. Раппопорт, 1962 г.; Е.Ф. Лушников, 1977 г.; Н.А. Краевский,
1976 г.) [1].
Эффективность предоперационного лекарственного лечения у больных РМЖ клинически определяется по субъективному и объективному эффектам. Критерием эффекта служит уменьшение размеров опухоли и пораженных ЛУ. Патоморфологический эффект определяется изменениями опухоли на клеточном уровне и проявляется дистрофией и апоптозом клеток, формированием полей некроза, развитием очагов фиброза и склероза. Кроме того, в этих очагах отмечаются вторичные реактивные изменения — кровоизлияние разной степени давности с отложениями гемосидерина, скоплениями гемосидерофагов, очаговой воспалительной инфильтрацией. По данным S.K. Apple и Е Suthar [2], субъективный клинический эффект, оцениваемый физикально (пальпаторно), часто имеет тенденцию к преувеличению. Объективный клинический эффект определяется ст епенью уменьшения опухоли, числа и размеров патологически измененных ЛУ при инструментальных методах исследования. При сравнении точности данных физи-кального и ультразвукового исследований, маммографии и магнитно-резонансной томографии, макро-
Маммология
Маммология
и микроскопической оценок у становлено, что наиболее точным методом является микроскопическая оценка размеров опухоли. Все прочие методики склонны переоценивать результаты неоадъювантного лечения (преуменьшать размеры остаточной опухоли) либо недооценивать их (преувеличивать размеры опухоли). Макроскопическая оценка размеров опухоли совпадает с микроскопической оценкой только в 19 % случаев, в 56 % наблюдений размеры остаточной опухоли преувеличены, а в 25 % — преуменьшены. Причинами для такой неточной оценки при макроскопическом исследовании размеров опухоли являются диффузный фиброз или разрозненные опухолевые клетки, не видимые и не доступные при пальпации и применении инструментальных методов визуализации опухоли, а также погрешности при секции удаленного материала (интервалы секции > 1 см).
Различные подходы к классификации лечебного патоморфоза в зависимости от степени морфологических изменений были предприняты как отечественными, так и зарубежными авторами. В России основные положения изложены в работах ГА. Лавниковой (1972), Е.Ф. Лушникова (1977), Н.А. Краевского (1977).
В Великобритании патологоанатомы используют классификацию I.D. Miller и S. Payne (1999), а во Франции конкурируют классификации В. Chevallier (1993) и D.M. Sataloff (1995). Т акже известны работы S. Akashi-Tanaka et al. (1996), A.H. Honkoop et al. (1998), H.M. Kuerer et al. (1998), I.C. Smith et al. (2000).
Для гистологической оценки степени повреждения опухоли после облучения Г .А. Лавниковой была разработана схема (1973, 1976), применимая к опухолям различной локализации и разных гистологических форм. Согласно данной схеме к IV степени повреждения относят полное исчезновение паренхиматозных элементов опухоли. В этом случае в препаратах иногда могут определяться лишь «следы» бывшей опухоли в виде гранулем вокруг роговых масс (при плоскоклеточном раке), очагов некроза, лишенных клеточных элементов, или «озер» слизи (п ри слизеобразующих опухолях).
При III степени структура опухоли резко нарушена за счет фиброзного замещения, обширного некроза или круглоклеточной инфильтрации, выраженных в разных опухолях в неодинаковой степени; на этом фоне определяют остатки опухоли в виде разрозненных групп паренхиматозных клеток, обычно с резкими дистрофическими изменениями.
Ко II степени относят облученные опухоли, в которых, несмотря на сохранение основной массы паренхимы, отчетливо видны очаги регрессивных изменений различного характера при наличии выраженных дистрофических изменений в клетках.
При I степени повреждения заметных изменений в общей структуре опухоли отметить не удается, име-
ются лишь несвойственные данному новообразованию полиморфизм и дистрофия клеток, а также подавление митозов.
Согласно классификации Е.Ф. Лушникова выделены 4 степени лечебного патоморфоза:
• I степень — изменения на молекулярном и субклеточном уровне. В тканях, окружающих опухолевые комплексы, изменения не выражены;
• II степень — повреждение в основном паренхиматозных элементов опухоли (дистрофические и не-кробиотические изменения клеток опухоли, нарушения деления клеток с появлением гигантских форм). В строме опухоли — сосудистые изменения, активация клеток соединительной ткани;
• III степень — нарушение типичной структуры опухоли в результате массовой гибели опухолевых клеток (поля некроза, выраженные сосудистые расстройства, разрастание соединительной ткани). Сохраняются устойчивые к терапии популяции опухолевых клеток без грубых повреждений, которые в дальнейшем могут приводить к развитию рецидива опухоли. Большое число «лучевых гигантов». В окружающих тканях — атрофические и дистрофические изменения;
• IV степень — замещение некротизированной опухолевой ткани соединительной тканью, импрегнация ее солями извести, кистообразование. В окружающих тканях — атрофические, дистрофические и склеротические изменения.
В классификации I.D. Miller и S. Payne (далее Miller— Payne) выделено 5 степеней патоморфоза в ответ на лекарственное лечение. Важно, что в этой классификации учитываются изменения в клеточности опухоли по сравнению с материалом, полученным при выполнении кор-биопсии до начала лечения. Таким образом, морфолог при оценке патоморфологического эффекта имеет возможность детально изучить структуру первичной опухоли и более точно подойти к оценке лечебного патоморфоза. При отсутствии опухолевых клеток в первичной опухоли и в регионарных ЛУ у станавливается полный патоморфологический ответ (рathologic Complete Response — pCR, см. таблицу) [3].
В. Chevallier et al. в своей классификации (1993) выделяют 4 класса морфологических изменений, но, в отличие от предыдущих классификаций, классы пронумерованы в обратном порядке:
• класс 1 (Ch2) — полное исчезновение опухолевых клеток в ткани молочной железы и ЛУ;
• класс 2 (Ch3) — наличие рака in situ в молочной железе, в ЛУ опухолевые клетки не определяются;
• класс 3 (Ch4) — инфильтративный рак на фоне повреждения стромы (склероз, фиброз стромы);
• класс 4 (Ch5) — отсутствие изменений или незначительные изменения в опухоли [4].
Классификация по Chevallier представляется наиболее лаконичной, отражающей основные этапы де-
Классификация степеней лечебного патоморфоза по Miller—Payne
Степень патоморфоза Характеристика изменений в опухоли
I Малозаметные изменения отдельных опухолевых клеток, но без уменьшения их числа
II Незначительное уменьшение клеточности (< 30 % опухоли)
III Сокращение числа опухолевых клеток от 30 до 90 %
IV Выраженное исчезновение инвазивных клеток. Определяются лишь широко рассеянные небольшие гнезда клеток (> 90 % клеточных потерь)
V (pCR) Опухолевые клетки в секционных срезах из места расположения первичной опухоли не определяются
градации опухолевой ткани. Так же как и для любого подобного исследования, значение этой классификации и достоверность выделения отдельных классов будут определяться различиями в отдаленных результатах, полученными для каждой отдельной группы пациенток со своим достигнутым классом лечебного патоморфоза.
В классификации D.M. Sataloff et al. (1995) полное исчезновение опухолевых клеток и рак in situ объединены в одну группу — полного или почти полного морфологического эффекта. В этой классификации учтены изменения, выявленные в ткани молочной железы, а также в ЛУ. В связи с тем что в работе проводили сравнение лечебных (клинических) изменений с морфологическими изменениями в опухоли и ЛУ , в классификации представлены данные клинического и морфологического эффектов [5].
В ткани молочной железы:
• Т—А — полный или почти полный лечебный эффект, свидетельствующий о наличии минимальной остаточной опухоли (рассеянные опухолевые клетки на площади < 5 % ложа опухоли при обязательной оценке всей опухолевой поверхности или оценке > 15 полей зрения). Клетки могут быть рассеяны или сгруппированы;
• Т—В — субъективно лечебный эффект > 50 %;
• Т—С — субъективно лечебный эффект < 50 %;
• Т—D — отсутствие лечебного эффекта.
В ЛУ:
• N—A — отсутствие признаков метастатического поражения ЛУ, выраженный лечебный эффект;
• N—B — отсутствие признаков метастатического поражения ЛУ и лечебного эффекта;
• N—C — наличие признаков метастатического поражения ЛУ, лечебный эффект не выражен;
• N—D — метастазы в ЛУ без признаков лечебного патоморфоза.
Сравнение классификаций D.M. Sata1off и В. ^е-vallier было проведено в работе Е РепаиЬ^1огса et а1. [6] на примере 710 больных, получивших нео-адъювантную полихимиотерапию по поводу РМЖ П-Ш стадий. Внутри каждой классификации осуществляли сравнение отдаленных результатов между группой с полным и почти полным морфологическими эффектами (^ 1 + 2 и Sa А) и группой с неполным морфологическим эффектом или с незначительными изменениями в опухоли (^ 3 + 4 и Sа В + С + D). Продемонстрированы значительные различия в показателях общей (ОВ) и безрецидивной (БРВ) выживаемости (рис. 1, 2). Однако при сравнении отдаленных показателей внутри группы больных (^ 1 + 2
%
Месяцы
Рис. 1. ОВ в зависимости от патоморфологического эффекта по D.M. Sataloff et al.
%
Месяцы
Рис. 2. ОВ в зависимости от патоморфологического эффекта по B. Chevallier et al.
Маммология
Маммология
Критерий RCB
Рис. 3. БРВ в зависимости от критерия RCB
и Sa A), где был достигнут полный морфологический эффект (pCR — без опухолевых клеток в молочной железе и ЛУ), и группой, у которой был получен почти полный морфологический эффект (рак in situ в опухоли и ЛУ), значимых различий в показателях ОВ и БРВ не обнаружено. Таким образом, по данным этих авторов, наличие рака in situ после неоадъювантного лечения при условии проведения адекватного адъювантного лечения не влияет на отдаленные результаты.
Согласно классификации A.H. Honkoop et al. (1998) выделяют 3 варианта морфологического ответа [7]:
• полный (pCR) — при макро- и микроскопическом изучении ткани молочной железы и ЛУ не выявлено признаков остаточной инвазивной опухоли;
• частичный — макроскопически опухоль не определяется, но при микроскопии обнаружены рассеянные фокусы клеток;
• диффузный — микроскопически опухоль не определяется, но имеет место обширная инфиль тра-ция ткани.
R. Burcombe et al. [8] вообще отказались от указанных выше классификаций, мотивируя это отсутствием общепринятой схемы, и предложили свой вариант оценки патоморфологического ответа опухоли:
• полный ответ — отсутствие остаточной инвазивной опухоли;
• частичный ответ — остаточная инвазивная опухоль с явлениями патоморфоза (увеличенные клетки с вакуо-лизированной цитоплазмой, увеличенные пористые ядра с выступающим эозинофильным ядрышком, увеличенные гиперхромные ядра с неровными контурами);
• стабилизация болезни — инвазивная опухоль без признаков морфологических изменений.
Однако из этой классификации неясно, к какой группе следует отнести рак in situ.
Таким образом, несмотря на сходства и различия в предложенных классификациях, одним из наиболее обсуждаемых вопросов остается определение полного лечебного патоморфоза (полное отсутствие опухолевых клеток или наличие рака in situ). Этот вопрос актуален прежде всего потому, что неизвестно, какое влияние оказывает наличие рака in situ или разрозненных опухолевых клеток на отдаленные результаты лечения.
В 2006 г. Международной экспертной группой (International Expert Panel) было рекомендовано определять полный морфологический эффект как отсутствие инфильтративного рака и рака in situ как в опухоли, так и в ЛУ.
W. Symmans et al. [9] предложили иску сственный критерий — RCB (Residual Cancer Burden — ложе остаточной опухоли), позволяющий предсказывать БРВ на основании измерения остаточной опухоли (двухмерные показатели с учетом возможной асимметрии опухоли), клеточности опухоли (по классификации Miller—Payne), наличия рака in situ, а также числа и размера пораженных ЛУ. Критерий RCB рассчитывается по формуле с помощью калькулятора (Residual Burden Calculator) на сайте M.D. Anderson Cancer Center, где также можно отнести полученный результат к одной из 3 групп (RCB I, II, III), каждая из которых соответствует низкому, промежуточному и высокому риску развития отдаленных метастазов (рис. 3) [10, 11].
Связь патоморфоза с отдаленными резуль татами показана во многих исследованиях. Объективный клинический ответ традиционно считается значимым фактором прогноза РМЖ, хотя в исследовании NSABP-B18, посвященном изучению неоадъювантной ХТ, было продемонстрировано, что объективный ответ предсказывает БРВ, но не ОВ [12, 13]. В работе Н.А. Огнерубова [14] получены результаты относительно ОВ и БРВ в зависимости от патоморфоза. Полная регрессия опухоли (IV степень по ГИ. Лавниковой) сопровождалась максимальными показателями ОВ: 3-, 5-, 10- и 15-летняя выживаемость у пациенток этой группы составила 100; 92,3; 83,1 и 83,1 % соответственно. Напротив, при слабовыраженном патоморфозе ОВ на аналогичных сроках достигала 57,8; 42,3; 28,7 и 28,7 % соответственно. Аналогичная тенденция прослеживалась и в отношении БРВ: при полном пато-морфозе показатели 3-, 5- и 10-летней выживаемости составили 85,6; 76,1 и 76,1 %, при слабом — 42,9; 33,7 и 28,7 %. Различия в показателях между полной регрессией опухоли и слабым, а также умеренным патомор-фозом были статистически значимы. Медиана ОВ при отсутствии опухоли в препарате не определялась, при слабом патоморфозе она достигала всего 44,9 мес.
Таким образом, несмотря на большое сходство представленных классификаций, в патоморфологичес-
кой оценке эффекта от лечения нет общепринятых международных стандартов, позволяющих патологоанатомам общаться между собой на одном языке и вносить в принятую схему обновления соответственно последним данным о лечении онкологических боль-
ных. Разногласия в определении полного па томор-фологического эффекта не позволяют сделать окончательные выводы в отношении интенсивности неоадъювантного и адъювантного лечения больных РМЖ.
1. Патологоанатомическая диагностика опухолей человека. Руководство в двух томах. Под ред. Н.А. Краевского,
А.В. Смольянникова. М.: Медицина,
1993. Т1; с. 130-58.
2. Apple S.K., Suthar F. How do we measure a residual tumor size in histopathology (the gold standard) after neoadjuvant chemotherapy?
Breast 2006;15(1):370—6.
3. Miller I.D., Payne S., Ogston K.N. A new gistological grading system to assess response of breast cancer to primary chemotherapy.
Int J Oncol 2002;20(4):791—6.
4. Chevallier B., Roche H., Olivier J.P. et al. Inflammatory breast cancer. Pilot study of intensive induction chemotherapy (FEC-HD) results in a high histologic response rate.
Am J Clin Oncol 1993;16:223-8.
5. Sataloff D.M., Mason B.A., Prestipino A.J. et al. Pathologic response to induction chemotherapy in locally advanced carcinoma
ЛИТЕРАТУРА
of the breast: a determinant of outcome.
J Am Coll Surg 1995;180:297-306.
6. Penault-Llorca F., Abrial C., Raoelfils I. et al. Comparison of the prognostic significance of Chevallier and SatalofT s pathologic classifications after neoadjuvant chemotherapy of operable breast cancer.
Hum Pathol 2008;39:1221-8.
7. Honkoop A.H., Pinedo H.M., De Jong J.S. et al. Effects of chemotherapy on pathologic and biologic characteristics of locally advanced breast cancer. Am J Clin Pathol 1997; 107:211-8.
8. Burcombe R.J., Makris A., Richman P.I.
et al. Evaluation of ER, PgR, Her-2 and Ki-67 as predictors of response to neoadjuvant anthracycline chemotherapy for operable breast cancer. Br J Cancer 2005;92(1):147—55.
9. Symmans W.F., Peintinger F., Hatzis C. et al. Measurement of residual breast cancer burden to predict survival after neoadjuvant chemotherapy. J Clin Oncol 2007;25:4414-22.
10. Kaufmann M., Hortobagyi G.N., Goldhirsch A. et al. Recommendations from an international expert panel on the use of neoadjuvant (primary) systemic treatment of operable breast cancer: an update. J Clin Oncol 2006;24:1940-9.
11. www.mdanderson.org/breastcancer_RCB
12. Fisher E.R., Wang J., Bryant J. Pathobiology of preoperative chemotherapy: findings from the National Surgical Adjuvant Breast and Bowel (NSABP) protocol B-18. Cancer 2002;95:681-95.
13. Fisher B., Brown A., Mamounas E. et al. Effect of preoperative chemotherapy on local-regional disease in women with operable breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-18.
J Clin Oncol 1997;15:2483-93.
14. Огнерубов Н.А. Неоадъювантная терапия местно-распространенного рака молочной железы. Автореф. дис. ... д-ра мед. наук. М., 1992.
Маммология
cyberleninka.ru
Лечение рака молочной железы т3-4n0m0 стадий
Лечение опухолей молочной железы
Н
р
ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ T3 — 4N0M0 СТАДИЙ
К.В. Максимов, И.В. Высоцкая, В.Д. Ермилова, В.П. Летягин, Е.М. Погодина,
Г.Ю. Чемерис, А.Д. Зикиряходжаев, Е.А. Ким, Г.В. Мартынова
ГУ РОНЦ им. Н.Н. Блохина РАМН, Москва
TREATMENT OF THE T3—4N0M0 BREAST CANCER K.V. Maximov, I.V. Visotzkaya, V.D. Yermilova, V.P. Letyagin, Ye.M. Pogodina,
G.Yu. Chemeris, A.D. Zikiryakhodzhayev, Ye.A. Kim, G.V. Martinova
N.N. Blokhin Cancer Research Center of Russian Academy of Medical Sciences, Moscow
The aim of the study was to determine the most effective regimens of the neo- and adjuvant therapy of the primary breast cancer of the T3—4N0M0 stages. The data of the clinical observations of the 145 patients with the locally advanced T3—4N0M0 breast cancer, who underwent treatment in the N.N.Blokhin CRC over the period of1998—2003, were used in the study. The mean age of the patients was 55,3±12,9 years (from 19 to 83 years, median-55 years). The duration of the observation of the patients was 46,5±28,51 months (from 3,6 to 109,4 months, median-44,5 months). For patients with the breast cancer of the T3—4N0M0 stages combined treatment modality was implemented with the use of neo- and adjuvant therapy in all the cases.
Рак молочной железы (РМЖ) прочно удерживает первое место в структуре онкологической заболеваемости. Статистические данные последнего десятилетия свидетельствуют о неуклонном росте показателей заболеваемости и смертности как во всем мире, так и в России. С 1993 по 2003 г. стандартизированные показатели заболеваемости РМЖ в России увеличились на 19%, смертности — на 12%. Ежегодный прирост заболеваемости составляет около 5,8% [1]. Немаловажную роль в исходе заболевания играют состояние овариально-менструальной функции женщины, ее возраст, состояние репродуктивной системы, генетические факторы, особенности характера питания, наличие дисгормональных заболеваний молочных желез [2—5]. Спорным до настоящего времени остается вопрос о выборе тактики лечения РМЖ при разных стадиях злокачественного процесса [3]. В особенности интерес представляет группа больных, у которых выраженный неопластический процесс поражает большой объем ткани железы и в то же время не метастазирует в регионарные лимфатические узлы (Т3—'4^М0). Непонятно, почему опухоль, достигнув «критической массы» (более 5 см в диаметре), не распространяется по регионарным лимфоколлекторам. Возможно, это связано с особенностями биологических характеристик при подобных процессах. В связи с этим прежде всего возникает ряд вопросов: нужно ли этим больным проводить неоадъювантное лечение и если да, то какое? На каком из этапов следует провести хирургическое вмешательство и необходимо ли дополнить его адъювантной терапией? Если да, то какой?
По определению, операбельность при РМЖ подразумевает не просто техническую возмож-
ность полного удаления опухоли, но и возможность достижения стойкого местно-регионарного контроля болезни. Случаи местно-распространенного РМЖ, относящиеся к стадии, формально являются первично операбельными, хотя по своим биологическим характеристикам их операбельность условна. Для этой категории предпочтительной считается тактика начала лечения с использованием предоперационной терапии [6—8]. Индукционная терапия, особенно в группе больных с первично неоперабельными опухолями, дает возможность выполнить адекватное хирургическое вмешательство и, кроме того, увеличить показатели общей и безрецидивной выживаемости [9—11].
Проблема оценки операбельности местнораспространенного (или первично неоперабельного) РМЖ существует только в отношении больных, у которых в результате предоперационного лечения наступает частичный эффект или стабилизация болезни. Больные с прогрессированием процесса остаются иноперабельными, операция возможна только с паллиативной целью (распад опухоли), но не с целью достижения ремиссии. Больные, получившие полный эффект от лечения, безусловно, операбельны. Решение о целесообразности операции у них основано на сомнении в точности оценки полноты эффекта [11, 12]. Правильное определение операбельно -сти позволяет оптимизировать лечение за счет отказа от операций, сопровождающихся быстрым местнорегионарным рецидивом болезни, в пользу модификации и интенсификации консервативного лечения [13].
В настоящее время нет четких данных об этапности, продолжительности и преимуществе различных методов лечения у данной категории
Е Н
больных. При сравнении схем комплексного лечения, особенно при IIIb стадии, некоторые авторы [9, 11, 12] приходят к мнению, что отдаленные результаты статистически не отличаются и в большей степени зависят от распространенности процесса, чем от лечебной тактики.
Необходимость проведения предоперационного лечения при местно-распространенном РМЖ с использованием химиотерапии (ХТ) продемонстрировали A. Forguet и соавт. [14]. Они сравнили эффективность последовательности проведения лекарственного и лучевого лечения у 390 больных РМЖ T3N0M0. Половина больных получали 4 курса ХТ по схеме СAF, а затем лучевую терапию (ЛТ) мелким фракционированием дозы РОД 2 Гр до СОД 40 Гр; другой половине пациенток проведено сначала лучевое лечение, а затем ХТ по аналогичной схеме. Четырехлетняя выживаемость в 1-й группе больных составила 89%, во второй — 80% (^=0,046). На вопрос, какие схемы лекарственной терапии наиболее эффективны в неоадъювантном режиме, в современной литературе нет однозначного ответа. Большинство исследований [15—17] носят поисковый характер и посвящены оценке либо новых противоопухолевых препаратов, либо препаратов, ранее применявшихся во второй линии.
U. Coskun и соавт. [8] описывают свой опыт проведения предоперационной ХТ у 91 больной местно-распространенным РМЖ при IIIa (n=30) и IIIb (n=61) стадиях. Лекарственное лечение с применением антрациклинов (FAC или AC, FEC или EC), а также CMF было эффективно в 91, 82 и 60% случаев соответственно (^=0,05). M. Machiavelli и соавт. (1996) проводили комбинированное лечение 140 больных РМЖ IIIa и IIIb стадий по схеме: 3 курса ХТ по схеме FAC + модифицированная РМЭ. Клинический эффект отмечен у 71%, стабилизация — у 26%, прогрессирование — у 3% больных. Авторы отмечают некоторое несовпадение клинического и морфологического эффектов. При полном эффекте, определяемом морфологически, безрецидив-ная и общая заболеваемость у пациенток были более выражены, чем при частичном эффекте или стабилизации. Данные крупных исследований II и III фазы применения ХТ продемонстрировали, что доопераци-онное лечение в течение 3—4 мес может быть назначено без риска снижения эффективности местно-регионарного контроля и долгосрочной выживаемости [11, 12, 15, 16].
Рис. 1. Распределение больных местнораспространенным РМЖ в зависимости от стадии
В нашем исследовании распределение больных по стадиям было следующим (рис. 1): T3N0M0 (ПЬ) - 65, T4N0M0 (ІІІЬ) - 80 пациенток соответственно.
Исходя из особенностей овариально-менструального статуса больные распределены следующим образом: наибольшее число пациенток — 105 (72,4%) находились в периоде менопаузы, у 40 (27,6%) больных менструальная функция была сохранена. Менопауза менее 5 лет отмечена у 34 (23,4%) больных (по 17 пациенток в каждой группе), а более 5 лет — у 71 (48,9%) пациентки, причем большая часть последних (52 женщины) относилась к группе с ІІІЬ стадией заболевания.
Всем больным в нашем исследовании было выполнено хирургическое вмешательство различного объема. Так, радикальная мастэктомия с сохранением обеих грудных мышц выполнена 123 (85%) пациенткам, органосохранная операция в объеме радикальной резекции — 22 (15%) больным.
В зависимости от проводимого лечения пациентки изучаемой группы распределились следующим образом (рис. 2).
Как видно из рис. 2, наибольшее число больных получили комбинированное либо комплексное лечение. Непосредственно хирургическое вмешательство выполнено всего 21 (14,5%) больной.
Рис. 2. Распределение больных местно-распространенным РМЖ в зависимости от вида лечения. Здесь и далее: ГТ — гормонотерапия
Лечение опухолей молочной железы
Лечение опухолей молочной железы
Рис. 3. Общая выживаемость больных РМЖ T3N0M0 стадии в зависимости от вида лечения
Неоадъювантное лечение получили 5 (3,5%) пациенток с Т3К0М0 стадией. Адъювантная терапия проводилась у 79 (54,5%) больных. Комбинация нео- и адьювантного лечения проведена в 40 (27,6%) клинических случаях. Неоадъювант-ная терапия использовалась в лечении 45 (31,1%) пациенток, причем чаще она назначалась больным 111Ь стадии — 29 (36,3%) пациенток. Сходная индукционная терапия использована в лечении 16 (24,6%) пациенток с 11Ь стадией опухолевого процесса.
Отмечено, что 21 (46,7%) больная до операции получила различную ХТ. Только ЛТ применена в 11 (24,4%) клинических случаях, относящихся к Т3К0М0 стадии опухолевого процесса. Комбинация ХТ + ЛТ проведена 11 (24,2%) больным, большая часть которых составили группу Т4К0М0 стадии. Самой малочисленной — 3 (6,6%) клинических случая — была группа пациенток, до операции лечившихся с применением эндокринотерапии.
Рис. 4. Безрецидивная выживаемость больных РМЖ T3N0M0 стадии в зависимости от вида лечения
Наиболее часто — у 23 (71,9%) пациенток в качестве предоперационной ХТ использовались атрациклинсодержа-щие комбинации (САР, АС, АТ), гораздо реже применялись другие режимы лечения (СМр СМБУР) — 9 (28,2%) больных и в группе больных с Т4К0М0 стадией опухолевого процесса. Предоперационное лекарственное лечение наиболее часто ограничивалось 2—4 курсами.
Большинству (62%) больных стадии Т3К0М0 неоадъю-вантно проводилась ЛТ в режиме укрупненного фракционирования дозы РОД 5 Гр до СОД 20 Гр на молочную железу и подмышечную область. При более распространенном процессе (111Ь стадия) предоперационная ЛТ проводилась мелкими фракциями РОД 2 Гр до СОД 40—44 Гр на молочную железу и зоны регионарного лимфоот-тока. Аналогичную ЛТ получили 13% больных с 11Ь стадией, с той лишь разницей, что суммарная доза облучения составляла 36 Гр.
Оценка эффективности проводимого лечения базировалась на клинической динамике (клинико-рентгенологических данных) и степени лечебного патоморфоза. Так, уменьшение размеров опухолевого узла, отека и гиперемии кожи молочной железы наблюдалось у большинства больных — 24 (54,2%). Клинический эффект от проведенного неоадъювантного лечения был отмечен у 6 (37,5%) больных в группе 11Ь стадии и у 18 (62,1%) пациенток при 111Ь стадии опухолевого процесса. Морфологически наблюдаемый лечебный патоморфоз различной степени выраженности отмечается практически у половины больных — 24 (53%).
Так, лечебный патоморфоз по гистологическим данным чаще встречался у пациенток с 111Ь стадией опухолевого процесса. Лечебный патоморфоз 1—11 степени отмечен в 34 (77%) клинических случаях, патоморфоз III степени установлен у 7 (16,1%) пациенток и полный (IV степень) — у 3 (6,7%) больных. Причем наличие абсолютного лечебного патоморфоза было характерно для группы больных с Т4К0М0 стадией.
Рассматривая степень лечебного патоморфоза в зависимости от схемы проведенного
Е Н
лечения следует отметить, что в группе больных с Т3К0М0 стадией, где хирургическое лечение комбинировалось с ХТ, слабый лечебный патоморфоз отмечен у 3 (16,7%) пациенток, получивших лекарственное лечение неоадъювантно. Аналогично в группе больных с Т4К0М0 стадией предоперационная ХТ проводилась всем пациенткам. Выраженный и полный лечебный патоморфоз установлен у 3 (30%) женщин.
У всех больных с Т3К0М0 стадией, получивших лечение по схеме: ЛТ + операция + ЛТ ±
ГТ, где ЛТ проведена в неоадъю-вантном режиме, отмечен только слабый лечебный патоморфоз. Пациентки с Т4К0М0 стадией получали ЛТ только в адъювантном режиме.
Любопытные результаты получены при изучении группы больных, которым помимо хирургического лечения проводились ХТ, ЛТ и ГТ. В большинстве случаев (59% — в стадии ПЬ и 74% — в стадии ШЬ) лечение было начато неоадъювант-но. У всех больных был достигнут лечебный пато-морфоз той или иной степени выраженности. У абсолютного большинства пациенток установлен лечебный патоморфоз I и II степени (90% — в группе Т3ШМ0; 71% — в группе Т4К0М0). Выраженный и полный эффект отмечен только у 5 (29%) больных и только при Т4К0М0 стадии заболевания. ГТ в неоадъювантном режиме применялась крайне редко — 2 (11%) пациентки в стадии Т4К0М0 — и характеризовалась отсутствием лечебного патоморфоза.
Таким образом, наиболее эффективными схемами лечения данных групп больных были сочетания методов, где в неоадъю-вантном режиме использовалась только ХТ (28,9%) либо ХТ + ЛТ ± ГТ (60,3%). Причем у 38% пациенток из 1-й группы и у 58% — из 2-й был отмечен выраженный лечебный пато-морфоз. При неоадъювантном применении только ЛТ макси -мальная выраженность дегенеративных изменений опухолевой ткани соответствовала I—II степени патоморфоза.
Анализ результативности различных вариантов лечения в зависимости от продолжительности жизни больных в Т3К0М0 стадии представлен на рис. 3 и 4.
Рис. 5. Общая выживаемость больных РМЖ T4N0M0 стадии в зависимости от вида лечения
Общая 5-летняя выживаемость больных с Т3К0М0 стадией в зависимости от вида лечения составила: только операция — 74%, операция + ХТ ± ГТ — 82%, операция + ЛТ ± ГТ— 56%, операция + ГТ — 62%, операция + ХТ + ЛТ ± ГТ — 78% соответственно.
Безрецидивная 5-летняя выживаемость больных с Т3К0М0 стадией в зависимости от вида лечения составила: только операция — 60%, операция + ХТ ± ГТ — 71%, операция + ЛТ ± ГТ — 33%, операция + ГТ — 50%, операция + ХТ + ЛТ ± ГТ — 66% соответственно.
Общая 5-летняя выживаемость у больных с Т4К0М0 стадией составила: только операция — 59%, операция + ХТ ± ГТ— 76%, операция + ЛТ ± ГТ — 60%, операция + ГТ — 46%, операция + ХТ + ЛТ ± ГТ — 80% соответственно. Общая выживаемость больных РМЖ Т4К0М0 стадии в зависимости от вида лечения представлена на рис. 5.
Безрецидивная 5-летняя выживаемость у больных с Т4К0М0 стадией составила: только
Рис. 6. Безрецидивная выживаемость больных РМЖ T4N0M0 стадии в зависимости от вида лечения
Лечение опухолей молочной железы
Лечение опухолей молочной железы
операция — 47%, операция + ХТ± ГТ — 64%, операция + ЛТ ± ГТ — 57%, операция + ГТ — 41%, операция + ХТ + ЛТ ± ГТ — 69% соответственно. Безрецидивная выживаемость больных РМЖ Т4К0М0 стадии в зависимости от вида лечения представлена на рис. 6.
Показатели 5-летней выживаемости у пациенток, которым выполнена радикальная мастэктомия с сохранением грудных мышц, составили: общая — 88%, безрецидивная — 71%. Для пациенток, подвергшихся операции в объеме радикальной резекции, показатели выживаемости составили: общая — 77%, безрецидив-ная — 64%.
Стабилизация процесса отмечена у 106 (73,1%) больных: 49 (75,3%) пациенток в группе с ПЬ и 57 (71,3%) — в группе с ШЬ стадией соответственно. Прогрессирование заболевания наблюдалось у 39 (26,9%) больных: 16 (24,6%) пациенток в группе с НЬ и 23 (28,7%) — в группе с ШЬ стадией. Интервал прогрессирования составил в среднем 19 мес (от 0,9 до 89,7 мес). Причем для группы больных с Т3К0М0 стадией заболевания такой интервал был равен в среднем 17,9 мес (от 0,93 до 89,7 мес), а для группы пациенток с Т4К0М0 стадией — 20,1 мес (от 2,26
до 83,2 мес). Средний возраст пациенток, у которых отмечено прогрессирование заболевания, составил 55 и 64 года соответственно. Следует отметить, что РМЖ в рассматриваемых группах в 23% клинических случаев прогрессирует уже в первое полугодие.
В большинстве (82%) случаев прогрессирование заболевания заключалось в отдаленном мета-стазировании, у 10% больных отмечен местный рецидив заболевания, у 8% — сочетание местного и отдаленного метастазов. У большинства пациенток отдаленные метастазы выявлялись в печени (31,4%), легких (25,7%) и костях (17,1%). Наиболее часто (86%) речь шла о метастатическом поражении в пределах одного органа.
Подводя итоги проведенного исследования, можно сделать вывод, что после анализа различных подходов к лечению больных РМЖ НЬ и ШЬ (Т3—4К0М0) стадий наиболее эффективной нам представляется следующая комбинация: ХТ с использованием антрациклинов (2—4 курса) + операция + ХТ + ЛТ (мелким фракционированием дозы РОД 2 Гр до СОД 44—60 Гр) ± ГТ — при использовании которой были получены лучшие результаты 5-летней общей и безрецидивной выживаемости.
ЛИТЕРАТУРА
1. Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ. М.; 2005.
2. Давыдов М.И., Летягин В.П. Стандарты лечения больных первичным раком молочной железы. М.; 2003.
3. Возный Э.К., Добровольская Н.Ю., Гуров С.Н. Некоторые аспекты неоадъювантной терапии местнораспространенного рака молочной железы. Юбилейный сборник «Этюды химиотерапии». М.; 2000. с. 90—8.
4. Летягин В.П. Первичные опухоли молочной железы. Практическое руководство по лечению. М.,
Миклош; 2004.
5. Летягин В.П., Погодина Е.М., Высоцкая И.В. и др. Лечение больных раком молочной железы стадии Т2№М0 — Т3ШМ0. Высокие технологии в онкологии. Материалы V Всероссийского съезда онкологов. Казань, 4—7 октября 2000 г. Т. 3. с. 55—6 (б).
6. Портной С.М., Лактионов К.П., Барканов А.И. Опыт лечения больных прогностически отягощенным местнораспространенным раком молочной железы. IV Ежегодная российская онкологическая конференция. Москва, 21—23 ноября
2000 г. с. З7—9.
7. Портной С.М, Лактионов К.П., Баркаиов А.И. Предварительные результаты органосохраняющих операций при раке молочной железы T2—3N0—2M0 после эффективной неоадьювантной терапии. Herald of the International Association of Plastic Surgeon and Oncologists, 2003;4:3З.
8. Coskun U., Gunel N., Onuk E. et al. Effect of different neoadjuvant chemotherapy regiments on locally advanced breast cancer. Neoplasma 2003;З0(3):210—6.
9. Gajdos C., Tartter P.I., Bleiweiss I.J. et al. Stage 0 to stage III breast cancer in young women. J Am Coll Surg 2000;190(З):З23—9.
10. Kaufmann M., Hortobagyi G.N., Goldhirsch A. et al. Recommendations from an international expert panel on the use of neoadjuvant (primary) systemic treatment of operable breast cancer: an update. J Clin Oncol 2006;24:1940—9.
11. Kaufmann M., von Minckwitz G., Rody A. Preoperative (neoadjuvant) systemic treatment of breast cancer. Breast 200З;14:З76—81.
12. Mauri D., Pavlidis N., Ioannidis J.P Neoadjuvant versus adjuvant systemic treatment for breast cancer: a metaanalysis. J Natl Cancer Inst 200З;97:188—94.
13. Семиглазов В.Ф., Семиглазов В.В.,
Клецель А.Е. Неинвазивные и инвазивные опухоли молочной железы. С.-Пб.; 2006.
14. Forguet A., Campana F., Scholl S. et al. Primary Chemotherapy of primary radiotherapy: a possibility to preserve the breast in large tumors. International Congress of Radiation Oncology 1993. June 21-25 Kyoto; 1993. p. 112.
15. Colleoni M., Litman H.J., Castiglione-Gertsch M. et al. International Breast Cancer Study Group; German Breast Cancer Study Group. Duration of adjuvant chemotherapy for breast cancer: a joint analysis of two randomised trials investigating three versus six courses of CMF. Br J Cancer 2002;86(11):1705—14.
16. Fisher E.R., Wang J., Bryant J. et al. Pathobiology of preoperative chemotherapy: findings from the National Surgical Adjuvant Breast and Bowel (NSABP) protocol B-18. Cancer 2002;95(4):681—95.
17. Taghian A.G., Jeong J.H.,
Mamounas E.P et al. Low locoregional recurrence rate among node-negative breast cancer patients with tumors 5 cm or larger treated by mastectomy, with or without adjuvant systemic therapy and without radiotherapy: results from five national surgical adjuvant breast and bowel project randomized clinical trials. J Clin Oncol 2006;24(24):3927—32.
cyberleninka.ru
Материалы конгрессов и конференций
Э.К. Возный, Н.Ю. Добровольская ФГУ РНЦРР
Хирургическое лечение больных местно-распространенным раком молочной железы обеспечивает 5-летнюю выживаемость только у 27-30% пациентов. Использование предоперационной химиотерапии в комбинации с операцией и лучевой терапией позволяет увеличить этот показатель до 40-80%.
Индукционная химиотерапия позволяет увеличить число органосохраняющих операций, определить индивидуальную чувствительность опухоли к цитостатикам для назначения адъювантного лекарственного лечения, а также продлить безрецидивный период.
С 1985 по 1996 гг. 336 женщин с местно-распространенной формой рака молочной железы получали комплексное лечение в Российском научном центре Рентгенорадиологии. В первой группе (231 больная) на первом этапе проводилась только химиотерапия по схемам CMF,CMFVP,CAF; во 2 группе (105 больных) в предоперационном периоде проводились те же режимы химиотерапии, а затем - лучевая терапия. Продолжительность наблюдения колебалась от 10 лет и более. Метастазы в лимфатические узлы были подтверждены цитологически у 298 (88,7%) больных: N1 имело место у 170 (50,6%) больных, N2 - у 128 (38,1%).
Методика комплексного лечения состояла из трех этапов. На первом этапе всем 336 больных проводилась неоадъювантная лекарственная терапия по схемам CMF, CAF, CMFVP. В последующем 105 из 336 пациентам назначалась предоперационная лучевая терапия. На втором этапе лечения выполнялось радикальное хирургическое лечение. На третьем этапе в послеоперационном периоде проводилась адъювантная лучевая терапия и химиогормонотерапия.
Индукционная химиотерапия при местно-распространенном раке молочной железы оказалась эффективной при всех изученных режимах как в целом, так и по подгруппам. Общий лечебный эффект отмечался у 168 (50%) пациентов, стабилизация процесса наступила у 164 (48,8%) больных и только в 4 (1,2%) случаях наблюдалось прогрессирование заболевания. Если говорить о группах, то общий лечебный эффект имел место у 50,2% пациентов в 1 группе и 49,5% пациентов во 2 группе.
Мы не выявили зависимости эффекта химиотерапии от стадии опухолевого процесса при всех режимах химиотерапии, что свидетельствует о зависимости эффекта не столько от распространенности опухолевого процесса, сколько от биологических особенностей опухоли. В 1 группе эффект наблюдался при Т2 у 29 (49,2%) больных, при Т3 – у 43 (48,3%) больных и при Т4 – в 44 (53,1%) случаев; во 2 группе при Т2 - у 5 (41,7%) больных, при Т3 – у 28 (52,8%) и при Т4 - у 19 (47,5%) пациентов.
Полная регрессия опухоли, подтвержденная морфологическим исследованием, при ее размерах Т2 и Т3 составила 6%, при Т4 - 2,4%. Важно, что у больных с лимфатическими узлами, оцененными индексом N1-2, снижение статуса до N0 имело место в 24,7%.
У большинства больных - 156 (46,4%) - зарегистрирована II степень лечебного патоморфоза. Одинаково часто имел место патоморфоз I и III степени: в 81 (24,1%) и 85 (25,3%) случаях соответственно. И только у 14 (4,2%) пациенток наблюдался патоморфоз IV степени. Патоморфоз III и IV степени в обеих группах чаще встречался при использовании схемы CAF и достигал 63,6%.
Выявлено, что в ранние сроки наблюдения местная распространенность опухоли не влияет на общую и безрецидивную выживаемость больных обеих групп, а в поздние сроки выживаемость зависит не только от значения индекса Т и N, но и, скорее всего, от клинического и морфологического эффекта (рис. 1, 2).
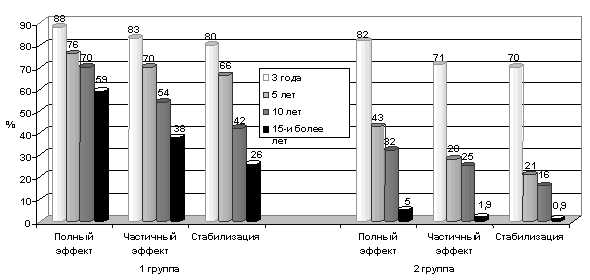
Рис. 1. Общая выживаемость больных РМЖ в зависимости от выраженности клинического эффекта.
Рис. 2. Продолжительность безрецидивного периода у больных РМЖ в зависимости от выраженности клинического эффекта.
Сочетание неоадъювантной терапии с лучевой терапией у больных РМЖ с III+IV степенью патоморфоза по выживаемости и продолжительности безрецидивного периода не имело преимуществ по сравнению проведением только индукционной химиотерапии.
В группе больных с III и IV степенями патоморфоза, достигнутыми после неоадъювантной химиотерапии, при проявлении метастазов также сохранялась чувствительность к противоопухолевой лекарственной терапии.
Следует подчеркнуть, что пациенты, имевшие положительные РЭ и РП в 79,5% случаев переживали 3-летний период, в 63,6% случаев - 5-летний период и в 34,1% случаев - 10-летний период, что может быть объяснено проводимой адъювантной эндокринной терапией. При отрицательных значениях рецепторов общая выживаемость по периодам была ниже и распределялась следующим образом: в 25% и 10,7% случаев. Никто из больных не пережил 10- и 15-летний период.
Более четкая зависимость имела место в отношении наличия РЭ. Так, в тех группах, где они определялись в клетках опухоли, общая выживаемость была достоверно выше, чем у пациентов имеющих РП. При 3-летней выживаемости это соотношение было 63,6% против 27,8%, при 5-летней – 45,5% против 19,4%, при 10-летней – 27,3% против 2,8%.
Патоморфоз III+IV степени был зарегистрирован у 42,9% женщин, у которых рецепторы эстрогенов и прогестерона в ткани опухоли отсутствовали, и только у 4,5% пациенток с положительным рецепторным статусом. Следует отметить, что при отрицательном рецепторном статусе патоморфоз III+IV степени чаще имел место у пациенток с лекарственной аменореей (50% против 42,3%).
Таким образом, с учетом полученных нами данных, можно утверждать, что неоадъювантная химиотерапия увеличивает безрецидивный период и продолжительность жизни больных с местно-распространенным раком молочной железы за счет снижения значения таких прогностических факторов как индексы Т и N и патоморфологический эффект и должна быть неотъемлемым компонентом комплексного лечения таких пациентов.
Наличие рецепторов стероидных гормонов в тканях опухоли является положительным прогностическим признаком, свидетельствующим о возможности более благоприятного течения заболевания в отношении отдаленных результатов (общей и безрецидивной выживаемости). Поэтому, возможно, у больных с положительными РЭ и РП предоперационное лечение следует начинать с эндокринной терапии.
Индуцируемая неоадъювантной химиотерапией аменорея имеет благоприятное прогностическое значение, особенно у пациенток с положительным рецепторным статусом.
rosoncoweb.ru