Патология молочной железы
Патология молочных желез
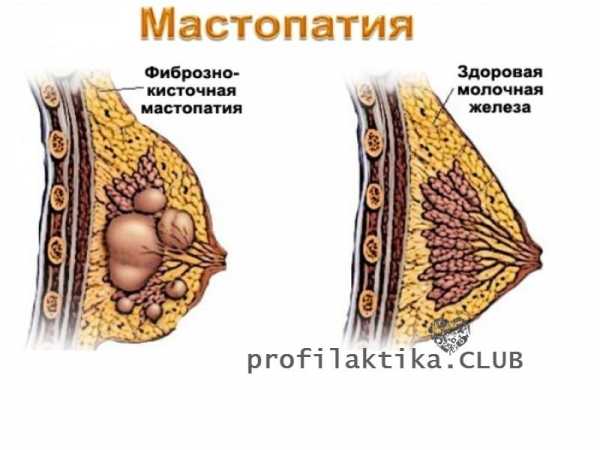
Мастопатия (дисгормональная дисплазия) — объединяющее понятие заболеваний молочной железы вне беременности,
В существующих классификациях дисгормональных дисплазий отражены как прогрессивные (гиперплазия, пролиферация долек, протоков, соединительной ткани), так и регрессивные (атрофия, фиброз, кистообразование) изменения.
А. Фиброзно-кистозная мастопатия.
Классификация фиброзно-кистозной мастопатии (ФКМ):
I) диффузная ФКМ:
1) с преобладанием железистого компонента (аденоз)
2) с преобладанием фиброзного компонента
3) с преобладанием кистозного компонента
4) смешанная форма;
II) узловая ФКМ.
Диффузная и узловая ФКМ могут иметь пролиферирующую или непролиферирующую форму; при пролиферации в эпителии, выстилающем молочные ходы, развиваются интрадуктальные папилломы; в эпителии, выстилающем стенки кист, — цистаденопапилломы, которые впоследствие могут привести к развитию злокачественных изменений в пролиферирующем эпителии
А) ФКМ с преобладанием железистого компонента (аденоз) — характеризуется высокодифференцированной, неосумкованной гиперплазией долек железы; наблюдается у молодых девушек в конце периода полового созревания и у женщин в начальных сроках беременности как преходящее состояние.
Клинически характеризуется: а) болезненностью б) нагрубанием железы и в) диффузным уплотнением всей железы или ее участка; границы уплотнений плавно переходят в окружающие ткани. Болезненность и нагрубание усиливаются в предменструальном периоде.
При рентгенологическом исследовании: множественные тени неправильной формы с нечеткими границами, соответствующие участкам гиперплазированных долек и долей. Иногда, при обширном процессе тени захватывают всю железу.
Б) ФКМ с преобладанием фиброза — характеризуется фиброзными изменениями междольковой соединительной ткани, пролиферацией внутрипротоковой ткани с сужением просвета протока железы вплоть до полной его облитерации; наблюдается чаще у женщин более старшего, пременопаузального возраста.
Клинически характеризуется болезненностью, при пальпации железы определяются уплотненные, тяжистые участки.
Рентгенологически: пласты плотных гомогенных участков с выраженной тяжистостью (рентгенограммы вида «матового стекла»)
В) ФКМ с преобладанием кистозного компонента — характеризуется наличием множественных кистозных образований эластической консистенции, довольно хорошо отграниченных от окружающей ткани железы; наблюдается чаще у женщин после 54 лет.
Клинически характерна болезненность, усиливающаяся перед менструациями.
Рентгенологически: крупнопетлистый рисунок, на котором определяются множественные просветления диаметром от 0,3 до 6 см с четкими контурами.
Морфологически: множественные кисты, фиброзные изменения интерстициальной ткани; возможны пролиферативные процессы в эпителии, выстилающем стенку кисты, с образованием папиллярных образований; цвет и консистенция кистозного содержимого различны; иногда кисты кальцинируются — признак озлокачествления
Г) смешанная форма ФКМ — встречается чаще всего, для нее характерна: гиперплазия долек, склероз внутридольковой и междольковой соединительной ткани и атрофии альвеол с расширением протоков и превращение их в кистозные образования.
Д) узловая форма ФКМ — характеризуется изменениями, описанными выше, но имеющими локальный характер в виде единичных или нескольких узлов.
Клинически: болезненность наиболее выражена, боль иррадиирует в плечо, лопатку; пальпаторно — отдельные уплотнения без четких границ, не спаянные с кожей, увеличивающиеся накануне и уменьшающиеся после окончания менструаций; иногда увеличение подмышечных л. у.
В. Мастодония (масталгия) — особая форма молочной железы в предменструальном периоде, циклическое нагрубание железы, обусловленное венозным застоем и отечностью стромы; молочная железа увеличивается в объеме более чем на 15 %.
Этиопатогенез: в основе — прогестерондефицитные состояния, нарушение функции яичников, при которых имеется абсолютная или относительная гиперэстрогения; эстрогены вызывают пролиферацию эпителия альвеол, протоков, усиливают активность фибробластов и вызывают пролиферацию соединительной ткани железы
Болеют в основном женщины репродуктивного возраста, причем подавляющее большинство из них страдает различными гинекологическими заболеваниями.
Клиника: основная жалоба — боль, усиливающаяся в предменструальном периоде, иногда начиная со второй половины менструального цикла, может иметь локальный характер, иррадиировать в руку или лопатку; пальпаторно — болезненные участки уплотнения в ткани молочных желез; увеличение лимфатических узлов в подмышечной впадине (у 10%).
Клинические фазы мастопатии:
1) первая фаза — возраст 20-30 лет, менструальный цикл регулярный, но часто укорочен до 21-24 дней; за неделю до менструаций появляется нагрубание, болезненность молочной железы, ткань уплотняется и становится чувствительной при пальпации
2) вторая фаза — 30-40 лет, боль в молочных железах носит постоянный характер и длится 2-3 нед до менструаций; в железе пальпируются отдельные болезненные уплотненные дольки с кистозными включениями
3) третья фаза — возраст старше 40-45 лет, боль в молочных железах менее интенсивная и непостоянная; пальпируются множественные кистозные образования, некоторые достигают 1-3 см в диаметре, содержат коричневато-зеленый секрет, появляющийся из соска при надавливании на околососковое поле.
Диагноз ставят на основании анамнеза (гинекологические заболевания в анамнезе), клинической картины, пальпации молочных желез (проводят в положении стоя и лежа с последовательным исследованием всех квадрантов железы в первую неделю после менструации) и подтверждают результатами специальных методов исследования (маммография в двух проекциях, УЗИ, пункционная биопсия с цитологией, термография молочных желез — позволяет выявить очаги повышенной термической активности).
Рентгенологическое исследование позволяет выявить макрокальцинаты (более 0,5 см в диаметре), характерные для кистозных изменений и расширения протоков, и микрокальцинаты (менее 5 мм в диаметре) — частый признак рака МЖ.
Лечение мастопатий:
1. Консервативная терапия проводится только после полного исключения злокачественных заболеваний молочных желез, ей подлежат больные с некоторыми формами диффузной мастопатии (ФКМ с преобладанием железистого, фиброзного компонента и смешанные формы). При мастопатии с преобладанием кистозного компонента после проведения пункционной биопсии и убедительных доказательств отсутствия пролиферативных изменений в эпителиальных структурах можно проводить консервативное лечение, но только под наблюдением онколога.
2. Используются:
А) гестагены (производные норэтистерона и прогестерона) — препараты применяют во второй фазе менструального цикла: норколут по 5 мг в день с 16-го по 25-й день цикла; прегнин по 0,02 г (2 таблетки) 3 раза в день с 16-го по 25-й день цикла
Б) андрогены (производные тестостерона) — применяется для лечения мастопатии преимущественно у женщин старше 45 лет, используются метилтестостерон по 5-10 мг (1-2 таблетки) с 16-й по 26-й день менструального цикла в течение первых 3 мес, затем по 5 мг в те же дни цикла, длительность лечения 8-10 мес; тестобромлецид ( комбинированный препарат, содержащий метилтестостерон, бромизовал и лецитин)
В) эстроген-гестагенные препараты с содержанием эстрогенного компонента не более 0,03 мг: ригевидон, содержащий 0,03 мг этинилэстрадиола, или полтаблетки контрацептивов, содержащих 0,05 мг этинилэстрадиола в течение 6-9-12 мес.
Г) антиэстрогены — тамоксифен по 10 мг (1 таблетка) в день 3-6 мес
Д) антипролактиновые препараты — бромокриптин (парлодел) по 2,5-5 мг во второй фазе менструального цикла с 16-го по 25-й день в течение 4-6 циклов.
Е) препараты йода (микродозы): 0,25 % раствор йодида калия по 10 мл 4 раза в день
Ж) витамины Е, A, B1, B2; пищевой режим, исключающий метилксантины — чай, кофе, шоколад.
З) НПВС — индометацин, бруфен, ацетилсалициловая кислота во второй фазе цикла с 16-го по 25-й день
3. Выбор препарата зависит от возраста женщины: молодым женщинам до 35 лет рекомендуются эстроген-гестагенные препараты, в пременопаузальном возрасте предпочтительны гестагены, в возрасте после 50 лет — андрогены. При сочетании ФКМ с предменструальным отеком молочной железы эффективен парлодел, при смешанной форме фиброзно-кистозной мастопатии с выраженными изменениями в железе следует предпочесть терапию тамоксифеном.
Лечение мастодоний: эфективное, проводится одновременно с лечением ПМС, часто сопутствующего мастодонии; используют антипростагландиновые препараты (НПВС), диуретические средства, ограничивают жидкость. При сильной боли и нагрубании молочных желез — норколут, прегнин или парлодел.
uchenie.net
Мастопатия: симптомы и лечение патологии молочной железы
Из всех заболеваний молочной железы фиброзно-кистозная болезнь, или фиброзно-кистозная мастопатия, является наиболее распространенной. Она встречается почти у 30% всех женщин, причем у женщин до 30 лет — в каждом четвертом случае обращения в женскую консультацию. Среди женщин, страдающих хроническими гинекологическими заболеваниями, мастопатия обнаружена у 30-70%.
Что такое мастопатия
Под термином «мастопатия» объединено около 30 терминов-синонимов — дисплазия молочной железы, дисгормональная гиперплазия молочных желез, фиброаденоматоз, болезнь Шиммельбуша, хронический кистозный мастит, мазоплазия, кистозная мастопатия, мастодиния и т. д.
Все эти и многие другие термины применяются в целях обозначения тех многочисленных изменений морфологического характера (пролиферативных, кистозных, фиброзных), которые нередко, но не обязательно, присутствуют одновременно и объединены одним общим названием.
В практической медицине термин «мастопатия» употребляется в отношении многих доброкачественных заболеваний молочных желез, различающихся многообразием клинических проявлений и, главное, гистоморфологической структурой, и объединенных основной причиной своего возникновения — нарушениями гормонального баланса в организме.
Таким образом, мастопатия — это группа доброкачественных заболеваний, морфологически характеризующихся широким спектром как регрессивных, так и пролиферативных процессов, при которых возникает патологическое соотношение соединительно-тканного и эпителиального компонентов молочных желез с возникновением изменений кистозного, фиброзного и пролиферативного характера.
Чем опасна мастопатия? Несмотря на то, что это заболевание доброкачественное и не считается непосредственно предраком, в то же время рак молочных желез развивается в среднем в 4 раза чаще на фоне диффузных заболеваний последних и в 40 раз чаще — на фоне кистозных форм с признаками разрастания (пролиферации) эпителиальных клеток. Риск озлокачествления при непролиферативных формах мастопатии составляет не более 1%, при умеренно выраженной пролиферации эпителия — около 2,5%, а в случае значительной пролиферации риски рака молочных желез возрастают до 31,5%.
С этой точки зрения профилактика и лечение мастопатии являются одновременно и реальной профилактикой злокачественных новообразований. К большому сожалению, 90% образований патологического характера женщины выявляют у себя самостоятельно и лишь в остальных случаях они обнаруживаются медицинскими работниками случайно в результате профилактического осмотра.
Сочетание дисгормональных гиперплазий со злокачественными новообразованиями, выявленное в большинстве исследований, объясняется общностью причин и факторов риска, идентичностью определенных вариантов мастопатии и злокачественных опухолей, сходными гормональными и метаболическими нарушениями в организме.
Виды мастопатии
В связи с большим разнообразием морфологических форм заболевания, существуют различные классификации. В практической деятельности, в зависимости от преобладания тех или иных изменений, выявленных при пальпации (прощупывании) или/и маммографии, а также с учетом результатов гистологического исследования выделяют три основных формы болезни, которые часть авторов считает различными стадиями развития одного и того же патологического процесса:
- Диффузная крупно- или мелкоочаговая, представляющая собой раннюю стадию развития болезни. Гистологическая картина определяется участками органа с нормальным строением, гиперплазированными (увеличенными) и атрофичными дольками, расширенными протоками и мелкими кистами, огрубением и разрастанием соединительнотканных структур и коллагеновых волокон.
- Узловая, характеризующаяся преобладанием кистозных элементов и фиброзных тканей, разрастанием долек железы и эпителиальных клеток, которые выстилают внутреннюю поверхность кист и молочных протоков. Обнаружение отдельных атипичных клеток является поводом для характеристики этой формы как предракового состояния.
- Смешанная, или диффузно-узловая — более или менее выраженные по размерам узловые образования определяются на фоне диффузных изменений молочных желез.
В свою очередь, диффузная и узловая формы классифицируются на виды. Диффузную форму подразделяют на:
- аденоз, в котором преобладает железистый компонент;
- фиброаденоз — фиброзный компонент;
- фиброкистоз — кистозный компонент;
- склерозирующий аденоз — компактное разрастание долек железы с сохранением внутреннего и наружного эпителиальных слоев и конфигурации долек, несмотря на сдавление последних фиброзными тканями;
- смешанную форму.
В узловой форме различают следующие виды:
- аденоматозный, представляющий собой избыточно разросшиеся ходы желез с формированием мелких аденом, состоящих из близко расположенных друг к другу увеличенных элементов железистого строения;
- фиброаденоматозный, в том числе листовидный — быстрорастущее соединительнотканное образование слоистого строения, содержащее клеточные элементы, кисты и железистые ходы, которые выстланы разрастающимися эпителиальными клетками;
- кистозный;
- внутрипротоковая папиллома, болезнь Минца, или кровоточащая молочная железа; представляет собой легко травмируемый разросшийся эпителий в расширенном выводном протоке за ареолой или близко от соска;
- липогранулема, или липома;
- гемангиома (сосудистая опухоль);
- гамартома, состоящая из железистой, жировой и фиброзной тканей.
Несмотря на то, что злокачественные опухоли молочных желез — это не обязательно последствия фиброзно-кистозных изменений. Однако наличие их во много раз повышает риск развития рака, который в значительной степени зависит от выраженности эпителиальной пролиферации внутри протоков и железистых долек. В соответствии с гистологическими исследованиями материала, полученного при операциях, в 46% злокачественные опухоли сочетаются с диффузной фиброзно-кистозной мастопатией. Этот факт дополнительно свидетельствует в пользу предположения о том, что профилактика мастопатии является также и профилактикой рака молочной железы.
Причины развития заболевания и факторы риска
Этиология и механизмы развития мастопатии полностью не выяснены, но установлена непосредственная связь преимущественно между развитием этой патологии и состоянием баланса гормонов в организме. Поэтому гормональная теория формирования диффузной фиброзно-кистозной болезни явилась основанием для названия заболевания дисгормональной гиперплазией молочных желез.
Последние являются органом, высокочувствительным к любым изменениям уровня гормонов, особенно половых, и в любые периоды жизни женщины. Молочные железы никогда не находятся в состояниях, характеризующихся функциональным покоем. Их развитие и состояние, физиологические изменения во время менструальных циклов после полового созревания, активация функции во время беременности и лактации осуществляются и регулируются посредством целого гормонального комплекса.
К таким гормонам относятся ГнРГ (гонадотропинрилизинг-гормон) гипоталамической области головного мозга, пролактин, лютеинизирующий и фолликулостимулирующий гормоны гипофиза, тиреотропный и хорионический гормоны, глюкокортикостероиды и инсулин, и, главное, половые гормоны (андрогены, эстрогены, прогестерон).
Поэтому любой гормональный дисбаланс, особенно между прогестероном и эстрогенами, в числе которых максимальное влияние на молочную железу имеет эстрадиол, сопровождается изменениями структуры ее тканей и, как следствие, развитием мастопатии. От эстрадиола зависит дифференцировка (специализация) клеток, их деление, развитие и пролиферация эпителиальных клеток протоков органа. Этот гормон также индуцирует развитие структурно-функциональной единицы железы (дольки), развитие сосудистой сети и наполненность жидкостью соединительной ткани.
Прогестерон же предотвращает деление и разрастание эпителия молочных протоков, снижает проницаемость мелких сосудов, обусловленную действием эстрогенов. Уменьшая отек соединительной ткани, прогестерон обеспечивает дольчато-альвеолярное разделение, способствует развитию железистых тканей, долек и альвеол.
Наибольшее значение имеет относительный (по отношению к эстрогенам) или абсолютный дефицит прогестерона. Его недостаток является причиной не только отека, но и увеличения массы и объема соединительных тканей внутри долек, а также роста эпителия протоков, приводящего к уменьшению их диаметра, закупорке и формированию кист. Гормон способен снижать степень активности эстрогенных рецепторов, уменьшать локальную концентрацию активных эстрогенов, чем способствует ограничению стимуляции разрастания тканей желез.
Некоторую роль в развитии мастопатии играет также повышенная концентрация содержания в крови гормона пролактина, которая приводит к увеличению в тканях желез числа рецепторов, воспринимающих эстрадиол. Это способствует повышению чувствительности к последнему клеток железы и ускорению роста в ней эпителия. Кроме того, повышение уровня содержания пролактина служит одной из причин нарушения соотношения эстрогенов и прогестерона, что сопровождается соответствующими симптомами во второй фазе менструального цикла — отеком, нагрубанием и болезненностью молочных желез.
Существует достаточно много причинных факторов риска, но главные из них — это:
- Позднее (после 16 лет) или преждевременное, не соответствующее возрасту, начало менструальных циклов (до 12 лет), в результате чего организм девушки не успевает адаптироваться к изменениям гормонального состояния, на что соответственно реагирует ткань молочных желез.
- Позднее (после 30 лет) начало половой жизни.
- Ранняя (до 45 лет) или поздняя (после 55 лет) менопауза, что связано с ранним дисбалансом половых гормонов или более длительным влиянием эстрогенов.
- Бесплодие, отсутствие беременностей, завершившихся родами или поздняя (после 30 лет) первая беременность.
- Частые аборты в подростковом возрасте или после 35 лет. Три искусственных прерывания после 6 недель беременности, когда значительно разрастается железистая ткань, являются пусковым фактором трансформации физиологической пролиферации в патологическую. Аборты на этих сроках в 7 раз увеличивают риск развития мастопатии из-за прерывания гормональной перестройки, происходящей во время беременности.
- Отсутствие, чрезмерно короткое (менее 5 месяцев) или слишком длительное грудное кормление.
- Наследственная предрасположенность и возраст после 45 лет.
- Хронические воспалительные заболевания женской половой сферы(около 40-70%), которые являются не столько провоцирующим, сколько фактором, способствующим или сопутствующим эндокринным расстройствам;
- Генитальный эндометриоз (80%), миомы матки (85%), гормоны которой влияют на молочные железы непосредственно или посредством влияния на рецепторы, воспринимающие другие гормоны.
- Опухоли яичников и нарушения менструальных циклов (54%).
- Гормональные расстройства гипоталамо-гипофизарной системы, заболевания щитовидной железы (обнаруживаются у 40-80% женщин с мастопатией), дисфункции коркового слоя надпочечников, гормональный дисбаланс при поликистозных яичниках и метаболическом синдроме.
- Нарушение утилизации стероидных гормонов, в частности эстрогенов, и их выведения в результате патологических изменений или нарушений функции печени, желчевыводящих путей и кишечника.
- Длительные психологические нагрузки и хронические стрессовые состояния, длительное депрессивное состояние и расстройства сна, приводящие к расстройству обратных связей между корой головного мозга, гипоталамусом и остальной эндокринной и вегетативной системами. Такие нарушения присутствуют почти у 80% женщин с мастопатией.
- Нерациональное питание — избыточное употребление пищи, богатой жирами, углеводами, животными белками, и недостаточное употребление фруктов и овощей, а также продуктов с пищевыми волокнами.
- Никотиновая интоксикация и злоупотребление алкогольными и содержащими кофеин напитками и продуктами — крепкий кофе и чай, кола, энергетические напитки, шоколад.
- Негативное влияние внешней среды (химические канцерогены и ионизирующее излучение) нередко является толчком к возникновению мастопатии.
Мастопатия и беременность в определенной степени связаны между собой. Если поздняя или прерванная беременность, а также бесплодие являются факторами риска развития мастопатии, о чем упоминалось выше, то, соответственно, ее наличие, а тем более повторные беременности и роды можно считать профилактикой заболевания. Кроме того, отдельные авторы считают, что при беременности может происходить задержка развития мастопатии и снижение степени ее проявлений. Это объясняется большим содержанием прогестерона в организме женщины в период беременности и кормления грудью.
Симптомы мастопатии
Диагностика любой патологии базируется на выяснении истории заболевания при беседе с пациентом, его субъективных ощущениях и внешнем визуальном и пальпаторном осмотрах. Все это дает возможность клиницисту избрать дальнейшие методы инструментальной и лабораторной диагностики с целью установления диагноза, провоцирующих факторов и сопутствующих заболеваний, влияющих на развитие конкретной патологии.
Основные и наиболее характерные первоначальные признаки мастопатии:
- Масталгия, или боли в молочных железах (у 85%) различной интенсивности, вынуждающие женщин обращаться к врачам. Они возникают в результате повышенного содержания эстрогенов и сдавления окончаний нервов отечной соединительной тканью или кистозными образованиями. Еще одна причина — вовлечение нервных окончаний в ткани, подвергшиеся склерозированию.
Боли локальные ноющие или тупые, но иногда усиливаются при движениях и иррадиируют (отдают) в лопаточную и подмышечную области, плечевой пояс, руку. Они возникают во второй половине менструального цикла — как правило, за неделю, а иногда и больше до наступления менструации. После начала менструации или через несколько дней боли проходят или их интенсивность значительно снижается. Выраженная болезненность приводит к канцерофобии (чувство страха по поводу злокачественной опухоли), к тревожному или депрессивному состоянию, эмоциональной неуравновешенности.
- Чаще беспокоят ощущения дискомфорта, распирания, тяжести, нагрубания (мастодиния) молочных желез и повышение их чувствительности. Иногда эти явления сопровождаются тревогой, раздражительностью, головной болью, тошнотой и рвотой, дискомфортом и схваткообразными болями в животе (предменструальный синдром). Они так же, как и в случаях масталгии, связаны с менструальным циклом и возникают в результате увеличенного кровенаполнения и отечности соединительнотканной структуры желез, образующих строму.
- Выделения при надавливании на соски — прозрачные, белесоватой, коричневатой, зеленоватой окраски или даже с примесью крови. Если их много, они могут появляться самостоятельно (без надавливания). Особо должны настораживать кровянистые выделения, встречающиеся и при злокачественном новообразовании.
- Наличие одного или нескольких узловых образований различных размеров, выявляемых пальпаторно, а иногда и визуально. Чаще они определяются в верхних наружных квадрантах желез, которые в функциональном отношении являются наиболее активными. Наружный осмотр и пальпаторное исследование в горизонтальном и вертикальном (с опущенными и поднятыми кверху руками) являются основными объективными и легко доступными методами исследования, требующими, в то же время, наличия достаточных практических навыков. Они позволяют определить выраженность кожной венозной сети, консистенцию и границы уплотнений, фиброзные тяжи и тяжистость долек, их болезненность.
Следует отметить, что увеличение регионарных лимфатических узлов, их болезненность и температура при мастопатии не являются признаками последней. Повышение локальной и/или общей температуры тела, увеличение над- и подключичных, подмышечных лимфоузлов обычно возникают при наличии воспалительных процессов в молочной железе (мастит). Кроме того, врач, исследуя молочные железы, всегда тщательно проверяет регионарные лимфоузлы, которые являются первым местом метастазирования злокачественной опухоли.
Диагностика заболевания
Легкая доступность молочных желез для визуального осмотра и мануального исследования, большое сходство в разные периоды их функционирования физиологических изменений со многими формами патологии нередко приводят к ошибочной интерпретации полученных результатов осмотра и являются причиной как гипер-, так и гиподиагностики.
Поэтому данные клинического осмотра должны быть дополнены такими основными методами исследования, как рентгенологическая маммография и ультразвуковая диагностика, позволяющими подтвердить, уточнить или отвергнуть предварительный диагноз.
Рентгенологический метод является наиболее информативным, позволяющим своевременно обнаружить патологию желез в 85 — 95% случаев. Всемирной организацией здравоохранения рекомендовано проведение маммографии каждые 2 года любой здоровой женщине после 40 лет, а после 50 лет — ежегодно. Исследование проводится с 5-го по 10-й день менструального цикла в двух проекциях (прямой и боковой). В случае необходимости, осуществляется прицельная (определенного ограниченного участка) рентгенография.
Для женщин 35-40-летнего возраста, беременных, кормящих матерей рекомендуется каждые полгода осуществлять эхографическое исследование. Его достоинства — это безопасность и высокая разрешающая способность. На УЗИ можно точно отличить полостные образования от солидных, обследовать железы с высокой плотностью (у молодых женщин, при отеке тканей в результате травмы или острого воспаления), проводить прицельную пункционную биопсию. Кроме того, УЗИ позволяет визуализировать рентгенонегативные опухолевидные образования, размещенные близко к грудной стенке, и регионарные лимфатические узлы, осуществлять динамический контроль результатов лечения.
Женщинам с патологией молочных желез нередко необходимо исследование гормонального фона. Эти лабораторные анализы в некоторых случаях позволяют установить причину болезни, факторы риска, откорректировать лечение в плане применения определенных гормональных средств.
Как лечить мастопатию
Общепринятых стандартных принципов терапии не существует, несмотря на распространенность заболевания и важность его раннего выявления и лечения в целях профилактики рака.
Лечение женщин с узловыми формами начинается с проведения пункционной (с помощью тонкой иглы) аспирационной биопсии. При выявлении в узле признаков дисплазии (неправильное развитие соединительнотканных структур) рекомендуется хирургическое лечение — секторальная резекция или полное удаление органа (мастэктомия) с обязательным экстренным гистологическим исследованием удаленных тканей.
Диета
Профилактическое и лечебное значение имеет диета при мастопатии, поскольку питание во многом влияет на метаболические процессы половых гормонов, особенно эстрогенов. Рекомендуется ограниченное употребление углеводов и жиров, мясных продуктов, что способствует снижению содержания эстрогенов в крови и нормализации соотношения андрогенов и эстрогенов. Кроме того, доказаны и противораковые свойства грубоволокнистых видов клетчатки, содержащейся в овощах и фруктах, особенно в некоторых зерновых продуктах.
Немаловажно употребление пищи, которая содержит в большом количестве витамины и микроэлементы, особенно йод, цинк, селен, магний, титан, кремний. Для их восполнения желателен дополнительный прием специальных пищевых добавок и витаминно-минеральных комплексов в драже. Одним из таких препаратов является Триовит в горошках, заключенных в капсулы.
Прием гормональных препаратов
Поскольку главная причина мастопатии — это гормональные расстройства, основной целью терапии является их коррекция. Для этого чаще всего используются гестагенные гормональные препараты, механизм эффекта которых базируется на подавлении активности гипофизарно-яичниковой системы, уменьшении степени стимулирующего влияния эстрогенов на ткани молочной железы.
В этих целях применяют Утрожестан, Дюфастон и особенно Гель прожестожель. Последний содержит микронизированный растительный прогестерон, идентичный эндогенному и действующий на уровне клеток. В то же время, он не увеличивает содержание гормона в сыворотке крови. Его наносят на кожу в течение 3-х месяцев с 16 по 25 день менструального цикла или ежедневно.
Гомеопатия
В последние годы определенное место в профилактике и лечении диффузных форм мастопатии заняла гомеопатия, основанная на применении малых доз активных компонентов, содержащихся в растениях, минералах, веществах животного происхождения и т. д. Они не вызывают негативных побочных эффектов. Их действие направлено на стимулирование и поддержание защитных способностей самого организма. К гомеопатическим средствам относятся такие таблетки от мастопатии, как:
- Мастопол, назначаемый на протяжении 2-х месяцев по 1 таблетке трижды в день за полчаса до еды или через 1 час после приема пищи; он содержит алколоиды болиголова пятнистого, туи, желтокореня канадского и оказывает седативный эффект, значительно уменьшает степень выраженности масталгии;
- Мастодинон, выпускаемый в таблетках и каплях — назначается для приема в течение трех месяцев дважды в день по 1 таблетке или 30 капель; он представляет собой комплекс средств, основным ингредиентом которых является экстракт из прутняка обыкновенного (Авраамово дерево, Витекс священный).
Активные вещества способствуют снижению синтеза пролактина путем воздействия на гипофиз, за счет чего улучшается функция желтого тела яичников и нормализуется соотношение эстрогенов с прогестероном; это лекарство приводит к ликвидации признаков предменструального синдрома, уменьшению или устранению выделений из сосков, к нормализации менструального цикла, способствует снижению интенсивности процессов пролиферации в молочных железах и регрессу патологических процессов при мастопатии;
- Циклодинон, содержащий только экстракт того же растения, к тому же в более высокой концентрации;
- Климадинон, главным компонентом которого является вытяжка из корневища клопогона вонючего, или цимицифуги; лечение мастопатии при климаксе часто оказывается высокоэффективным, поскольку цимицифуга хорошо устраняет сосудисто-вегетативные расстройства, незначительно уступая лишь гормональным средствам; механизм ее действия основан на модуляции функции эстрогеновых рецепторов в центральной нервной системе, подавлении избыточной секреции лютеинизирующего гормона, участвующих в механизме климактерических расстройств и ухудшении течения мастопатии среди женщин 45 – 50-летнего возраста.
- Гелариум в драже, содержащий экстракт зверобоя; он способствует устранению незначительно выраженной депрессии, которая сопутствует предменструальному синдрому, нормализует сон и аппетит, повышает психоэмоциональную устойчивость;
- Фемигландин, который получен из масла примулы вечерней — содержит витамин “E” и полиненасыщенные жирные кислоты;
- Фемивелл — состоит из изофлавоноидов сои, экстракта красного дерева и витамина “E”
После согласования с врачом лечение мастопатии в домашних условиях можно осуществлять с помощью настоев, приготовленных самостоятельно из перечисленных выше или других отдельных лекарственных растений или сбора трав, которые предлагаются аптечной сетью.
Нередко пациентками задается вопрос, можно ли делать массаж при мастопатии? Физиопроцедуры, мази, массаж, компрессы не только в области молочных желез, но и мягких тканей в зоне грудного отдела позвоночника приводят к расширению мелких и средних сосудов, увеличению объема крови, поступающей к тканям органа. Это способствует повышению питания тканей, ускорению обменных процессов, что стимулирует рост уже имеющихся опухолевидных образований. Поэтому мастопатия является противопоказанием для использования подобных средств лечения названных зон и областей.
При нагрубании и отечности молочных желез, сопровождающихся болями, из наружных средств можно использовать Димексид, но только не компрессы или мазь, а в виде 25 или 50% геля, выпускаемого в тубах. Препарат обладает противовоспалительным и умеренным обезболивающим эффектами при нанесении на кожу молочных желез.
Проведенные исследования женщин, находящихся в репродуктивном возрасте и страдающих различной гинекологической патологией, выявили диффузную форму мастопатии в среднем у 30%, смешанную (диффузно-узловую) — у такого же числа пациентов, узловые формы мастопатии сочетались обычно с миоматозом матки, гиперплазией эндометрия и генитальным эндометриозом. Таким образом, выбор способов лечения зависит от формы патологии, наличия гормонального дисбаланса и сопутствующих заболеваний.
ginekolog-i-ya.ru
Рак груди — предопухолевая патология молочной железы
23 Ноября в 8:35 969
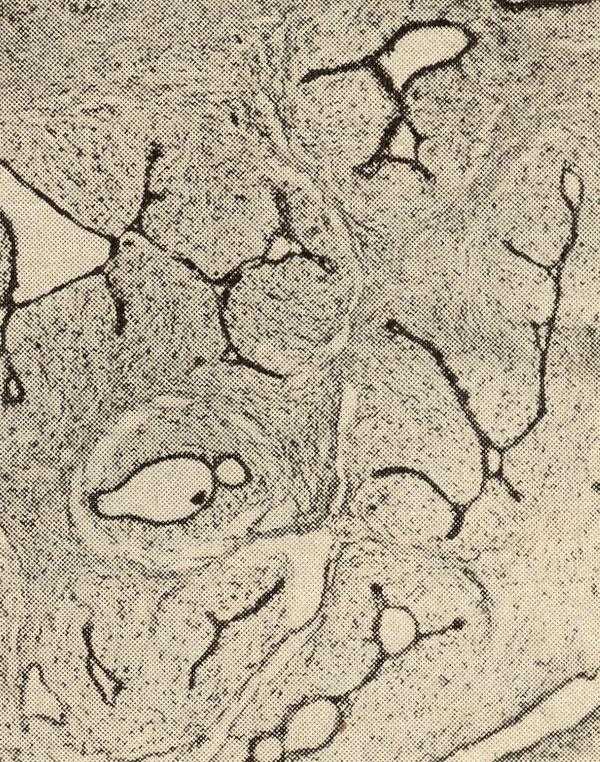
Наиболее сложным в патологической анатомии является вопрос дифференциальной диагностики гиперпластических процессов, которые возникают па фоне гормональной стимуляции, прежде всего гиперэстрогении, и начальных форм рака молочной железы (РМЖ).Дольковая неоплазия наиболее часто развивается у женщин впредменопаузальный период (в возрасте 45-47 лет) и составляет 1-3,8% всех эпителиальных патологических процессов молочной железы.
В 0,5-4% материала биопсий, взятых по поводу доброкачественных заболеваний молочной железы, выявляют дольковую неоплазию разной степени дифференцировки. В 85% случаев дольковая неоплазия возникает мультицентрично и в 30-67% — билатерально. Для лобулярной неоплазии характерна пролиферация мелкого эпителия, расположенного в просвете долек, со слабым межклеточным соединением, с педжетоидной реакцией или без нес. Происходит дольковая неоплазия из эпителия концевой (терминальной) протоково-дольковой единицы молочной железы. Выраженность атипии, степень пролиферации, количество атипических митозов зависят от степени дифференцировки неоплазии. Выделяют два типа клеток дольковой неоплазии: тип А и тип В. Тип А состоит из мономорфных эпителиальных клеток, тип В — из крупных полиморфных клеток с выраженными признаками атипии. Хотя клетки крупные, они гораздо мельче эпителия протоков. Может быть смешанный тип, представленный сочетанием в разной пропорции клеток типа А и В. Термины «атипическая дольковая неоплазия» и «рак in situ» используют, чтобы подчеркнуть их важное прогностическое значение и для указания степени атипии клеток в очаге поражения. Однако известны публикации, свидетельствующие об отсутствии разницы клинического течения атипической дольковой неоплазии и рака in situ, а также разницы в прогнозе дальнейшего развития на их фоне инвазивного рака. Согласно Классификации РМЖ ВОЗ (2003) рекомендуется пользоваться термином «дольковая неоплазия», подразделяя ее на три степени и термин «дольковый ракшей». Деление на степени дифференцировки дольковой неоплазии происходит в зависимости от выраженности клеточного полиморфизма, наличия некрозов, признаков атипии и количества митозов. Легкая степень дольковой неоплазии (первая степень неоплазии) характеризуется сохранением альвеолярной архитектоники, пролиферацией в одной или нескольких дольках мелких мономорфных эпителиальных клеток, слабо сцепленных между собой (клетки типа А). Как правило, клетки в очаге пролиферации имеют округлое, нечетко отграниченное ядро и скудную цитоплазму. Некрозы, митозы и кальцинаты редки. Иногда отмечают очаги пролиферации и полиморфизма клеток, появляются скопления крупных клеток, но эти признаки представлены незначительно. В единичных дольках могут быть признаки апокриновой неоплазии (фото 3). Фото 3. Легкая степень дольковой неоплазии. Общее строение дольки сохранено, однако количество долек значительно увеличено, отмечается выработка секрета, эпителий мелкий мономорфный. Гематоксилин-эозин, х 100 Умеренная дольковая неоплазия (вторая степень неоплазии) характеризуется нарастанием полиморфизма эпителия долек, появлением большего количества крупных клеток с неправильной формой ядра и обильной цитоплазмой, отмечают единичные митозы и отдельные перстневидные клетки. Миоэпителиальные клетки чаще располагаются вдоль базальной мембраны, но могут вытесняться из обычного места расположения и примешиваться к эпителиальному пролиферату. Базальная мембрана сохранна на всем протяжении (фото 4, 5). Фото 4. Умеренная степень дольковой неоплазии. Отмечается пролиферация и формирование многорядного эпителия, очаги секреции. Гематоксилин-эозин, х 200 Фото 5. Умеренная степень дольковой неоплазии. Эпителий полиморфный, формирует сосочки, миоэпителиальные клетки местами вытесняют эпителиальные. Гематоксилин-эозин, х 400 Тяжелая дольковая неоплазия (третья степень неоплазии) представлена в основном полиморфными клетками, заполняющими почти полностью просвет долек, чаще, чем в предыдущей стадии, выявляют митозы, в том числе атипические митозы, очаги некроза (фото 6). Фото 6. Тяжелая степень дольковой неоплазии. Дольки расширены, просвет полностью заполнен эпителиальными клетками. Гематоксилин-эозин, х 100 Данную дольковую неоплазию трудно дифференцировать от рака in situ. Основное отличие тяжелой дольковой неоплазии и рака in situ в том, что последний представлен малигнизированным эпителием, по клеточному составу не отличается от долькового рака и характеризуется сохранной базальной мембраной. Для описания атипической дольковой неоплазии часто используют термин «дольковый рак in situ». Все эти процессы имеют один морфологический код в Международном классификаторе онкологических заболеваний — 8520/2. Рак in situ часто ассоциирован с микроинвазивным раком в окружающих участках, поэтому его исследование требует особой ответственности и внимания при установлении диагноза. Необходимо изучить большое количество срезов и края резекции. В сложных случаях для исключения инвазивного рака необходимо исследовать базальную мембрану для выявления ее целостности и доказать отсутствие нарушения миоэпителиального слоя и базальной мембраны. Важным условием диагностики дольковой неоплазии является отсутствие инвазии опухолевыми клетками базальной мембраны. Для исключения инвазии применяют антитела, выявляющие коллаген IV типа и гладко-мышечный актин. Рецепторы эстрогена по данным большинства авторов и нашим наблюдениям выявляют в 60-90% случаев долькового рака in situ, а рецепторы прогестерона редко. В низкодифференцированном дольковом раке in situ может быть определена экспрессия HER2/neu и белка р53, однако это нетипично для данной патологии. Фото 7. Дольковый рак in situ. Атипичные клетки заполняют просвет долек. Гематоксилин-эозин, х 100 Фото 8. Дольковый рак in situ. Видны микроочаги некроза в опухолевом инфильтрате. Гематоксилин-эозин, х 100 Типичным для дольковой неоплазии тяжелой степени и рака in situ является отсутствие экспрессии цитокератина СК 5/7 и Е-саdherin. Но цитокератин высокой молекулярной массы (HMW СК 34ВЕ12) присутствует в цитоплазме клеток долькового рака in situ. Это является важным дифференциальным признаком для диагностики протокового и долькового рака.Черездовольно длительный промежуток времен и у некоторых женщин на фоне рака in situ возникают инвазивные формы рака, но следует отметить, что дольковый рак in situ не обязательно является предраком инфильтративных форм.
К ним относят простую протоковую гиперплазию, гиперплазию со слабо выраженной пролиферацией эпителия, атипическую протоковую гиперплазию и протоковый рак in situ (трех степеней дифференцировки). Существуют два классификационных подхода к оценке эпителиальных пролиферативных поражений протоков. Касательно молочной железы одновременно используют две классификационные схемы.Таблица 1. Классификационные схемы оценки эпителиальных пролиферативных поражений протоков
| Традиционная терминология (классификация ВОЗ) | Терминология DIN |
| Простая протоковая гиперплазия | Простая протоковая гиперплазия |
| Слабо выраженная протоковая атипия | Протоковая интраэпителиальная неоплазия Gradel А |
| Атипическая протоковая гиперплазия | Протоковая интраэпителиальная неоплазия Gradel В |
| Протоковый ракin situ Gradel | Протоковая интраэпителиальная неоплазия GradeI C |
| Протоковый ракin situ Grade 2 | Протоковая интраэпителиальная неоплазия Grade 2 |
| Протоковый ракin situ Grade 3 | Протоковая интраэпителиальная неоплазия Grade 3 |
Риск развития инвазивного рака из простой протоковой гиперплазии составляет 2,6% за период наблюдения около 14 лет. Следует отметить, что такой процент инвазивного рака на фоне атипической протоковой гиперплазии формируется за 8,3 года.
В другом исследовании указывается, что в 4% случаев простая протоковая гиперплазия транформировалась в инвазивиый РМЖ за 15 лет наблюдения. Однако риск развития рака на фоне этой гиперплазии значительно ниже, чем при других вариантах гиперплазии. Обычная протоковая гиперплазия является одним из морфологических проявлений гормональных изменений в организме женщины. Морфофункциональные изменения, возникающие в различные периоды менструального цикла и беременности, могут симулировать обычную протоковую гиперплазию, поэтому патологоанатом должен иметь информацию о состоянии женщины, ее возрасте, наличии эндокринных и гинекологических заболеваний.Обязательно следует выдерживать сроки взятия биопсии или проведения операции в соответствии с менструальным циклом.
В данном варианте протоковой неоплазии по сравнению с предыдущим более выражена пролиферация эпителия, клетки формируют в протоке от 1 до 3-5 рядов, более существенно проявление атипии клеток. Фото 11. Протоковая неоплазия со слабо выраженной атипией. Гематоксилин-эозин, х 100 Папиллярные, криброзные, солидные пролифераты отсутствуют. Часто отмечают секрецию эпителия (цитоплазма клеток становится обильной светлой пенистой, ядро расположено ассиметрично, ближе к базальному краю) и секрет в просвете протоков (фото 12-14). Фото 12. Протоковая неоплазия со слабо выраженной атипией. Гематоксилин-эозин, х 200 Фото 13. Протоковая неоплазия со слабо выраженной атипией. Эпителий протоков формируют микропапиллярные структуры и сосочки. Гематоксилин-эозин, х 200 Фото 14. Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами. Гематоксилин-эозин, х 200 Возможны микрокальцинаты. Морфологическая картина при этой патологии соответствует протоковой интраэпителиальной неоплазии Gradel А.Риск развития инвазивного рака на фоне простой протоковой атипии выше, чем на фоне простой протоковой гиперплазии.
Это заболевание характеризуется более выраженной пролиферацией эпителия, усилением признаков клеточного полиморфизма и появлением атипии разной степени выраженности. Заболевание характеризуется умеренным риском развития инвазивного рака молочной железы. В протоках отмечают равномерное распределение мономорфных клеток с округлым ядром. Эпителиальные клетки формируют папиллярные структуры, солидные группы, пучки, аркады, криброзные структуры внутри протоков. Морфологическая картина соответствует протоковой интраэпителиальной неоплазии Gradel В, местами протоки похожи на рак in situ G1. Для атипической протоковой гиперплазии обязательны участки простой протоковой гиперплазии. Для исключения рака in situ общим требованием является взятие на исследование ткани через каждый 1 мм и исследование серийных срезов гистологического блока. Микрокальцинаты могут отсутствовать, быть представленными фокально или на большом протяжении. Это не является ведущим фактором для установления диагноза (фото 15-19). Фото 15. Атипическая протоковая гиперплазия. Некроз и кальцинаты в протоках. Гематоксилин-эозин, х 200 Фото 16. Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами, формирует криброзные структуры, слева отмечается очаг некроза, во многих протоках явления секреции. Гематоксилин-эозин, х 200 Фото 17. Атипическая протоковая гиперплазия. Атипичный эпителий в протоках формирует солидные пласты, однако нет инвазии стромы. Гематоксилин-эозин, х 200 Фото 18. Тот же участок. Видны атипичные клетки с гиперхромными ядрами, нет инвазии стромы. Гематоксилин-эозин, х 400 Фото 19. Экспрессия гладкомышечного актина (клон HHF35, производство DAKO). Иммуногистохимичеокое окрашивание, система визуализации Envision, хромоген DAB. Миоэпителиальные клетки в виде непрерывной линии вдоль базальной мембраны, х 200 Рецепторы эстрогена и прогестерона выявляют в большом количестве клеток, белок ERBB2 экспрессируется крайне редко, экспрессия этого белка более характерна для рака in situ. Белок р53 не выявляют как в атипической протоковой гиперплазии, так и раке in situ. Однако экспрессия Cyclin D1 выявлена в 27-57% случаев атипической протоковой гиперплазии. Около 90% случаев атипической протоковой гиперплазии не имеют экспрессии цитокератина высокого молекулярного веса (СК HMW), таких как СК 5/10/14, поэтому их можно использовать для дифференциальной диагностики с простой протоковой гиперплазией. Атипическая протоковая гиперплазия имеет довольно высокий риск развития инвазивного рака молочной железы. По данным различных авторов инвазивиый рак развивается в 3,7-22% случаев атипической протоковой гиперплазии. Важнейшим отличительным признаком любой формы протоковой интраэпителиальной неоплазии является наличие непрерывной базальной мембраны и слоя миоэпителиальных клеток. В зависимости от степени протоковой интраэпителиальной неоплазии количество эпителиальных клеток отличается. Наиболее важная и сложная задача патологоанатома — не пропустить инвазию опухолевыми клетками базальной мембраны. Эта задача может быть выполнена только в результате кропотливого исследования большого количества срезов, отбора наиболее подозрительных на малигнизацию участков и проведения дополнительных методов окраски базальной мембраны и миоэпителиальных клеток.Неоценимую помощь в этом оказывает иммуногистохимический метод исследования. Для маркировки миоэпителиальных клеток мы часто применяем антитела к гладкомышечному актину, которые дают четкое окрашивание, и реакция легко воспроизводима (фото 19).
Эти образования возможны в любом месте в пределах системы протоков от соска до терминальной дольково-протоковой единицы. Бывают доброкачественные варианты (внутрипротоковая папиллома), атипические (атипическая папиллома) и злокачественные (внутрипротоковый папиллярный рак). Среди внутрипротоковых папиллом в зависимости от локализации выделяют центральные и периферические варианты. Центральная внутрипротоковая папиллома — это одиночное образование, располагающееся, как правило, в субареолярной зоне, часто в кистозно-расширенном протоке. Периферические внутрипротоковые папилломы чаще множественные. Большинство исследователей считают, что одиночные внутрипротоковые папилломы не имеют тенденции к малигнизации. Множественные папилломы, особенно в периферических отделах дольково-протоковой системы, склонны к озлокачествлению. Большие затруднения возникают при диагностике центральных внутрипротоковых папиллом, так как они могут клинически сопровождаться кровянистыми выделениями из соска.Диагностика папиллом включает обязательно маммографию, ультразвуковое исследование (УЗИ), а также цитологическое исследование выделений из соска.
Внутрипротоковая папиллома — округлое образование с четкой границей размером 3-4 см, но возможны процессы, занимающие несколько сантиметров в диаметре. Внутрипротоковая папиллома представлена сосочковыми разрастаниями, состоящими из фиброваскулярной ножки, покрытой эпителием и миоэпителием (фото 20). Часто отмечают апокринизацию эпителия. Фото 20. Внутрипротоковая папиллома. Гематоксилин-эозин, х 200 Термин «папилломатоз» молочной железы эксперты ВОЗ рекомендуют избегать и использовать термин «множественные внутрипротоковые папилломы».Все внутрипротоковые папилломы имеют общий морфологический код в Международном классификаторе онкологических заболеваний — 8503/0.
Составляет 10% всех доброкачественных поражений молочной железы. Чаще выявляют у женщин среднего возраста (40-50 лет). Пальпаторные поражения — это округлые образования с четко ограниченными контурами, имеется связь с расширенным крупным протоком. Пункционная биопсия позволяет получить серозное содержимое. Размер, как правило, большой, от 3-4 мм до нескольких сантиметров. Фото 21. Внутрипротоковая папиллома. Видны отдельные сосочки с фиброзной стромой и однорядной эпителиальной выстилкой. Гематоксилин-эозин, х 200 Гистологическое строение центральной и периферической внутрипротоковой папилломы одинаковое. Однако, учитывая большие размеры центральной папилломы, в ней можно отметить участки двух видов: протоковый и папиллярный. Папиллярные образования представлены фиброваскулярной ножкой, покрытой двумя слоями эпителия. Протоковый компонент имеет строение описанных выше протоковых гиперплазии. Опухоли, в которых преобладает протоковый компонент и склероз стромы, обычно называют «склерозирующая папиллома». В центральных внутрипротоковых папилломах могут быть представлены участки пролиферации миоэпителия, апокринизация эпителия, плоскоклеточная, хрящевая и костная метаплазия, внутрипротоковая пролиферация эпителия, воспалительная инфильтрация. Отсутствие клеточной атипии, инвазии стромы позволит диагностировать центральную внутри протоковую папиллому.Особенно кропотливой работы требуют папилломы с участками, имитирующими микроинвазию. Большую помощь в таких случаях оказывает иммуногистохимическое исследование компонентов базальной мембраны и миоэпителия, Чаше для этих целей применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
В отличие от центральной внутрипротоковой папилломы, эта опухоль развивается у женщин более молодого возраста. Клиническое течение чаще протекает скрыто. Большие размеры папиллом могут пальпироваться. Маммография выявляет чаше множественные узловые образования с четкими контурами, возможны микрокальцинаты. Фото 22. Периферическая внутрипротоковая папиллома. Гематоксилин-эозин, х 200 Характерный мультицентричный рост периферической внутрипротоковой папилломы может быть на фоне внутрипротоковой гиперплазии, карциномы in situ или инвазивного рака.Термин «микропапиллома» применяют к малым формам периферической внутрипротоковой папилломы. Часто микропапилломы выявляют в больших фокусах аденоза молочной железы.
Эта форма внутрипротоковой папилломы выделена из-за ее важного прогностического значения, поскольку именно на фоне атипической внутрипротоковой папилломы чаще возникают инвазивные карциномы. В отличие от описанных выше папиллом, атипическая внутрипротоковая папиллома характеризуется ядерной атипией, часто многорядностью эпителия, наличием солидных участков с некрозами, могут быть небольшие участки высокодифференцированной карциномы in situ. Фото 23. Атипическая внутрипротоковая папиллома. Сосочки имеют грубоволокнистую соединительнотканную основу, миоэпителиальный компонент и один или несколько слоев эпителиальных клеток с гиперхромными ядрами. Гематоксилин-эозин, х 200 Если участки рака в папилломе значительные (до 90% площади), то к этой опухоли применим термин «внутрипротоковый папиллярный рак». Характерной особенностью этого рака является отсутствие инвазии опухолевых клеток через базальную мембрану в окружающую строму.Кроме исследования большого количества срезов опухоли, исключить очаги инвазии помогает имуногистохимическое исследование с антителами к коллагену IV типа и гладкомышечному актину, а также отсутствие лимфогистиоцитарной инфильтрации в строме вокруг папилломы.
Внутрипротоковый папиллярный рак лишен (почти на всем протяжении) миоэпителиального клеточного слоя и характеризуется пролиферацией атипичного эпителия (фото 24). Часто бывает мультицентричный рост. Фото 24. Внутрипротоковый папиллярный рак. Часть сосочков не имеет соединительной ткани в своей основе и состоит из атипичных эпителиальных клеток. Гематоксилин-эозин, х 400 Эта опухоль имеет свой морфологический код в Международном классификаторе онкологических заболеваний — 8503/2. Захарцева, М.В. Дятел, А.В. Григорукmedbe.ru
Атлас макроскопической патологии человека
1. ВОСПАЛЕНИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ (N61). Классический гнойный мастит достаточно часто встречается в клинической практике, но не является патологией, представляющей значительный интерес для аутопсийной работы. Это объясняется несколькими вполне очевидными причинами. Во-первых, недиагностированные маститы являются казуистическими случаями, тем более столь далеко зашедшие, чтобы выступить в качестве основного заболевания в патологоанатомическом диагнозе. Во-вторых, представляя значительный интерес с точки зрения лечения и диагностики, они не имеют каких-либо макроскопических особенностей, принципиально отличающих эту форму гнойного воспаления от любой другой. В-третьих, если далеко зашедший, резистентный к терапии гнойный процесс все же имеет место, то механизмы развития сепсиса и его макроскопическая картина не отличаются какими-либо характерными чертами.
Аналогичное суждение справедливо и для абсцессов молочной железы. Ни в коей мере не умаляя значения этой патологии, следует сказать, что проведение исследования воспалений молочной железы обычно не входит в поле зрения прозектора, производящего вскрытие.
2. ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ И ОПУХОЛЕПОДОБНЫЕ ПРОЦЕССЫ МОЛОЧНОЙ ЖЕЛЕЗЫ являются чрезвычайно распространенными заболеваниями и имеют большое практическое значение для современной клиники и патологии. Однако патологоанатом, производящий вскрытие, редко имеет дело с незлокачественными массами молочной железы. Для гистопатологической практики эта патология представляет несомненный и значительный интерес.
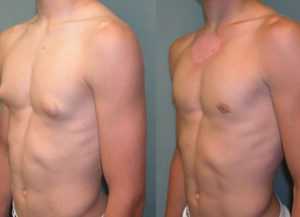
2.1. Гинекомастия (N62) определяется как увеличение грудной железы у мужчин и только в некоторых случаях связана с истинным ожирением. Соответствующий диагноз может быть установлен при асимметричном поражении и при наличии болевого синдрома.
Пубертатная гинекомастия является частым процессом и представлена увеличением грудной железы в позадисосковом пространстве до 2—4 см (рис. 9.1). Процесс обнаруживает спонтанную регрессию в течение 1—12 мес. Гинекомастия довольно часто определяется у пожилых лиц, особенно в связи с возрастным ожирением. Кроме того, гинекомастия может являться первым симптомом других заболеваний, например, при синдроме Пейтца—Егерса, и быть связана с возникновением тестикулярных опухолей.
Весьма разнообразные причины гинекомастии могут быть классифицированы по следующим группам: идиопатические; физиологические (ожирение, возраст и др.); эндокринные (анд рогены, пролактин, тиреотоксикоз, синдром Клайнфельтера и др.); системные болезни (печень, почки); опухоли (надпочечники, легкие, половые железы) и применение ряда лекарственных препаратов. Обычно физиологические и эндокринные гинекомастии билатеральные, а идиопатические, негормональные и фармакологические — односторонние.
2.2. Солитарная киста молочной железы (N60.0) является достаточно редким процессом, если рассматривать ее как отдельную нозологическую форму, но в качестве сопутствующего морфологического синдрома при различных очаговых и диффузных поражениях встречается довольно часто.
Киста молочной железы может быть начальным проявлением фиброзно-кистозной мастопатии, эктазии протоковой системы, различных форм мастита, особенно связанного с кормлением. Макроскопически обычно представляет собой кистовидное образование с гладкими стенками и довольно плотной капсулой (рис. 9.2). Содержимое кисты зависит от этиологического фактора. При дифференциальной диагностике особое внимание следует обратить на так называемый комедомастит, абсцесс молочной железы и отдаленные последствия травматического или спонтанного жирового некроза молочной железы.
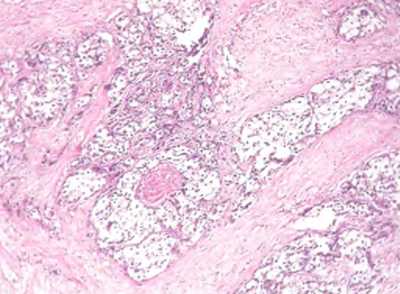
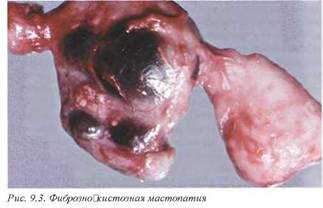
2.3. Фиброзно-кистозная мастопатия (N60.1). Фиброзно-кистозная болезнь молочной железы является очень важной проблемой патологии в связи с высокой частотой, несомненной связью со злокачественными опухолями и сложностью дифференциального диагноза с раком молочной железы. Если в практике хирургической анатомической патологии эта проблема является одной из основных, то с точки зрения аутопсий ее значение не столь велико.
В литературе существует множество синонимов данного заболевания: кистозная болезнь, кистозная мастопатия, кистозная гиперплазия, болезнь Шиммельбуша. Термин «дисплазия молочной железы» не является корректным для описания этого патологического процесса.
Болезнь чаще определяется в возрасте 25—45 лет. В этиопатогенезе основную роль играют гормональные воздействия. Истинную частоту патологического процесса в популяции определить невозможно по многим причинам, и прежде всего в связи с нередко бессимптомным течением этого заболевания.
Процесс чаще двусторонний и симметричный, однако в некоторых случаях определяется одностороннее поражение или более интенсивное развитие патологического процесса в одной железе.
Макроскопически определяются множественные кисты, локализованные диффузно в паренхиме железы, с гладкой внутренней поверхностью (рис. 9.3). Содержимое кист жидкое, желтого цвета или прозрачное. По периферии больших кист наблюдается микрокистоз. Диагноз устанавливается только на основании микроскопического исследования.
2.4. Фиброаденома молочной железы (D24/M9020/0) —широко распространенный патологический процесс. Чаще всего определяется у женщин в возрасте 25—35 лет. Опухоли увеличиваются в размерах при беременности и редуцируют с возрастом.
Макроскопически представлены солитарными инкапсулированными опухолевыми массами плотной консистенции, не более 3—4 см в диаметре, обычно округлой формы. В 20% наблюдений определяется билатеральная локализация. Опухоли четко отграничены от прилежащей паренхимы, что позволяет в большинстве случаев легко дифференцировать их с фиброзно-кистозной мастопатией (рис. 9.4). Со временем фиброаденомы подвергаются кальцификации или оссификации и приобретают чрезвычайно плотную стекловидную консистенцию.
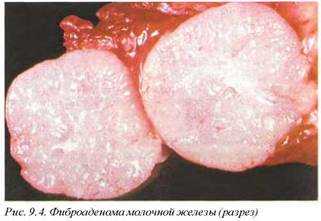
В связи с развитием локальной недостаточности кровообращения в фиброаденомах возможно развитие инфарктов с последующей резорбцией некротических масс. В таких случаях в плотных старых опухолях выявляется центральная киста с буроватой периферической окраской. На разрезе паренхима опухоли волокнистая, серо-белая, в ряде случаев слабо видимые нодулярные структуры возвышаются над поверхностью разреза и придают опухоли бугристый вид (рис. 9.5). В паренхиме определяются щелевидные полости, представляющие собой склерозированные сосуды.
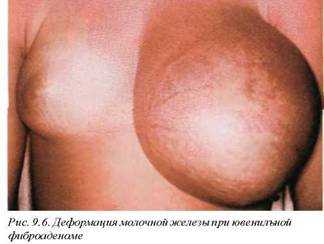
Ювенильные фиброаденомы могут достигать значительных размеров и приводить к деформации молочной железы (рис. 9.6). Однако макроскопическая структура их сохраняется. В таких случаях следует проводить дифференциальную диагностику с листовидной саркомой.
2.5. Внутрипротоковая папиллома (D24/M8503/0). Папилло матозные пролифераты протоковой системы молочной железы чрезвычайно важны в практике хирургической анатомической
патологии в связи с их распространением и трудностями диффе ренцировки доброкачественного и злокачественного процессов. Приблизительно 70% всех гистологических препаратов из пролиферирующих и внутрипротоковых папиллом требуют коллегиального просмотра несколькими специалистами. Как и многие другие заболевания молочной железы, папилломы не имеют существенного значения для аутопсийной практики.
Папиллярные процессы молочной железы включают внутри протоковую папиллому, папилломатоз, множественные папилломы, гиперплазию терминальных протоков и атипическую протоковую гиперплазию. Дифференциально-диагностическими признаками являются: количество поражений, размеры вовлеченных протоков, степень пролиферации и наличие клеточной атипии.
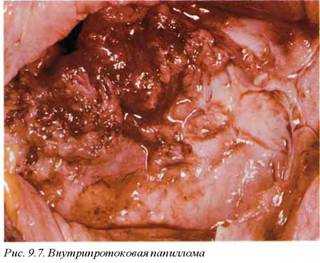
Макроскопически внутрипротоковые папилломы обычно имеют небольшие размеры, однако в ряде случаев они могут достигать 4—6 см в диаметре. Паренхима опухоли мягкая и ломкая, легко разрушается (рис. 9.7). В связи с этим основным клиническим признаком являются кровянистые выделения из одного соска. В опухоли часто обнаруживаются участки кровоизлияний.
Возможности злокачественной трансформации внутрипротоковых папиллом весьма преувеличены — только 1—3% из них приобретают признаки злокачественного роста. Даже в случаях малигнизации внутрипротоковых папиллом вопрос — является ли этот процесс истинной трансформацией или фоном для развития внутрипротоковой карциномы — остается открытым.
2.6. Зернисто-Клеточная опухоль (М8895/0), или миома из миобластов, является редкой, но важной нозологической формой. Это связано с тем, что данную доброкачественную опухоль макроскопически невозможно дифференцировать с карциномой молочной железы. На разрезе паренхима опухоли плотная, гомогенная, серо-белая или серо-желтая (рис. 9.8). Как правило, опухоль не связана со структурами кожи и подкожной жировой клетчаткой. В некоторых случаях она плотно спаяна с подлежащей фасцией. Зернисто-клеточные опухоли молочной железы могут достигать 10 см в диаметре.
2.7. При проведении макроскопического исследования молочной железы в ходе вскрытия в дифференциальную диагностику процесса должны войти состояния, связанные с имплантацией искусственной молочной железы (Т85.9). На сегодняшний день около 13 млн женщин имеют имплантированные силиконовые молочные железы, которые обычно помещаются под большую грудную мышцу или, что менее желательно, в подкожную клетчатку (рис. 9.9). При обычном состоянии имплантата приблизительно у 20% пациенток развивается выраженная инкапсуляция с деформацией естественной молочной железы и развитием значительного болевого синдрома, что требует удаления протеза. Разрывы имплантата наблюдаются в 5—8% всех случаев имплантации, а кровотечения в гель отмечаются еще чаще. Несмотря на то, что любой компонент протеза может стать адъювантом предшествующей аутоиммунной болезни, учащения иммунологических нарушений у лиц с грудными имплантатами обнаружено не было. Широкие эпидемиологические исследования не выявили учащения рака молочной железы у лиц, подвергнувшихся имплантации, однако следует отметить, что диагностика данного заболевания у этой категории лиц затруднительна, поскольку маммография в этом случае не является достаточно эффективной.
3. ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ МОЛОЧНОЙ ЖЕЛЕЗЫ (С50)
3.1. Рак молочной железы. На сегодняшний день злокачественные опухоли молочной железы (подавляющее большинство которых представлено раками) являются самыми частыми новообразованиями у женщин. Эта патология представляет собой нетолько медицинскую, но и социальную проблему. Достижения в диагностике и лечении позволили продлить жизнь многих больных, и в настоящее время 5 -летний уровень выживаемости составляет 67% для всех форм (независимо от стадии болезни) и до 90% в 0 и I стадии.
Рак молочной железы является вторым по частоте (после рака легкого) в структуре летальности от злокачественных новообразований. Ежегодно в США выявляется около 180 000 новых случаев рака молочной железы и регистрируется 43 000 смертей, т.е. эта опухоль обнаруживается у каждой 8-й — 9-й женщины.
Особое внимание следует обратить на факторы риска: поздние роды или бесплодие; семейный анамнез рака молочной железы, особенно у родственников первой линии; атипическую дисплазию молочной железы.
В последнее время все большее внимание уделяется изучению роли генетических факторов в возникновении рака молочной железы. Установлена достоверная корреляция между мутацией хромосомы 17 и вероятностью наследственного рака. Выделено несколько генов, мутации которых увеличивают вероятность заболевания раком молочной железы и некоторыми другими злокачественными опухолями. BRCA1, мутантный ген, связанный с хромосомой 17, является проонкогеном, т.е. его аплификация усиливает риск как рака молочной железы, так и рака яичников и рака простаты. Мутация BRCA2 в хромосоме 11 облигатно связана с 5% всех раков молочной железы. ТР53 является универсальным супрессорным геном, и его мутация приводит к развитию большого числа опухолей различной локализации. Экспрессия мутированного HER-2/neu является причиной 30% спорадического рака молочной железы.
Диагностика рака молочной железы — многоступенчатый процесс, принципы и последовательность которого изложены достаточно подробно в соответствующих руководствах. Следует отметить, что ни один из существующих методов исследования не может быть принят в качестве основного, и для заключительного диагноза во всех случаях необходимо гистологическое исследование.
Снижение смертности от рака молочной железы связано как с внедрением скрининговых методов диагностики, так и новых форм лечения. Алгоритм скрининговой системы позволяет выявить лиц с высоким риском и создать условия для детальной диагностики патологического процесса молочной железы. Диагностика рецепторов эстрогенов и прогестерона позволила применять гормональную терапию при некоторых резистентных раках и эффективно лечить до 70% больных с метастатическими формами заболевания.
Установлено, что прогноз раков при положительных эстрогеновых и прогестероновых рецепторах более благоприятный и их наличие позволяет выбрать контингент для проведения адъювантной и/или неоадъювантной терапии.
Макроскопически опухоли молочной железы представлены гомогенными массами белого цвета, в различной степени отграниченными от окружающей паренхимы. Диагноз рака молочной железы может быть установлен только гистологически, и прямых морфологических симптомов, характерных для той или иной формы рака или обладающих дифференциально-диагностическими критериями, не существует. Однако более тщательное исследование опухолевой массы молочной железы может дать определенную информацию о преимущественности той или иной формы злокачественного роста.
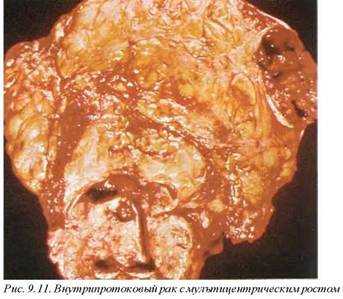
Так, инвазивные протоковые карциномы представлены опухолевыми массами, неотграниченными от прилежащей паренхимы. Плотность их ткани зависит от интенсивности десмопластической реакции (рис. 9.10). При разрезе ткани опухоли слышен характерный скребущий (песчаный) звук, что связано с развитием кальцификации. Иногда мультицентрические фокусы (или внутрижелезистые метастазы) связаны между собой интенсивно развитыми кальцифи- катами, напоминающими мел (рис. 9.11). В некоторых случаях крупные протоки и сосуды в толще опухоли выступают над поверхностью разреза в виде «гусиных перьев», что объясняется довольно характерным эластозом этих структур. Наличие интенсивной кальцификации свидетельствует о высокой вероятности инвазии даже при видимом ее отсутствии. Все описанные симптомы не являются специфическими и могут встречаться при доброкачественных процессах, например, при склерозирующей папиллярной пролиферации.
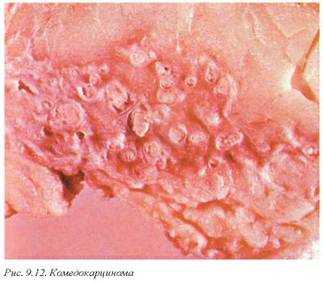
Внутрипротоковая карцинома макроскопически представлена опухолевой массой с видимо утолщенными стенками протоков и полями нормальной паренхимы железы между ними. Окружающая ткань может быть представлена неизмененной молочной железой или значительно инфильтрирована. При внешнем давлении из просвета утолщенных протоков выделяются полужидкие бело-серые массы, что является довольно характерным симптомом для комедокарциномы (рис. 9.12).
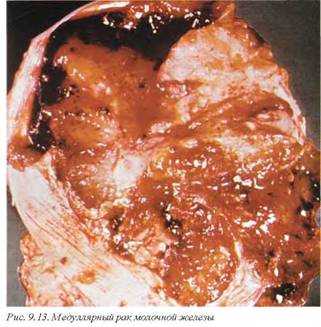
Медуллярный рак отличается выраженным агрессивным течением и макроскопически представлен хорошо отграниченной опухолью белого цвета с кровоизлияниями и некрозами и по внешним признакам напоминает фиброаденому со вторичными дегенеративными изменениями (рис. 9.13). Обычно опухоль развивается в относительно молодом возрасте — 60% больных составляют лица моложе 50 лет.
Папиллярный рак молочной железы представлен опухолевой массой с плотноэластической гомогенно-белой паренхимой, иногда с центральной кистевидной полостью и множественными хрупкими белыми и бело-серыми папиллярными разрастаниями (рис. 9.14).
Размер опухоли определяет стадию процесса: 2 см — для Т1 и Т2; 5 см — для ТЗ; любой размер — для Т4 при наличии Ml.
Диагноз рака молочной железы может быть установлен только на основании гистологического исследования. Существующие клинические методы диагностики могут лишь усилить или уменьшить подозрение, но ни в коем случае не являются прерогативными в диагностике.
Рак молочной железы метастазирует в лимфатические узлы, легкие и плевру, кости и печень. Гормонально-позитивные раки иногда метастазируют в яичники.
3.2. Болезнь Педжета (рак Педжета) (С50.0/М8540/3) представляет собой патологический злокачественный процесс, вовлекающий сосок молочной железы. Ряд авторов расценивают болезнь Педжета лишь как внешнее проявление внутрипротокового рака. Этот тип злокачественной опухоли молочной железы всегда сопровождает течение болезни Педжета и может протекать как со стромальной инвазией, так и без нее. В связи с этим такая точка зрения представляется достаточно справедливой. Как патологический процесс рак Педжета возникает вторично и является новой характеристикой внутрипротокового злокачественного процесса. Прогноз этого состояния зависит именно от поведения протокового компонента (наличие инвазии или чистая внутрипротоковая форма), а не от присутствия или отсутствия внутриэпителиального повреждения.
Макроскопически рак Педжета представлен бляшковидным экземоподобным легко кровоточащим фокусом, первично расположенным на соске и позднее распространяющимся на всю ареолу (рис. 9.15). Размеры опухолей редко превышают несколько сантиметров.
В некоторых случаях непосредственно за соском может паль паторно определяться опухоль, и в таких случаях практически всегда подлежащая опухоль инвазивная. С другой стороны, отсутствие пальпируемой опухоли не позволяет исключить инва зивный внутрипротоковый компонент.
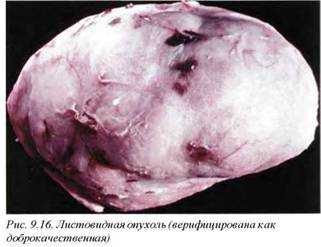
3.3. Фиплюирная (листовидная) цистосаркома (C 50/D24/M9020/ 0 —М9020/3). При описании данного патологического процесса термин «саркома» (в общем его понимании) не является удовлетворительным, поскольку большинство опухолей этого типа протекают доброкачественно. В этом случае, вероятно, правильнее применять термин «листовидные опухоли», которые более соответствуют морфологической картине и биологическому поведению новообразований данной группы.
Листовидные опухоли встречаются редко и в том же возрасте, что и раки молочной железы. Они известны тем, что могут достигать довольно значительных размеров, однако в большинстве случаев не превышают 5 см в диаметре.
Макроскопически опухоль имеет округлую форму (рис. 9.16). Определяется уплощение соска, но кожа в процесс никогда не вовлекается. С другой стороны, опухоль довольно часто интимно прилежит к фасции, создавая картину псевдоинвазии. Листовидные опухоли на разрезе плотные, серо-белого цвета, с выраженной капсулой, четко отграничивающей опухоль от прилежащей паренхимы (рис. 9.17). В опухолях больших размеров определяются некрозы (с явлениями резорбции или без таковой), инфаркты и кровоизлияния различного срока давности. Единичные щелевидные полости представляют расширенные склерозированные сосуды.
В редких случаях возникает вторичное абсцедирование при прямом распространении инфекции и изъязвлении. «Старые» опухоли обнаруживают выраженное дольчатое строение в связи с организацией вторичных дегенеративных процессов и развитием фиброза.
3.4. Саркомы молочной железы (общий морфологический код М8800/3). Другие злокачественные опухоли молочной железы не являются органоспецифическими и не имеют принципиальных макроскопических отличий от своих аналогов иных локализаций.
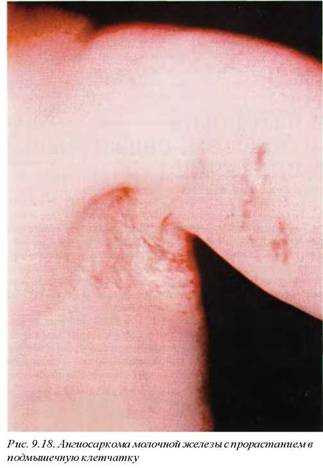
Ангиосаркома (рис. 9.18) молочной железы встречается крайне редко. Прогноз заболевания неблагоприятный. Макроскопически опухоль нечетко отграничена от прилежащей паренхимы железы, ткань ее мягкая, губчатая, с массивными очагами кровоизлияний.
Злокачественная лимфома (рис. 9.19) молочной железы как самостоятельная опухоль встречается редко, однако может представлять часть генерализованного процесса. Макроскопически опухоль не отграничена от окружающей паренхимы, ткань ее мягкая, серо[белая, отечная, при разрезе выбухает над поверхно- стью.Прогноз опухоли зависит от гистоструктуры. Злокачественные лимфомы не вовлекают сосок и покрывающую кожу.
4. ОПУХОЛИ КОЖИ. Ниже приведены некоторые данные, касающиеся злокачественных опухолей кожи, которые крайне редко выступают в качестве основного заболевания в аутопсийной практике.
4.1. Злокачественная меланома (С43.9/М8720/3) — наиболее агрессивная кожная злокачественная опухоль, имеющая высокий метастатический потенциал. Прогноз значительно ухудшается при наличии метастазов. Этиологические и предрасполагающие факторы: светлая кожа, избыточная солнечная экспозиция семейный анамнез меланомы, невоидный диспластический синдром (аутосомно-Доминантный синдром, проявляющийся во множественных невусах и кожных меланомах, ассоциируется с мутацией в хромосоме 9) и врожденные гигантские невусы.
Гистологически выделяется несколько типов злокачественной меланомы:
- поверкностно-распространенная — наиболее частая форма, проявляет радиальный рост перед метастазированием;
- лентигозная — относительно более доброкачественная форма, обнаруживает длительный радиальный рост перед метастазированием ;
- акральио-лентигозная — характерна для темнокожих больных (возникает на ладонях и подошвах, слизистых и кожно-слизистых соединениях, течение более злокачественное, чем классической лентигозной формы;
- нодулярная — прогноз неблагоприятный в связи с инициально-инвазивным характером роста.
Макроскопически меланома представлена пигментированным фокусом (редко амеланотическим), цвет значительно варьирует, но обычно коричневый и черный. Вероятность малигниза ции увеличивается, если пигментный фокус имеет асимметричную и неровную поверхность и его диаметр составляет более 6 мм.
4.2. Базально-Клеточный рак (М8090/1 — М8090/3) — наиболее частая форма кожного рака, обычно возникающая на открытых поверхностях (кожа лица). Этиологическими и предрасполагающими факторами являются длительное солнечное и ультрафиолетовое облучение, хроническое воздействие неорганического мышьяка и ионизирующая радиация. Гистологически выделяется несколько типов базально-клеточного рака с приблизительно одинаковым клиническим течением и прогнозом. Макроскопически базально-клеточный рак имеет классический вид. Вначале определяется плотная блестящая гладкая папула, которая со временем изъязвляется. Язва имеет закругленные края, отвесные стенки и телеангиоэктазии в дне. Опухоль обладает местно-дест руирующим ростом и обычно не метастазирует.
4.3. Плоскоклеточный рак (М8050/3) — более редкий, чем базально-клеточный. Этиологические и предрасполагающие факторы аналогичны таковым при базально-клеточном раке, и, кроме того, эта форма опухолей развивается на фоне рубцов и хронических воспалений (после ожогов, по периферии костно-кожных фистул при хронических остеомиелитах). Солнечный кератоз для плоскоклеточного рака является предраковым процессом. Выделяют несколько типов плоскоклеточного рака с приблизительно сходным клиническим течением и прогнозом. Макроскопически плоскоклеточный рак представлен гиперкератотической папулой или узлом. Эрозирование может быть как первичным (эрозивный рак), так и вторичным (эрозия узла или папулы).
makro-patologiya.ru