Миома матки патогенез
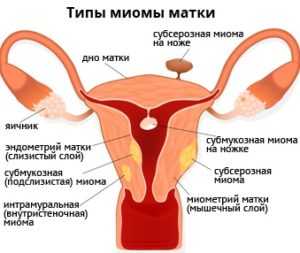
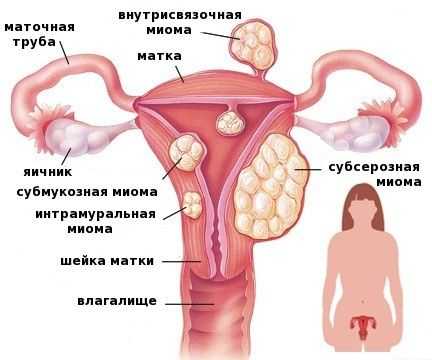
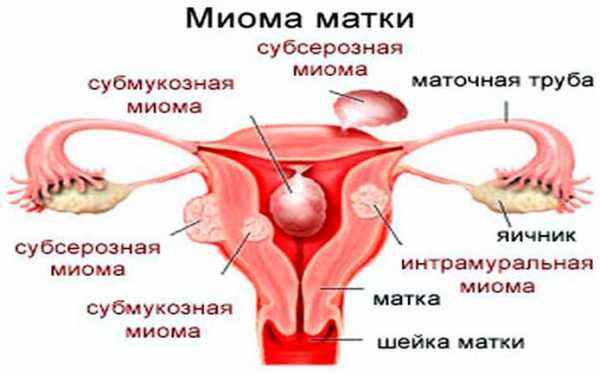
Классификация и типы миомы матки
среда, мая 18, 2016 - 13:31
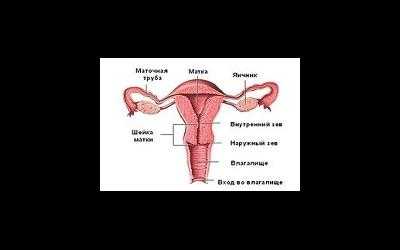
Миома матки является опухолью доброкачественного характера, развивающейся в мышечном слое матки. Существуют различные типы миомы матки. Подразделение заболевания на несколько отдельных видов зависит от локализации миоматозных узлов.
В большинстве случаев опухоль формируется в теле матки, редко на шейке и перешейке матки (шеечная и перешеечная миома матки).
Субмукозная миома матки
Раньше женщине с таким диагнозом не оставалось никакого выбора, кроме хирургического вмешательства по удалению матки. Медлить с операцией было нельзя ввиду достаточно серьезных осложнений, характерных этому виду миомы: маточных кровотечений, несущих опасность для здоровья и жизни пациентки, а также риска появления анемии вследствие существенной кровопотери. Миоматозные узлы, обладая действием внутриматочной спирали, являются своеобразным противозачаточным средством и препятствуют наступлению беременности.
Миоматозные узлы при субмукозной миоме располагаются внутри матки, под слизистой оболочкой, выстилающей её полость. Рост миоматозного узла происходит в направлении эндометрия (внутреннего слоя матки).
Субмукозная миома сопровождается ярко выраженной симптоматикой:
- маточными кровотечениями;
- обильными продолжительными менструальными выделениями, часто с кровяными сгустками;
- ацикличными кровотечениями;
- бесплодием;
- железодефицитом в крови, и, как следствие, анемией.
На сегодняшний день альтернативой удаления матки при такой патологии, как субмукозная миома матки является гистерорезектоскопия (внутриматочная хирургия), позволяющая сохранить женскую репродуктивную функцию. Данный малоинвазивный метод оперативного лечения позволяет эффективно бороться с такими внутриматочными патологиями, как миома матки, полип эндометрия, внутриматочные перегородки и т.д.
Субсерозная и интерстициосубсерозная миома матки
Миоматозные узлы при субсерозной миоме матки располагаются на её наружной поверхности. При достижении крупных размеров могут врастать в полость таза.
Миома данного вида не оказывает влияния на менструальную функцию. Сдавливая ткани смежных органов, она причиняет ощущение дискомфорта, приводит к задержке стула, нарушениям мочеиспускания и т.д.
Диагноз интерстициосубсерозная миома матки ставится в случае прорастания миоматозного узла сквозь стенки матки и продолжении его роста в направлении брюшной полости.
Интрамуральная миома
Миоматозные узлы при интрамуральной миоме локализуются в среднем мышечном слое матки, значительно увеличивая её размеры в процессе своего роста.
Характеризуется нарушением менструального цикла, сильными болями, чувством сдавливания, а также, при увеличенных размерах опухоли – бесплодием.
Крупные миоматозные узлы приводят к деформации полости матки и фаллопиевых труб.
Миома матки: этиология, патогенез
Данная патология считается гормонально зависимым опухолевидным новообразованием, появление и прогрессирование которой происходит преимущественно у женщин детородного возраста, ввиду высокой гормональной активности яичников. Снижение уровня половых гормонов в постклимактерический период зачастую приводит к обратному развитию опухоли (миома матки в стадии регресса).
Другой причиной развития миомы матки может быть патологическая регенерация миометрия, поврежденного ввиду внутриматочных вмешательств, абортов, а также инфекционных заболеваний половых органов воспалительными инфильтратами, вероятность появления которых у женщин детородного возраста значительно выше.
Половые гормоны играют решающую роль в процессе роста миомы матки на этапах, когда в узлах сформирован экстрацеллюлярный матрикс, который повышает восприимчивость опухоли к стероидным гормонам. По сравнению с окружающим миометрием, уровень эстрогенных рецепторов, расположенных в миоме, повышен в два раза, уровень прогестероновых – в три раза.
Наряду с вышеперечисленными факторами, на возникновение миомы матки может повлиять изменение иммунологической реактивности организма, вызванное хроническими очагами инфекции.
Различают три варианта роста миомы (быстрорастущей):
- истинный рост, вызванный пролиферацией и гипертрофией миогенных элементов;
- ложный рост, возникающий в связи с нарушением образования крови и лимфы, а также вследствие отека при обострении хронического воспаления;
- стимулированный рост, который обусловлен развитием другой патологии (саркомой, аденомиозом).
В более, чем в 60% случаев среди пациенток с быстрорастущей миомой диагностируется ложный рост.
Диагностика миомы матки
При проведении диагностики необходимо дифференцировать миому матки с новообразованиями доброкачественного и злокачественного характера придатков, кистами яичников.
Ввиду частого бессимптомного течения заболевания, миома матки нередко обнаруживается при профилактическом осмотре, что бывает неприятным сюрпризом для женщин.
Дополнительными способами подтверждения диагноза являются:
- ультразвуковое сканирование;
- ЦДГ (цветная доплерография);
- гистеросальпингография;
- компьютерная томография;
- магнитно-резонансная томография (при такой патологи как миома матки, МРТ позволяет выявить труднодиагностируемые случаи);
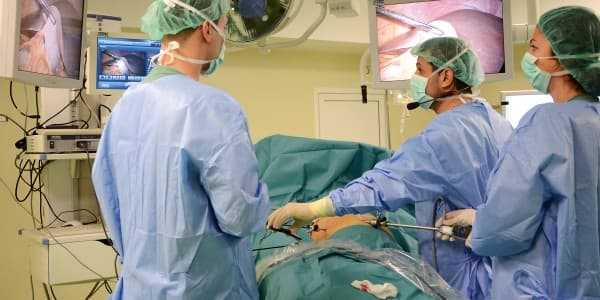
- лапароскопия.
Лечение миомы матки
Выбор метода лечения данного заболевания проводят в соответствии с возрастом больной, её желанием родить в дальнейшем ребенка, общим состоянием, сопутствующими заболеваниями, а также размеров и структуры миоматозных узлов (различные типы миомы матки требуют отдельного лечения).
Медикаментозная терапия миомы матки подразумевает прием лекарственных препаратов: комбинированных оральных контрацептивов, прогестерона и гестагенов, агонистов и антагонистов гонадотропин-рилизинг гормонов, антиэстрогенов и антагонистов прогестерона, а также препаратов кровоостанавливающего и обезболивающего, противовоспалительного действия.
Схема лечения подбирается с учетом индивидуальных данных пациентки. Самолечение строго запрещено.
Хирургическое лечение заболевания включает в себя проведение органосохраняющих операций, миомэктомии, радикальных (гистерэктомия) оперативных вмешательств, применение органосохраняющих малоинвазивных методик (эмболизацию маточных артерий), а также миолиз, при котором миоматозные узлы растворяются при помощи лазерного луча.
Преимущественным является комбинированный метод лечения, сочетающий медикаментозную терапию и миомэктомию.
Не нужно отрицать и народные методы лечения данной патологии. При этом следует понимать, что не стоит искать заговор от миомы матки у какой-нибудь ворожки. Речь идет прежде всего о фитотерапии. Лекарственные травы от миомы матки: боровая матка, чистотел, календула, лопух и многие другие в виде настоев в некоторых случаях являются довольно эффективным средством для борьбы с этим недугом.
Гомеопатия при миоме матки применяется также довольно часто и дает уверенные результаты.
При такой патологии, как миома матки, гирудотерапия (т.е. лечение медицинскими пиявками) помогает выравниванию гормонального баланса, изменения в котором стали причиной развития опухоли.
Таким образом, можно сделать заключение, что в борьбе с миомой матки все методы оправданы, отсутствие каких-либо действий, направленных на лечение заболевания (если это не является «выжидательной тактикой»), может привести к дальнейшему прогрессированию роста миоматозных узлов и даже к их озлокачествлению.
Любите себя, следите за состоянием своего здоровья, прислушивайтесь к своему организму, и в случае каких-либо подозрений не медлите с обращением к специалисту!
www.probirka.org
Современные аспекты этиологии и патогенеза миомы матки
Меглей Сергей Бендеры, Молдавия megley@rambler.ru
Одним из самых распространенных в гинекологической практике невоспалительных заболеваний является миома матки. Согласно современным представлениям, миома
матки не является истинной опухолью. По мнению Е. В. Коханевич и соавт. (1998, 1999), ее следует рассматривать как доброкачественную,
гормонально контролируемую гиперплазию мышечных элементов мезенхимального происхождения. От 20 до 40% женщин в возрасте старше 35 лет врач сообщает этот диагноз при очередном осмотре. Более половины оперативных вмешательств вгинекологических отделениях выполняются по поводу миомы матки.
Е.М. Вихляева и соавт. (1997) выделяют следующие факторы риска, способствующие возникновению миомы матки: позднее менархе, обильные менструации, высокая частота медицинских абортов, наличие экстрагенитальной патологии (особенно сердечно-сосудистой) и
гинекологических
заболеваний.В литературных источниках приводятся следующие данные о сочетании миомы матки с экстрагенитальными заболеваниями: ожирение — в 64% наблюдений, заболевания сердечно-сосудистой системы — 60%, нарушения со стороны желудочно-кишечно-печеночного комплекса — 40%, гипертоническая болезнь — у 19% больных, неврозы и неврозоподобные состояния — 11%, эндокринопатии — в 4,5% наблюдений. Исследования, проведенные B.T. Kamioski et al. (1993), показывают, что
избыточный вес в сочетании с низкой физической активностью и высокой частотой стрессов относятся к
факторам, способствующим развитию данного заболевания. При оценке риска возникновения миомы матки прослеживается генетическая предрасположенность кразвитию данного заболевания .
Морфологическому изучению миомы матки посвящено большое количество исследований. Согласно классическим работам по морфологии женской репродуктивной системы, проведенным еще в 30-е годы К.П. Улезко-Строгановой, образование
зачатков миоматозных узлов
происходит на эмбриональном этапе, что подтверждается последними исследованиями. По данным S. Fujii (1992) развитие систем гладкомышечных клеток мезодермальногопроисхождения (мюллеров проток) в течение внутриутробного
периода происходит до 30 недель, в то время как дифференцировка гладкомышечных клеток эндодермальногопроисхождения (желудочно-кишечного тракта) заканчивается в 12 недель. Недифференцированные клетки, которые затем пролиферируют
и дифференцируются в гладкомышечные клетки матки, в течение длительного периодавнутриутробного развития могут подвергаться воздействию
многочисленных факторов из организма матери (тропных гормонов, половых стероидов, факторов роста) и окружающей среды. Малодифференцированные клетки, подвергшиеся воздействию внешних факторов в течение внутриутробногоразвития, становятся предшественниками миом. Клетки-предшественники сохраняются в миометрии и начинают расти после менархе. Их рост
продолжается в течение многих лет на фоне выраженной активности яичников под действием как эстрогенов, так и прогестерона. В то же время в результате некоторых исследований установлено, что образование зачатка миоматозного узла может происходить из трансформированных гладкомышечных клеток миометрия и мышечной оболочки сосудов матки. По мнению M.S. Rein et al. (1995),неопластическая трансформация миометрия в миому происходит под влиянием соматических мутаций нормального миометрия, половых стероидов и местных
факторов роста. Несмотря на то, что миоматозные клетки проявляют морфологическое сходство с клетками миометрия, современные исследования выявили отличия вструктуре метаболизма этих тканей.
Развитие миом происходит из зон роста, расположенных обычно вокруг тонкостенного сосуда. Изначальные клетки миомы дифференцируются в миофибробласты, которые затем трансформируются в миобласты и фибробласты.
В морфогенезе миомы матки выделяют три последовательные стадии соответственно особенностям ее структурных компонентов и характеристикам тканевого обмена: 1.образование активной зоны роста (зачатка) в миометрии с активированным клеточным метаболизмом; 2.рост опухоли без признаков
дифференцировки; 3.рост опухоли с дифференцировкой и созреванием.
Возможно, что определенную роль в развитии заболевания играет нарушение нервно-мышечной регуляции миоматозных узлов. Г.А. Савицкий и соавт. (1986), проведя исследования узлов миом матки методом выявления холинэстераз, контактно-микроскопическим и флюоресцентным методами, установили, что в миоматозных узлах не обнаруживаются холин- и адренергические нервные структуры.
Это дало авторам основание утверждать, что узел миомы матки является абсолютно денервированным образованием.
В настоящее время выделяют простые и пролиферирующие миомы матки, последние встречаются у каждой четвертой больной с миомой матки. Миогенные элементы в пролиферирующих миомах не атипичны, но более многочисленны в
сравнении с миомами без признаков пролиферации. Отмечено, что в простых
миомах митозы отсутствуют, а в пролиферирующих миомах митотическая активность повышена. В этой связи И.А. Яковлева и Б.Г. Кукутэ (1976; 1979) отмечают, что пролиферирующие миомы в два раза чаще встречаются у больных с быстрорастущими опухолями, чем при умеренном или медленном темпе роста опухоли. Авторы считают, что выделение двух форм миомы матки по особенностям гистогенеза имеет важное практическое значение, особеннопри выборе врачебной тактики.
Г.А. Савицкий соавт. (1987) полагают, что увеличение массы миомы матки за счет митотического деления — процесс, встречающийся достаточно редко, поскольку
даже в самых “подозрительных” пролиферирующих миомах митотический индекс не превышает 3%.
С целью объективной оценки темпов роста миомы, обусловленных процессом пролиферации гладкомышечных клеток, Г.А. Савицкий и соавт. (1994) провели анализ синтеза ДНК методами авторадиографии и цитофотометрии метода. Проведенные
исследования позволили сделать следующее заключение: гипертрофия миоцитов
миомы является одним из основных процессов, влияющих на скорость увеличения массы опухоли.Несмотря на то, что миоматозные клетки проявляют сходство с клетками миометрия, современные исследования выявили отличия в структуре и метаболизме этих тканей .На основе исследования ультраструктуры миомы матки Г.И.
Брехманом, А.А. Мироновым (1986) была предложена следующая трактовка процессов, происходящих в миоматозной матке: сначала
расстройства микроциркуляции и нарастание тканевой гипоксии обусловливают компенсаторные изменения в гладкомышечных клетках (увеличение гладкой цитоплазматической сети, возрастание числа митохондрий, их набухание идр.), затем наступает декомпенсация (ишемические зоны в митохондриях, липидное перерождение, слипание миофибрилл, вакуолизация ядра,
диффузный отек); в последующем развивается отек и начинается разрушение клеток. Дистрофические изменения в опухоли рассматриваются авторами не как осложнения в процессе развития последней, а как звенья единого процесса. Помимо этого имеются данные, что дистрофические изменения в ткани опухоли нарастают из-за денервации миоматозных узлов, в которых не обнаруживаются холин- и адренергические нервные структуры. Недавние исследования молекулярной биологии гладкомышечных клеток опухолей матки сиспользованием технологии анализа ДНК подтвердили их моноклональность .
Патогенез миомы матки остается спорным и вызывает много вопросов. Существующие теории развития заболевания опираются на результаты лабораторных исследований и объясняют в той
или иной степени некоторые звенья патогенеза данной патологии.
Л. Н. Василевская (1980) выделяет три патогенетических варианта развития миомы матки: с вовлечением в патологический процесс гипоталамо-гипофизарной системы, с выраженными нарушениями функции яичников и преимущественными изменениями функции матки. У больных отмечается гиперсекреция ФСГ на 5–7-й день менструального цикла и ЛГ на 14-й день с одновременным снижением экскреции ЛТГ на 21–22-й день цикла, эстрогенов и прегнандиола — на протяжении всего менструального цикла. Участие в патологическом процессе гипоталамо-гипофизарной системы подтверждается частым сочетанием миомы матки с дисгормональными заболеваниями молочных желез и нарушением функции щитовидной железы. Определенную роль играют изменения функции
печени, железодефицитная анемияи др. факторы.
В развитии миомы матки исключительное значение придается генетическим факторам (предполагается аутосомно-рецессивный тип наследования).
Различия в характере мутаций доброкачественных миом и лейомиосарком позволяют предположить, что развитие узла изначально идет по одному из двух гистологических путей, и этот принцип можно применить для ранней диагностики и прогнозирования роста опухоли.
Одно из центральных мест в проблеме патогенеза миомы матки занимает вопрос об особенностях гормонального статуса и функциональном состоянии репродуктивной системы по мере развития заболевания. Проведенные исследования показали, что
у 2/3 больных гормональные параметры менструального
цикла не отличаются от соответствующих нормативных показателей. У больных с недостаточностью лютеиновой фазы (НФЛ) и с ановуляторными циклами отмечаются изменения в содержании в крови ФСГ и ЛГ, зависящие в большей степени от функционального состояния репродуктивной системы, чем от наличия опухолиматки.
R. Maheux et al. (1988), M.N. Neuman et al. (1991), Y. Watanabe et al. (1992) сообщают, что назначение агонистов гонадолиберина (декапептид, образующийся в ядрах медиального гипоталамуса) приводит к существенному снижению уровней эстрогенов и прогестерона и уменьшению размеров миомы матки. Принято
считать, что этот эффект обусловлен влиянием агонистов
гонадолиберина на клетки-гонадотрофы аденогипофиза, секретирующие ФСГ и ЛГ. Однако в последние годы получены данные, в значительной мере дополняющие эту точку зрения. В своих исследованиях M. Marinaccio et al. (1994), обнаружили вткани миоматозных узлов и нормального миометрия специфические точки
связывания гонадолиберина, что указывает, по мнению авторов, на возможность прямого действия гонадолиберина и его агонистовна ткань миомы и миометрия.
Предполагается, что соматотропин (гормон роста) также может играть роль инициатора развития миомы матки. Это подтверждается тем, что у женщин с акромегалией чаще возникают миомы матки. Наличие мРНК-рецептора соматотропина в ткани миометрия и миомы подтверждает возможность действия соматотропина непосредственно на миометрий, а не через синтез в печени инсулиноподобного
фактора роста 1.
В последние годы появляется все больше исследований, посвященных пролактину. Исследуя особенности выделения пролактина при миоме матки, Е.М. Вихляева и соавт. (1997), Г.А. Паллади (1986) установили, что у больных моложе 40 лет содержание пролактина в плазме находится в пределах доверительного
интервала нормы здоровых женщин, а у больных старше 40
лет — в значительной мере превышает ее. Установлено, что клетки миомы матки также секретируют пролактин. Однако роль этого гормона в патогенезе миомы матки и его влияние на рост опухоли еще уточняются. По данным E.A. Stewart et al. (1996)блокатор прогестеронных рецепторов RU 486 подавляет синтез пролактина в миоматозных узлах и в нормальном миометрии. Авторы
полагают, что поскольку RU 486 вызывает торможение роста миоматозных узлов уопределенной группы больных, пролактин, наряду с прогестероном,
может быть одним из факторов роста миоматозных узлов.Традиционное мнение о ведущей роли эстрогенов в патогенезе миомы подтверждается данными современных исследований . Содержание рецепторов эстрадиола и прогестерона в ткани миомы выше, чем в неизмененном миометрии и подвержено циклическим изменениям. После длительного лечения (3 — 4 мес.) агонистами гонадолиберина (гипоталамический рилизинг-фактор) отмечается уменьшение объемов миоматозных узлов и значительное снижение содержания рецепторов эстрогенов в миометрии и тканях миомы, что подтверждает гипотезу о
роли эстрогенов в патогенезе миомы. Cодержание эстрогенов при
миоме матки изучалось многими исследователями, однако выводы, к которым онипришли, оказались противоречивыми. По мнению ряда
исследователей значение имеет не столько количество выделяемых эстрогенов, сколько нарушение их экскреции и метаболического превращения, а также нарушениекачественного соотношения между фракциями эстрогенов. Проведенные Г.А. Паллади и соавт.
(1986) исследования показали, что экскреция эстрогенов в суточной моче у больных миомой матки зависит от величины опухоли и характера менструального цикла. Приэтом авторы отмечают, что преобладающей фракцией эстрогенов является эстриол, эта особенность значительно выражена у больных с тенденцией к росту опухоли.
Авторы считают, что преобладание эстриола (E3) в сумме эстрогенов приводит к более выраженным изменениям миометрия, о чемсвидетельствует появление быстрорастущих миом без нарушения менструального цикла. При повышенном содержании эстрадиола(E2)
повреждается эндометрий и клиническая картина характеризуется небольшими размерами опухоли и кровотечениями.В то же время за последние годы накоплены данные, что прогестерон наряду с эстрогенами стимулирует рост миомы матки. Оба этих гормона принимают участие в патогенезе миом, используя противоположные пути. В течение фолликулярной фазы эстрогены усиливают экспрессию генов, которые в норме активны в миометрии при развитии беременности. По данным Г.А. Савицкого и соавт. (1994) увеличение массы миометрия может происходить как за счет гиперплазии гладкомышечных клеток, которая инициируется
эстрогенами, так и за счет гипертрофии этих клеток. Однако процесс гипертрофии ГМК, аналогичный процессу их гипертрофии во время беременности, может возникать только при сочетанном воздействии сравнительно высоких концентраций эстрадиола и
прогестерона
. В течение лютеиновой фазы прогестерон повышает митотическую активность миомы, особенно у молодых женщин. Кроме того, по мнению J. Аndersen (1996), прогестерон может воздействовать путем индуцирования продукции факторов роста и их рецепторов. По данным S. Lamminen et al. (1992)миомы наиболее активно
пролиферируют в секреторную фазу менструального цикла. При этом индекс митотической активности в клетках пременопаузальных миом значительно выше, чем в постменопаузе. Японские ученые S. Casterday, D. Grimes, J. Ridds (1983), изучив влияние эстрадиола и прогестерона на ткань миомы сделаливывод, что прогестерон участвует в процессе дифференцировки гладкомышечной клетки миомы.
Ткань миомы содержит значительно больше рецепторов к эстрадиолу и прогестерону, чем нормальная ткань матки. Это указывает на этиопатогенетическую роль прогестерона в развитии миомы матки и подтверждается высоким митотическим индексом в клетках ткани миомы в лютеиновую фазу. По данным O. Sadan et al. (1988) содержание эстрогенных рецепторов в миоме и нормальном миометрии не имеет существенных отличий, но содержание прогестеронных рецепторов в миоме выше, чем в обычном миометрии. На основании проведенных исследований обнаружено, что все ткани матки
у женщин, страдающих миомой матки, реагируют на колебания уровня половых гормонов изменением концентрации своих
рецепторов; эстрадиол индуцирует образование сначала своих рецепторов, а подъем уровня прогестерона в крови приводит к снижению и эстрогенных и прогестеронных рецепторов. Отмечено, что величина индукции рецепторов в миометрии значительно меньше, чем в эндометрии. Авторы полагают, что это связано с тем, что эндометрий гораздо сильнее, чем миометрий, реагирует на гормональные влияния изменением своей массы. По особенностям концентрации рецепторов эстрадиола и прогестерона и их реакции на изменение гормональной стимуляции в течение цикла миома значительно ближе к эндометрию, чем к миометрию. Это, возможно, обусловливает ее большую, чем у миометрия, потенцию роста приодинаковом уровне гормонемии.
Присутствие эпидермального фактора роста (EFG), инсулиноподобного фактора роста-1 (IFG-1) и фактора роста тромбоцитов (PDGF AB) обнаруживается в тканях миомы вместе с их рецепторами. Повышенное содержание факторов роста и их рецепторов в миоматозной матке, регулирующих процессы васкуляризации, приводит к возникновению патологических кровотечений. Предположительно основную роль в этом процессе играют фактор роста фибробластов, сосудистый эндотелиальный фактор роста, трансформирующий бета-фактор роста, паратиреоидный гормоноподобный протеин и пролактин. Существующие схемы лечения женщин с кровотечениями, связанными с миомой, основываются главным образом на применении стероидных гормонов. По
мнению М. Piva, О. Flieger, V. Rider (1996) факторы роста проявляют наивысшую пролиферативную активность в присутствии прогестерона. Углубленное понимание
патогенеза данного патологического процесса, позволяет повысить эффективность лечения, направленного на коррекцию содержания факторов роста в ткани опухоли. Патологическим стимулом, способным нарушить баланс факторов роста, может быть очаг эндометриоза в миометрии, вокруг которого, особенно при очаговой и узловой форме, всегда выявляется гиперплазия мышечной ткани и довольно часто развиваетсямиома матки.
По мнению А.Л. Тихомирова (1998) результаты морфологических и иммуногистохимических исследований тканей матки свидетельствуют, что формирование “зон роста” миомы происходит вокруг воспалительных инфильтратов и
эндометриоидных эксплантатов в миометрии
.Многочисленные исследования указывают на изменения иммунного статуса женщин с миомой матки. Они касаются дифференцировки иммунокомпетентных клеток, синтеза интерлейкинов, интерферонов,
активности системы комплемента и др. Активность гуморального и клеточного иммунитета снижена
при быстром росте миомы, сопутствующих хронических инфекционных заболеваниях придатков матки, гиперпластических процессах в эндометрии, анемии и другой экстрагенитальной патологии. По данным H.Y. Huang et al. (1990) наблюдается достоверная отрицательная корреляционная связь между уровнем эстрадиола в сыворотке крови и активностью Т-киллеров. На основании этого, авторпредполагает, что снижение активности клеточного иммунитета может играть
определенную роль в патогенезе миомы матки.Приводимая в публикациях частота сочетания миомы матки и гиперпластических изменений эндометрия колеблется от 30,1% до 58%. По данным Е.М. Вихляевой, Г.А. Паллади (1982) миома матки сочетается с железистой гиперплазией эндометрия у 25% больных, с атипической гиперплазией — у 10,7%, раком эндометрия — у 7% больных. Однако, по мнению Б.И. Железнова (1980), Д.В. Якубович и Н.И. Кондрикова (1980), гиперплазия эндометрия, относящаяся к числу наиболее распространенных патологических процессов матки, не может не сочетаться с миомой матки в том или ином проценте наблюдений. В соответствии с представленными данными возникает вопрос о том, следует считать сочетанную патологию эндо- и
миометрия случайным совпадением различных процессов, либо
рассматривать их единым состоянием репродуктивной системы, проявляющимся гиперпластическими изменениями гормонально-зависимых органов. Согласно мнению ученых, изучающих гиперпластические процессы гормонально-зависимых органов репродуктивной системы, однотипность преморбидного фона у пациенток с различными сочетаниями доброкачественных заболеваний эндо- и миометрия предполагает сходство патогенетических механизмов их развития. По мнению Е.В. Уваровой (1989) этим, вероятно, можно объяснить нередкое последовательное выявление указанных патологических состояний в течение жизни женщины. Приведенные в исследованиях Е.В. Уваровой (1989) доказательства системности поражения при сочетанных гиперпластических заболеваниях эндо- и миометрия могут быть дополнены данными литературы, свидетельствующими о выраженных изменениях гуморального и клеточного звеньев иммунитета у подобных больных. Оценивая состояние эндометрия у больных миомой матки, следует рассматривать комплекс факторов, способных приводить к патологическим изменениям. Последние отчасти связаны с формой и ростом опухоли, а в основном обусловлены возрастными и индивидуальными (преморбидными) особенностямиорганизма, включая эндокринный статус. Частота возникновения гиперпластических процессов в слизистой матки зависит от длительности
существования опухоли
.Фундаментальные исследования группы ученых под руководством Г.А. Савицкого, итогом которых явилось издание монографии “Миома матки. Патогенетические и
терапевтические аспекты” (1994), показали, что решающим фактором, индуцирующим развитие гиперпластических процессов эндометрия и миомы матки, является локальная гиперэстрадиолемия, несбалансированная локальной
гиперпрогестеронемией.
По мнению авторов, миома матки в условии естественной ановуляции является фактором риска ускоренного развитиягиперпластических процессов эндометрия
. Вместе с тем, данные ряда исследований, выполненных в онкогинекологических клиниках, свидетельствуют, что в климактерическом и постменопаузальном периодах жизни женщины наличие миомыматки расценивается как фактор высокого риска малигнизации эндометрия.
Таким образом, современные исследования существенно расширяют наши представления о факторах риска и механизмах развития миомы матки. Комплексный подход в изучении миомы матки позволяет получить новые данные о распространенности и причинах данного
заболевания.
Лечение:
Лечение миомы — консервативное и оперативное. По мнению C. R. Garsia et al. (1997), большинству пациенток хирургическое лечение не показано и «все, что нужно — это наблюдение до наступления менопаузы». Тогда рост опухоли
прекращается и нередко наблюдается ее обратное развитие. Г. А. Савицкий (2000) считает, что «во многих странах миома матки стала
основой коммерциализации гинекологических учреждений именно вследствиенеобычайной либерализации показаний для удаления детородного органа».
Поэтому весьма важно четко определить показания к оперативному лечению, которое может быть как консервативным (миомэктомия), так и радикальным (гистерэктомия,
син. экстирпация матки). Согласно рекомендациям
Американского общества акушеров-гинекологов, показания к консервативной миомэктомии имеются у пациенток, имеющих бесплодие или повторное невынашивание беременности. Такие миомы должны быть достаточно большими или иметь характерную локализацию, что потенциально может привести к описанным проблемам. Также должны отсутствовать более вероятные причины бесплодия и невынашивания. Перед выполнением данной операции необходимо исключить прочие причины бесплодия и невынашивания (проводится исследование полости матки и маточных труб, например, гистеросальпингография). Также следует объяснить пациентке (и оформить это документально!), что в случае распространенности патологического процесса иневозможности удаления узлов может возникнуть необходимость в гистерэктомии. В практической деятельности миомэктомии отдают предпочтение, если пациентка
хочет сохранить репродуктивную функцию или «просто иметь матку».
Большинство авторов считают миомэктомию более щадящей операцией, поскольку она предусматривает сохранение матки. Однако иногда при хаотическом расположении множественных узлов целесообразность сохранения органа весьма сомнительна. Кроме того, некоторые авторы считают, что миомэктомия сравнительно с гистерэктомией сопровождается большей кровопотерей и во время нее чаще возникает необходимость в гемотрансфузии (что, естественно, увеличивает общий риск вмешательства). После операции пациентки больше страдают от боли, дольше выздоравливают и требуют более продолжительной госпитализации. Хотя эти оценки в определенной мередискутабельны. До 25% женщин, перенесших консервативную операцию, особенно при множественных узлах, в дальнейшем нуждаются в гистерэктомии в связи с повторным ростом опухоли. Даже при наилучших условиях миомэктомия сопровождается риском развития рубцовых изменений матки и других органов малого таза, что может
вызвать бесплодие.
При беременности, которая наступает впоследствии, повышен риск разрыва матки. У этих пациенток родоразрешение целесообразно осуществлять путем кесарева сечения, а интервал от операции до наступления беременностидолжен быть не менее 6 месяцев
Критерии к гистерэктомии при миоме матки (согласно рекомендациям Американского общества акушеров — гинекологов) определяют, что эта операция показана при наличии, по крайней мере, одного из следующих условий:
- бессимптомные миомы больших размеров, которые пальпируются через живот и вызывают дискомфорт у пациентки;
- выраженные маточные кровотечения:
- профузное кровотечение, или выделение сгустков крови, или повторные затяжные менструации продолжительностью более 8 дней;
- анемия, обусловленная острой кровопотерей;
- дискомфорт в области малого таза, вызванный миоматозными узлами:
- острая выраженная боль;
- сопровождается постоянным ощущением давления внизу живота или в пояснице;
- сопровождается давлением на мочевой пузырь с частыми позывами на мочеиспускание, не связанными c инфекцией мочевых путей.
Данная операция противопоказана, если женщина стремится сохранить репродуктивную функцию (в таких случаях целесообразна миомэктомия), и не
рекомендуется при бессимптомных миомах размерами менее 12 недель беременности.
Резюмируя изложенное, следует согласиться с мнением большинства авторов, что при наличии безусловных показаний к оперативному лечению миомы его следует осуществлять, не тратя время и средства на консервативное лечение, которое либо вовсе не поможет, либо даст временное улучшение. Если же в этой ситуации больная отказывается от операции, медикаментозная терапия
становится вынужденной альтернативой операции. Когда отсутствуют показания к оперативному лечению, ведущее значение приобретает консервативная терапия, целью
которой является торможение роста опухоли.
Согласно рекомендациям К. М. Малевича и П. С. Русакевича (1994), задачами лечения является: 1.восстановление нарушенных соотношений в гипоталамо-гипофизарной системе, 2.устранение (уменьшение) сопутствующего воспалительного процесса (Обязательно у всех пациенток необходимо брать мазок на выявление хламидий, микоплазм, уреаплазм и др. в связи с определенной ролью генитальной инфекции в патогенезе миомы матки), 3.нормализация функции яичников, 4.улучшение состояния миометрия.
Консервативное лечение приемлемо и достаточно эффективно в любом возрасте до наступления менопаузы, но особенно в репродуктивном периоде. Оно должно быть комплексным и направленным на различные звенья патологического процесса с учетом
выявленных нарушений.
На всех этапах наблюдения и лечения больных с миомой матки необходимо соблюдение максимальной онкологической настороженности.Показания к консервативному лечению миомы матки
- Клинически малосимптомное и бессимптомное течение заболевания.
- Расстройства менструального цикла типа менометроррагий, не приводящие к анемизации женщины.
- Миома матки в сочетании с тяжелой экстрагенитальной патологией, являющейся противопоказанием к хирургическому лечению.
- Сочетание миомы матки с хроническим воспалительным процессом внутренних гениталий, клетчатки малого таза при условии отсутствия гнойно-воспалительных образований, частых обострений и прогрессирующего
течения воспаления.
- Сочетание миомы матки с аденомиозом, эктоцервикальным эндометриозом шейки матки.
- Особенности локализации опухоли и клинического течения:
а) интерстициальные, межмышечные и субсерозные миоматозные узлы на широком основании независимо от их величины;
б) множественная узловатая миома матки, по величине не превышающая 12–13 нед. беременности;
в) интерстициальные миоматозные узлы, пролаббирующие в полость матки, или субмукозные — на широком основании, не приводящие к анемизации больной;
г) одиночные субсерозные узлы на ножке без перекрута и нарушения питания в молодом возрасте, при нежелании подвергнуться операции.
- Консервативное лечение как предварительный этап подготовки к предстоящей консервативной миомэктомии или как этап
восстановительного лечения после удаления миомы матки.
Для консервативного лечения применяются медикаментозные препараты различных фармакологических групп:
- антианемические препараты (препараты железа);
- седативные препараты (растительные транквилизаторы валериана, новопассит, персен, малые нейролептики феназепам, френолон,
комбинированные препараты белласпон, беллатаминал);
- адаптогены и иммунокорректоры (экстракт элеутерококка, эхинацеи, метилурацил, продигиозан, декарис и др.);
- ингибиторы простагландинсинтетазы (НПВС) — например, индометацин по 25 мг 2 раза в день после еды во 2 фазу менструального цикла
курсами по 2 месяца с интервалами 6 месяцев);
- витамины (А, С, Е, комбинированные поливитаминные препараты с микроэлементами, особенно с медью, цинком, йодом;
- препараты йода (внутрь и в виде электрофореза 1–2% раствора калия йодида);
- антибактериальная терапия по строгим показаниям — в период обострения воспалительного процесса;
- диета, фитотерапия, немедикаментозные методы лечения (аппаратная физиотерапия,
бальнеотерапия, ЛФК и др.).
Одним из основных патогенетических методов консервативного лечения миомы матки является гормональная терапия.
Некоторое время назад предлагалось применение различных сочетаний андрогенов (тестостерона пропионат, метилтестостерон), гестагенов (прогестерон, прегнин) и тономоторных (питуитрин, гифотоцин, маммофизин) препаратов. В последнее время использование андрогенов значительно ограничено в силу частого возникновения выраженных побочных действий (вирильный синдром, аменорея, огрубение голоса и
др.).
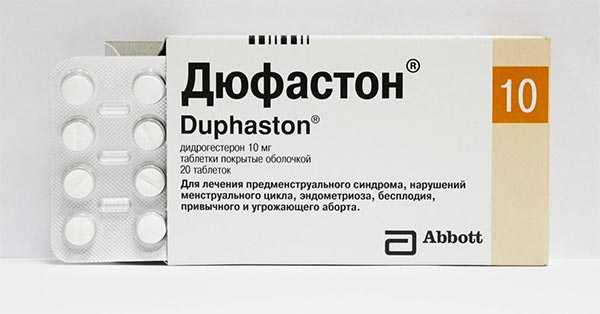
Значительно более эффективно применение комбинированных эстроген — гестагенных препаратов (КОК) по контрацептивной схеме кратковременными (по 3–4) месяца курсами или «чистых гестагенов» (норколут, примолют-нор, оргаметрил, дуфастон, утрожестан и др.). Отмечается уменьшение менструальной кровопотери, улучшение общего состояния, торможение роста и уменьшение размеров опухоли, нормализация водно-солевого обмена.
При сохраненном менструальном цикле гестагены назначаются в дозе 5–10 мг/сут с 16-го по 25-й день цикла в течение
4–6 мес., в пременопаузе — в той же дозе в непрерывном режиме в течение 3 мес. Выраженным гестагенным эффектом обладает ОПК (17-оксипрогестерона капронат 12,5% масляный раствор), который назначают по 1–2 мл внутримышечно на 16–21-й или на 14–17–21-й дни менструального цикла в течение 4–6 мес. В пременопаузальном периоде ОПК применяется с целью прекращения менструальной функции и назначается по 125 мг (1 мл 12,5% раствора) на 5–14–17–21 дни менструального цикла. Медроксипрогестерона ацетат (МПА), выпускаемый в виде препаратов провера и депо-провера (депонированная форма), подавляет секрецию гонадотропинов, блокирует эстрогенные рецепторы матки, вызывает состояние выраженной гипоэстрогении, что приводит к атрофическим и псевдодецидуальным изменениям в эндометрии. МПА назначают в циклическом или непрерывном режиме в течение 3–9мес.
При сочетании миомы матки с эндометриозом предпочтительнее назначение даназола, обладающего выраженным антигонадотропным эффектом без эстрогенных и гестагенных свойств. Механизм его действия связан с торможением секреции ФСГ и ЛГ из гипофиза по типу отрицательной обратной связи. Эффективные лечебные дозы —200–800 мг/сут.; продолжительность приема обычно 6 мес., иногда
до 9–12 мес.
Сходное с даназолом по клиническому эффекту действие оказывает гестринон — производное 19 норстероидов. Назначается в дозе 2,5–5 мг два раза в неделю. Морфологический эффект проявляется выраженными инволютивными
изменениями железистого эпителия.
Препарат RU-486 (мифепристон — антагонист прогестерона) также может уменьшить размеры миоматозных узлов путем снижения концентрации прогестерона. В частности, в одном из исследований при суточной
дозе мифепристона 25 мг объем миом уменьшался на 50%.
В последнее время много внимания уделяется изучению аналогов гонадолиберина, вызывающих состояние «обратимого гипогонадизма». Непрерывное введение аналогов ГнРГ, синтезированных искусственным путем, вызывает глубокую блокаду секреции гонадотропинов. Наиболее изученными являются
препараты трипторелин (декапептил) и гозерелин
(золадекс), которые вводятся парентерально один раз в 28 дней в течение 3–12 мес. Лечение агонистами ГнРГ приводит к существенному уменьшению объема матки (в среднем на 53%) с исчезновением патологической симптоматики. Однако это лечение является весьма дорогостоящим и имеет временный эффект, в связи с чем рекомендуется в качестве предоперационной подготовки и при противопоказаниях к хирургическому лечению. Следует учитывать и наличие достаточно выраженных побочных эффектов, которые напоминают симптомы перименопаузы: приливы жара, головная боль, сухость влагалища, диспареуния (болезненность при половом акте), утомляемость, бессонница. Также имеет значение тот факт, что лишение организма женщины воздействия эстрогенов на 3–6 мес., в большинстве случаев вызываетрезорбцию костной ткани.
Таким образом, очевидной является необходимость сугубо индивидуального подхода к выбору метода лечения каждой больной. Совершенно недопустимо
противопоставление консервативного и хирургического методов.
medinfa.ru
Лекция 20 Миома матки.
План
Актуальность проблемы
Современные представления о патогенезе миомы матки
Патоморфологические аспекты миомы матки
Клинические проявления миомы матки
Особенности течения миомы матки при беременности
Диагностика миомы матки
Показания к хирургическому лечению больных миомой матки
Консервативное ведение больных миомой матки
Объем оперативного вмешательства при миоме матки
«Я … твердо уверен в том, что пути решения проблем,
связанных с миомой матки, проходят не только
через операционный зал. Нож хирурга, очень часто
не вполне разрешая существующие проблемы,
нередко создает новые, подчас не менее серьезные…»
Г.А. Савицкий
Миома матки – явление исключительное, если не уникальное (Савицкий Г.А., 1994). Основная причина, заставляющая хирургов-гинекологов проводить радикальные операции на матке в репродуктивном возрасте, она до сих пор изучена недостаточно.
Миома матки – доброкачественная, иммуно- и гормонально-зависимая опухоль, относится к стромальным опухолям, которые образуются в результате гипертрофии и пролиферации элементов соединительной и мышечной ткани.
В настоящее время существует несколько определений миомы матки, но все авторы единодушны в одном. По Н.Д. Селезневой (1990) миома матки – доброкачественная опухоль из мышечных и соединительнотканных элементов. В случае преобладания в опухоли мышечных элементов пользуются термином «миома» матки, при превалировании соединительнотканной стромы – «фиброма», а при одинаковом содержании обеих тканей – «фибромиома». Наиболее распространен термин «миома» матки.
И.С. Сидорова (1985), считает, что миоматозные узлы представляют собой очаговую доброкачественную гиперплазию миометрия, развивающуюся из тех же элементов мезенхимы сосудистой стенки, которые подвергаются физиологической гиперплазии во время беременности.
Большинство авторов считают целесообразным использовать термины «миома» и «лейомиома». Таким образом, лейомиома или миома матки – доброкачественная опухоль, состоящая из гладкомышечных клеток и соединительнотканных элементов, является одним из самых частых гинекологических заболеваний и самой частой причиной различных операций на матке. В последние десятилетия отмечается увеличение частоты встречаемости данной патологии у молодых женщин (Кулаков В.И. с соавт., 1999; Вихляева Е.Н., Селезнева Н.Д., Марфунин Д.Л.).
Миома матки – моноклональный гормоночувствительный пролиферат, состоящий из из фенотипически измененных гладкомышечных клеток миометрия. (В.И. Кулаков, 2007).
Термины: лейомиома, фиброма, фибромиома – синонимы.
Частота миомы матки клинически по данным разных авторов колеблется от 30% до 35%. По данным аутопсий частота до 80%. В последние десятилетия отмечается увеличение частоты встречаемости данной патологии у молодых женщин.
Этиология и патогенез миомы матки
Теории происхождения клетки-предшественника миомы матки.
1. Появление дефекта клетки во время онтогенетического развития матки вследствие нестабильного периода эмбриональных гладкомышечных клеток.
2. Повреждение клетки в зрелой матке.
Формирование зачатка роста миоматозного узла происходит из мезенхимы сосудистой стенки, в ходе многократно повторяющихся циклов гиперплазии миометрия. Во время менструальных циклов происходит накопление гладкомышечных клеток, в которых нарушается процесс апоптоза, и эти пролиферирующие клетки подвергаются воздействию повреждающих факторов: ишемия, обусловленная спазмом спиральных артерий во время менструации, воспалительный процесс, травматическое воздействие при медицинских манипуляциях или очаг эндометриоза.
Количество поврежденных клеток накапливается, формируется активный зачаток роста. В формировании локальных автономных механизмов поддержания роста миомы матки, ведущее значение имеют дисгормональные процессы, приводящие к развитию относительной гиперэстрогении и гипоксия ткани миометрия.
С увеличением размеров опухоли формирование аутокринно-паракринной регуляции роста и становление локальных механизмов делают рост миомы матки независимым. Это связано с нарастанием в структуре узла доли соединительной ткани и за счет локального синтеза эстрогенов из андрогенов.
Существенную роль в запуске и развитии этих процессов имеют психосоматические нарушения и наследственная предрасположенность.
Пролиферативная активность клеток миомы матки обусловлена дисрегуляцией генов HMGIC и HMGIY, расположенных в хромосомах 12 и 6 соответственно.
Аберрантная экспрессия HMGIC и HMGIY белков характеризует злокачественный процесс, а дисрегуляция этих белков выявляется в различных доброкачественных мезенхимальных образованиях.
Моноклональный пролиферат гладкомышечных клеток миометрия, в котором за счет дисрегуляции генов HMG активизирована программа клональной пролиферации ткани. Увеличение в размерах происходит на фоне нормального гормонального фона, в то время как клетки неизмененного миометрия находятся в состоянии относительного покоя.
Зачатки роста миомы матки образуются из мезенхимы сосудистой стенки, происходит перерождение мезенхимы стенки сосуда с образованием активной зоны. В этих зонах роста нарушается метаболизм, и дальнейший рост обусловлен дисгормональными нарушениями, приводящими к развитию относительной гиперэстрогении и гипоксии ткани миометрия. При этом существенную роль в запуске и развитии этих процессов имеют психосоматические нарушения и наследственная предрасположенность.
studfiles.net