Саркома яичников
Саркома яичника: что это, диагностика, лечение
Саркома яичника — это разновидность злокачественных опухолей, диагностика которых существенно затруднена. Встречается у 2-4% пациенток.
Диагностирование патологии
Саркома яичника очень редко выявляется в дооперационный период, потому как определение при помощи маркеров неэффективно и не дает конкретных данных. Цитологические исследования же в большей части случаев показывают наличие значительного количества патологических эпителиальных клеток и поэтому лечение для таких больных назначается аналогичное, как при эпителиальных раковых заболеваниях.
Возникает из соединительных тканей. При гистологических исследованиях выявляют эпителиальные, стромальные и саркоматозные компоненты патологического характера. Определение саркомы усложнено тем фактом, что метастазирование осуществляется преимущественно за счет эпителиальных компонентов, в то время как саркоматозный может иметь незначительные включения или же отсутствовать вовсе.
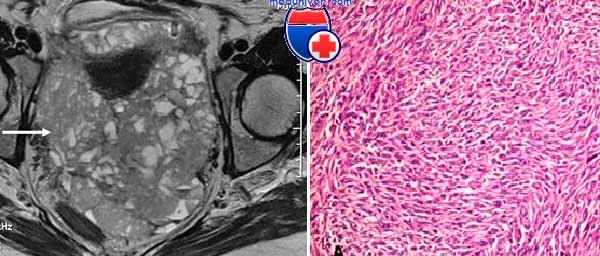
Саркома. Фото взято с медпортала meduniver.com
Симптоматика и лечение
Саркома яичников опасна тем, что имеет незначительные симптомы и очень быстрое развитие. Чаще всего бывает односторонней и достигает достаточно больших размеров, но иногда может переходить и в двустороннюю форму.
Опухоль имеет высокую степень злокачественности и активно метастазирует, поражая соседние органы. Новообразование имеет мягкую консистенцию, и чем оно мягче, тем хуже прогноз, потому что в таком случае очаги метастазов возникают очень быстро и развиваются в позвоночном столбу, легких и других органах из-за распространения патологических клеток по кровотоку.
Лечение осуществляется посредством хирургического вмешательства, при котором удаляют полностью матку и придатки, независимо от возрастной категории пациентки. После операции назначают лучевую или химиотерапию. Чаще всего применяются такие виды оперативного вмешательства:
- Гистерэктомия.
- Сальпингооварэктомия.
- Оментэктомия.
Выбор метода хирургического вмешательства зависит от стадии заболевания, наличия метастаз, хронических заболеваний и возраста пациентки.
oyaichnikah.ru
Саркома яичников
ссылки Саркома яичников, новообразование из соединительнотканных элементов, характеризуется быстрым ростом, составляет до 10% всех бластом. Опухоль чаше бывает односторонней, обычно имеет неровную поверхность, по консистенции значительно мягче фибромиомы, склонна к распаду и кровоизлияниям. Макроскопически саркома яичника отличается от доброкачественных опухолей (фибромы) мягкой консистенцией. На разрезе опухоль имеет мозговидный характер, беловатый цвет, признаки некроза и кровоизлияний, различной величины полости и очаги размягчения. Гистологически различают формы опухоли: веретеноклеточную, круглоклеточную, мелкоклеточную и полиморфноклеточную. Особенно злокачественно протекает круглоклеточная саркома. По злокачественности течения саркома ничем не уступает раку. Клиника заболевания вначале напоминает клинику рака яичника. В дальнейшем саркома яичника характеризуется быстрым ростом, появлением асцита и метастазов. Диагноз саркомы яичника, как правило, устанавливается на операционном столе или при гистологическом исследовании удаленной опухоли. Прогноз определяется гистологической структурой опухоли. Чем мягче консистенция опухоли, тем хуже прогноз (быстрое метастазирование). Опухоль очень быстро по кровеносным путям дает отдаленные метастазы в позвоночный столб, легкие, мозг и другие органы. Лечение хирургическое - экстирпация матки с придатками с последующей химио- или лучевой терапией. Онкогинекологи в Москвеvse-zabolevaniya.ru
Саркома матки
Саркома матки – злокачественное новообразование тела или шейки матки, исходящее из недифференцированных соединительнотканных элементов миометрия или стромы эндометрия. Саркома матки проявляется циклическими и ациклическими кровотечениями, болями в животе, упорными белями с гнилостным запахом, общим недомоганием. Саркома матки диагностируется с помощью бимануального исследования, гистероскопии, УЗИ, диагностического выскабливания, цитологии и гистологии биоптатов, лапароскопии. При саркоме матки производится расширенная пангистерэктомия, комбинированная с лучевой и химиотерапией.
В структуре злокачественных новообразований матки саркома составляет от 3 до 5-7% случаев. Саркома матки нередко сочетается с саркомой влагалища, а также может развиваться в узле имеющейся фибромы матки. Саркома матки встречается у женщин любого возраста (чаще в пре- и постменопаузе), однако наблюдается даже у девочек, являясь следствием дисэмбриогенеза. По локализации в 10 раз чаще диагностируется саркома тела матки, чем ее шейки. По своему течению саркома матки чрезвычайно злокачественна.
Причины развития саркомы матки
Вопросы эпиопатогенеза саркомы матки малоизученны. Предполагается, что в развитии саркоматозной опухоли решающую роль играют полиэтиологические факторы, в т. ч. дисэмбриоплазии и рецидивирующие травмы, приводящие к пролиферации регенерирующих тканей.
Саркоме матки обычно предшествуют некоторые патологические состояния. Наиболее часто (51-57%) опухолевая дисплазия происходит в очаговых узловых образованиях – фибромиомах матки. В числе факторов риска гинекология также выделяет нарушения эмбриогенеза, родовые травмы, повреждения матки при хирургическом прерывании беременности и диагностическом выскабливании, патологию матки с пролиферативными изменениями (эндометриоз, полипы эндометрия) и др.
Существенное значение в этиопатогенезе саркомы матки отводится хроническим интоксикациям (в т.ч., никотиновым, алкогольным, лекарственным), профессиональным вредностям, экологическому неблагополучию, облучению малого таза при раке шейки матки. Не исключается, что развитию саркомы матки способствует ановуляция и гиперэстрогения, а также нейроэндокринные нарушения, возникающие в период климакса.
Опухолевая дисплазия при саркоме чаще возникает в гладких мышцах матки (лейомиосаркома), интерстициальной соединительной ткани (стромальная саркома эндометрия) и других морфологических структурах. Саркомы миометрия обычно являются образованиями округлой формы, плохо отграниченными от окружающих тканей. На разрезе саркоматозные узлы имеют белесый, серовато-розоватый цвет, мягкую крошащуюся консистенцию, иногда – вид вареного мяса или мозговидной ткани. При некрозах и кровоизлияниях в ткань опухоли саркома матки приобретает пеструю окраску. Саркомы эндометрия чаще представлены ограниченными (узловатыми, полипозными) разрастаниями, реже – имеют диффузный характер.
По мере роста саркома матки инфильтрирует миометрий и даже может достигать периметрия и стенок смежных органов (мочевого пузыря, кишки). При инвазии околоматочной клетчатки может развиваться клиника параметрита. Саркома матки склонна к быстрому росту и ранней деструкции (распаду), что сопровождается формированием кистозных полостей. При метастазировании саркомы матки (гематогенном, лимфогенном) отсевы опухолевых клеток чаще определяются в легких (17%), печени (9%), ретроперитонеальных лимфоузлах (8%), яичниках (7%), позвоночнике и костях (5%).
Классификация саркомы матки
Основными морфологическими формами саркомы матки служат лейомиосаркомы, эндометриальные стромальные саркомы, смешанные мезодермальные опухоли, карциносаркомы и др. Саркомы, исходящие из миометрия встречаются в 47,2% случаев, из фиброматозных узлов – в 25,3%, из эндометрия – в 27,5%.
По клеточному составу выделяют фибробластический, веретеноклеточный, полиморфноклеточный, круглоклеточный, мышечноклеточный, гигантоклеточный, мелкоклеточный тип саркомы матки.
При оценке распространенности саркомы матки выделяют IV стадии:
I – распространение саркомы матки ограничено мышечным или/и слизистым слоем
- Iа – опухолевая инвазия затрагивает миометрий или эндометрий
- Ib – опухолевая инвазия затрагивает миометрий и эндометрий
II – локализация саркомы ограничена телом и шейкой матки и не выходит за их пределы
- IIа – имеется проксимальная или дистальная инфильтрация параметрия без перехода на стенки малого таза
- IIb - опухоль переходит на шейку матки
III – локализация саркомы за пределами матки, но в границах малого таза.
- IIIа – имеется одно- или двусторонняя инфильтрация параметрия с переходом на стенки малого таза
- IIIb – отмечается метастазирование опухоли в регионарные лимфоузлы, влагалище, придатки, прорастание крупных вен
- IIIс - определяется прорастание серозного покрова матки, образование конгломератов с соседними структурами без их поражения
IV - прорастанием саркомы матки в смежные органы и выход за пределы таза
- IVa – опухоль прорастает в мочевой пузырь, прямую кишку
- IVb – опухоль метастазирует в отдаленные органы
Симптомы саркомы матки
В ранних стадиях саркома матки является «немой» опухолью, дающей скудную симптоматику. При развитии саркомы матки в фиброматозных узлах проявления могут не отличаться от клиники фибромы матки (субсерозной, субмукозной, интерстициальной).
По мере прогрессирования саркомы матки, в зависимости от ее локализации, направления и темпа роста отмечаются нарушения менструального цикла (меноррагии, метроррагии), боли в области малого таза, обильные бели водянистого характера, которые при присоединении инфекции приобретают гнилостный запах. Симптоматика наиболее выражена при саркоме субмукозных узлов и эндометрия.
К поздним проявлениям саркомы матки относятся анемия, кахексия, слабость, интоксикация, асцит. При метастатизировании саркомы в легкие развивается плеврит; в печень – желтуха; в позвоночник – боли в том или ином отделе, а также другие проявления, характерные для пораженного органа.
В процессе диагностики саркому матки следует дифференцировать от доброкачественной фибромиомы. О саркоме матки следует думать при быстром росте фиброматозных узлов; ациклических кровотечениях; выраженной анемии, не соответствующей степени кровопотери; увеличении СОЭ; рецидиве симптоматики после удаления субмукозных узлов или полипов; выявлении опухолевых узлов в культе после надвлагалищной ампутации матки.
При осмотре влагалища обращает внимание цианотичная окраска шейки, ее отек, гипертрофия, иногда – обнаружение рождающегося саркоматозного узла. С помощью гинекологического исследования (бимануального, ректовагинального) устанавливается локализация саркомы матки, величина и консистенция узлов, их смещаемость, наличие инфильтратов в параметрии, увеличенных пристеночных лимфоузлов, состояние придатков.
По данным УЗИ-диагностики выявляется узловая трансформация матки, ее неоднородная эхогенность, некротизированные узлы, наличие патологического кровотока. При проведении аспирационной биопсии с цитологическим исследованием мазков-отпечатков в ряде случаев удается обнаружить наличие атипических полиморфных клеток. Более точную информацию получают при РДВ с последующим гистологическим исследованием соскоба эндометрия. В диагностическом отношении при саркоме матки информативны гистероскопия, гистероцервикография, лапароскопия, лимфография, ангиография.
Всем пациенткам с саркомой матки производится обследование мочевыводящих путей (экскреторная урография, хромоцистоскопия, ренография), кишечника (ректороманоскопия, ирригоскопия), легких (рентгенография грудной клетки), печени (УЗИ). Саркому матки в ходе диагностики дифференцируют от фибромиомы матки, опухолей яичников, полипов эндометрия, первичных опухолей смежной локализации.
Лечение саркомы матки
Наиболее эффективно при саркоме матки проведение комбинированного лечения. Радикальным вмешательством при саркоме матки является пангистерэктомия; в запущенных случаях - расширенная гистерэктомия - удаление матки, удаление придатков (аднексэктомия), регионарных лимфоузлов, инфильтратов параметрия и резекция смежных органов.
Хирургический этап дополняется лучевой терапией, направленной на девитализацию опухолевых клеток. Химиотерапия (доксорубицином, фторурацилом, циклофосфамидом, винкристином, дактиномицином) ввиду недостаточной эффективности применяется как паллиативный метод при иноперабельных процессах и рецидивах саркомы матки.
Прогноз и профилактика саркомы матки
Прогнозирование отдаленных результатов при саркоме матки неутешительно. В среднем пятилетняя выживаемость пациенток с саркомой матки составляет около 40%: при I ст.- 47%, при II ст. - 44%, при III ст. - 40%, при IV ст. - 10%. Относительно благоприятным течением характеризуются саркомы матки, развивающиеся из фиброматозных узлов (при условии отсутствия метастазов), худший прогноз отмечается при саркомах эндометрия.
Профилактика саркомы матки заключается в своевременном выявлении и коррекции нейроэндокринных нарушений, лечении эндометритов, фибромиом матки, эндометриоза, полипов эндометрия. К числу превентивных мер относятся подбор контрацепции, предупреждение абортов.
www.krasotaimedicina.ru
Саркомы яичников (обзор литературы)
Гинекология
Саркомы яичников: обзор литературы
С.А. Швачко1, А.Н. Грицай2, Н.И. Лазарева2, С.Б. Петерсон1, А.В. Василевская3
Кафедра онкологии ГОУ ВПО РГМУ Росздрава;
2ГУРОНЦ им. Н.Н. Блохина РАМН;
3кафедра онкологии Первого Московского государственного медицинского университета
Контакты: Сергей Александрович Швачко sashvachko@gmail.com
В обзоре освещены этиология, особенности клинического течения и современные подходы, применяемые в диагностике и лечении сарком яичников.
Ключевые слова: саркома яичников, карциносаркома, смешанная мюллеровская опухоль, аденосаркома, эндрометриальная стромальная саркома, недифференцированная саркома, фибросаркома
Ovarian sarcomas: a review of literature
S.A. Shvachko1, A.N. Gritsai2, N.I. Lazareva2, S.B. Peterson1, A.V. Vasilevskaya3
Department of Oncology, Russian State Medical University, Russian Agency for Health Care;
2N.N. Blokhin Russian Cancer Research Center, Russian Academy of Medical Sciences;
3Department of Oncology, I.M. Sechenov First Moscow State Medical University
The review describes the etiology and clinical features of ovarian sarcomas and current approaches applied to their diagnosis and treatment.
Key words: ovarian sarcoma, carcinosarcoma, mixed Mulllerian tumor, adenosarcoma, endometrial stromal sarcoma, undifferentiated sarcoma, fibrosarcoma
Первичные саркомы яичников (СЯ) — это редкие злокачественные опухоли. Несмотря на это, важную роль играют точная диагностика и дифференциальный диагноз с другими злокачественными новообразованиями яичников, так как прогноз при этой патологии неблагоприятный. Лечебная тактика при СЯ имеет ряд особенностей. В статье приводится обзор данных литературы, отражающих современные принципы диагностики и лечения больных с СЯ.
СЯ встречаются в основном у пациенток, находящихся в периоде постменопаузы (до 80% наблюдений), при этом средний возраст больных составляет 60 лет.
Злокачественные смешанные мюллеровские опухоли (ЗСМО) — наиболее часто встречающийся тип СЯ (рис. 1), отличающийся наличием как кар-циноматозного, так и стромального (саркоматозного) элементов опухоли (синонимы — карциносар-кома, злокачественная смешанная мезенхимальная опухоль, метапластическая карцинома) [1]. ЗСМО составляют всего 1—4% всех злокачественных новообразований яичников. Стромальный компонент может быть гомологичен мюллеровскому протоку и напоминать эндометриальную стромальную саркому (ЭСС) или, реже, фибро- (ФС) и лейомиосарко-
му. При другом гистологическом типе он может содержать гетерологические тканевые элементы, такие как жировая ткань, поперечно-полосатая мышца, хрящевая или костная ткань.
Рис. 1. ЗСМО. Низкодифференцированные железы окружены веретеновидными, округлыми и многоядерными клетками
В англоязычной литературе описано < 400 случаев ЗСМО яичников [2]. ЗСМО составляют < 1% всех злокачественных опухолей яичников. По наблюдению J. Chang и соавт. [3], средний возраст больных ЗСМО яичников составляет 65 (26—85) лет.
Частота заболеваемости ЗСМО яичников выше у женщин, подвергшихся лучевой терапии (ЛТ), проведенной на область малого таза.
ЗСМО яичников принято стадировать так же, как и рак яичников (РЯ), в соответствии с классификацией Международной ассоциации акушеров-гинекологов ^ЮО, 2009).
— Стадия I — процесс ограничен яичниками:
• ІА — опухоль ограничена одним яичником, асцита нет, опухоли на наружной поверхности нет, капсула интактна;
• ІВ — опухоль захватывает оба яичника, асцита нет, опухоли на наружной поверхности нет, капсула интактна;
• ІС — то же, что на стадиях ІА и ІВ, но с наличием опухоли на поверхности одного или обоих яичников, вовлечением капсулы, присутствием опухолевых клеток в асцитической жидкости.
— Стадия ІІ — опухоль захватывает один или оба яичника и распространяется на стенки таза:
• ІІА — опухоль распространяется на матку и (или) одну или обе трубы, но без вовлечения висцеральной брюшины, асцита нет;
• ІІВ — опухоль распространяется на другие ткани таза и (или) вовлекает висцеральную брюшину, асцита нет;
• ІІС — опухоль с распространением на матку и (или) одну или обе трубы и (или) другие ткани, имеется асцит, содержащий злокачественные клетки (или положительный перитонеальный смыв).
— Стадия ІІІ — опухоль захватывает один или оба яичника и распространяется на тонкую кишку или сальник; или имеются метастазы, выходящие за пределы малого таза; или поражены ретро-перитонеальные лимфатические узлы (ЛУ); или и то и другое.
— Стадия ГУ — распространение опухоли на отдаленные органы.
До 70% ЗСМО яичников диагностируют уже в запущенной стадии (ІІІ—ІУ стадия по классификации FIGO) [3].
Согласно последним данным этиология и патогенез ЗСМО яичников имеют сходство с таковыми карциносарком тела матки и соответствуют моноклональной теории гистогенеза [4]. ЗСМО развиваются из покровного эпителия яичников или из очагов эндометриоза, поэтому могут рассматриваться как высокодифференцированный РЯ с метаплази-рованным саркоматозным компонентом. Клинический ответ ЗСМО на проведение лекарственной терапии с включением препаратов платины, эффективной при РЯ, подтверждает эту точку зрения.
Клиническая картина ЗСМО яичников аналогична таковой при РЯ: наличие опухоли в брюшной полости, асцита и симптомов кишечной непроходимости. У больных ЗСМО яичников также отмечается повышение титра онкомаркера СА-125, что затрудняет дифференциальную диагностику. Несмотря на то что СА-125 не рекомендован в качестве маркера, позволяющего определить эффективность проводимой химиотерапии (ХТ) у пациенток с ЗСМО яичников, ряд исследователей (Е. Brown и соавт. [5]) полагают, что данный онкомаркер может служить таковым. В большинстве случаев диагноз устанавливают после проведения оперативного вмешательства.
Опухоль, как правило, представлена одно- или двусторонними опухолевыми массами (в 90% наблюдений) больших размеров (до 10—20 см в диаметре), чаще всего имеющих кистозно-солидную структуру, реже — являющихся солидным образованием. На разрезе опухоль имеет серо-коричневую окраску с очагами кровоизлияний и некроза. Диагноз ЗСМО может быть подтвержден результатами иммуногистохимического исследования [6].
ЗСМО яичников характеризуются крайне агрессивным течением. Для этого злокачественного новообразования характерно такое же распространение, как и для РЯ. К моменту постановки диагноза у 75% больных имеет место опухолевое поражение брюшины, сальника, органов малого таза и регионарных ЛУ, более чем в 50% случаев выявляются отдаленные метастазы. У пациенток с ЗСМО прогноз хуже, чем у больных РЯ, при одинаковой стадии по FIGO [7].
Из факторов прогноза наибольшее значение имеет стадия заболевания по FIGO. У пациенток с ранними стадиями заболевания отмечено преимущество в общей выживаемости по сравнению с больными, находящимися на более распространенных стадиях. Роль гистологического типа и остаточной опухоли как прогностических факторов неоднозначна, хотя во многих исследованиях возникло предположение, что большой объем остаточной опухоли коррелирует с меньшей продолжительностью общей выживаемости. По данным J.S. Berek и соавт. [7, 8], безреци-дивный период увеличивается при отсутствии остаточной опухоли после операции. Так, в их наблюдении продолжительность безрецидивного периода у 2 больных, получавших адъювантную ХТ с включением эпирубицина и цисплатина (6 курсов), превысила 3 года. По данным J. Chang и соавт. [3], такие характеристики ЗСМО яичников, как гомологическая или гетерологическая гистологическая структура опухоли, а также тип, выраженность и степень злокачественности эпителиального компонента, на прогноз не влияют. В некоторых исследованиях установле-
Гинекология
Гинекология
на связь гетерологической структуры опухоли с быстрым прогрессированием заболевания, а следовательно, и с худшим прогнозом. Часть авторов не придают значения этому фактору, поскольку гетерологи-ческий гистологический тип выявляется, как правило, при более запущенных стадиях заболевания и общая выживаемость одинакова для таких же стадий гомологических ЗСМО яичников. Медиана выживаемости больных ЗСМО после проведения комбинированного лечения (оптимальная циторедуктивная операция и XT препаратами платины) составляет 19 мес [9], 5-летняя выживаемость — 18—27% [10], большинство пациенток умирают в течение 2 лет.
Наибольшее значение в лечении данной патологии имеет хирургический метод. Доступные в литературе данные свидетельствуют о значительной роли максимальной циторедукции в улучшении прогноза больных ЗСМО яичников. T.L. Rutledge и соавт. [2] зафиксировано улучшение прогноза у больных ЗСМО яичников IIIC стадии по FIGO, подвергшихся выполнению оптимальной цито-редуктивной операции. Результаты, полученные Е. Brown и соавт. [5], подтверждают данное заключение: у пациенток с III стадией по FIGO, которым была проведена оптимальная циторедукция, отмечены более высокие показатели выживаемости (медиана выживаемости составила 14,8 мес по сравнению с 3,1 мес у больных, которым циторедуктивная операция была выполнена в субоптимальном или неоптимальном объеме, p < 0,001). Большинство авторов указывают на то, что выполнение оперативного вмешательства при ЗСМО связано с развитием большого числа осложнений [9]. ЗСМО яичников характеризуется склонностью к распаду и повышенной кровоточивостью, что обычно приводит к возникновению большей кровопотери во время операции. Xирургическая тактика при этой патологии аналогична таковой при РЯ [6].
Разработаны различные XT-режимы с широким диапазоном ответа на лечение. Данные всех опубликованных исследований приведены в таблице.
Для терапии СЯ, так же как и для лечения других мягкотканных сарком изначально применяли режим VAC (винкристин, актиномицин D, цикло-фосфамид). Частота получения ответа при использовании этого режима в сочетании с ЛT и без облучения малого таза составила около 42%, но при этом общая выживаемость в течение 1 года не превышала 33% [13]. В последующем были применены режимы с включением цисплатина. W. Anderson и со-авт. [14] наблюдали 10 пациенток, получавших лечение по схеме САР (циклофосфамид, доксоруби-цин, цисплатин), частота ответа на лечение у которых составила 67%, а медиана его продолжительности — 16 мес. В исследовании S.C. Plaxe и соавт. [15]
15 больным с III—IV стадией (FIGO) ЗСМО яичников была проведена ХТ с включением цисплатина и доксорубицина, при этом частота получения ответа на лечение составила 85%, однако медиана выживаемости не превысила 16 мес. В исследовании, состоявшемся в Christie Hospital (Манчестер) [16], при проведении 10 циклов ХТ циклофосфамидом (внутривенное введение в дозе 600 мг/м2 каждые 28 дней) 3 пациенткам в 2 случаях был зарегистрирован полный и в 1 — частичный эффект, продолжительность полного ответа составила 103 и 106 мес соответственно. Таким образом, проведение моно-ХТ цисплатином, а также использование режимов с включением цисплатина (цисплатин/доксоруби-цин и цисплатин/циклофосфамид) характеризовались лучшими результатами по сравнению с режимами без препаратов платины [7, 8]. T.R. Baker и соавт. [17] опубликовали результаты проспективного исследования, включившего 11 пациенток с III—IV стадией ЗСМО яичников по FIGO или рецидивом заболевания, которым после выполнения циторе-дуктивной операции была проведена ХТ по схеме цисплатин, доксорубицин, дакарбазин. Показатели выживаемости составили: 1 год — 70%, 2 года — 35% и 3 года — 35% соответственно. В исследовании Patsner и соавт. (1995) 4 пациенткам с распространенной ЗСМО яичников было проведено лечение доксорубицином, ифосфамидом, месной и да-карбазином. Две из этих больных подверглись выполнению циторедуктивной операции в оптимальном объеме. В данной работе зафиксировано достижение 2 полных эффектов лечения продолжительностью 34 и 46 мес. В исследование Т. Le и соавт. [1] вошли 33 пациентки с распространенными стадиями ЗСМО яичников. После осуществления хирургического этапа лечения в 22 случаях отмечено сохранение остаточной опухоли. Адъювантная ХТ включала цисплатин и доксорубицин. Пятилетняя выживаемость составила 35%. Тринадцати пациенткам выполнена second-look-лапаротомия. По мнению авторов, данное вмешательство не играет большой роли в лечении больных с ЗСМО яичников. D.R. Crotzer и соавт. [18] представлены собственные результаты использования цисплатина, ифосфамида и месны при лечении ЗСМО яичников. Медиана выживаемости у 8 пациенток составила 21 мес. J. Thigpen и соавт. [10] в исследовании GOG (Gynecologic Oncology Group) приводят данные по 136 пациенткам с ЗСМО яичников, для лечения которых использовали цисплатин в дозе 50 мг/м2 в режиме однократного введения каждые 3 нед до прогрессирования заболевания или до выявления непереносимой токсичности. Подтверждена эффективность применения цисплатина в 1-й линии лечения этих опухолей. Медиана выживаемо-
сти 130 больных составила 11,7 мес. В исследовании Е. Brown и соавт. [5] были выполнены проспективный анализ и сравнение клинико-патологических особенностей и прогноза течения заболевания у 65 больных с ЗСМО яичников и 746 — с серозной аденокарциномой той же локализации. По данным указанного исследования, эффективность ХТ с включением препаратов платины у пациенток с ЗСМО была ниже. M.P. Zorzou и соавт. [19] провели лечение 9 пациенток с использованием ци-торедуктивных оперативных вмешательств и ХТ
с включением антрациклинов. Медиана выживаемости составила 32,9 мес, статистически значимой разницы между ранними и запущенными стадиями ЗСМО яичников не выявлено. J.E. Мок и соавт. [11] опубликовали результаты лечения и провели обзор использования ХТ с включением препаратов платины у 10 пациенток с ЗСМО яичников. После осуществления хирургического вмешательства все больные получали ХТ с включением препаратов платины, а 7 пациенток были пролечены ифос-фамидом в дозе 1,2 г/м2 и цисплатином — 75 мг/м2.
ЗСМО яичников: хирургическое лечение, режимы ХТ и прогноз
Автор Число больных Число больных с запущенной (Ш-1У) стадией заболевания Число больных, получивших хирургическое лечение (все стадии) ХТ (1-я линия) Выживаемость без прогрессирования, мес Общая выживаемость, мес
T.L. Rutledge и соавт. [2] 31 24 25 без ОО*, 3 с ОО > 1 см, 2 с ОО 2 см, 1 с ОО > 5 см Цисплатин 20 мг/м2 х 4 дня и ифосфамид 1,5 г /м2 х 4 дня через каждые 21 день х 6 циклов; карбоплатин АиС6 и таксол (175 мг/м2) каждые 3 нед х 6 циклов 12 — в группе пациенток, получающих карбоплатин и таксол; не достигнута в группе цисплатина и ифосфамида (но значительно улучшена) 21 (п = 31); в группе с цисплатином и ифосфамидом в течение 2 лет живы 81% пациенток, в группе с карбоплатином и таксолом — 55%
J.E. Mok и соавт. [ll] 10 8 8 без ОО, 1 с ОО < 1 см, 1 с ОО < 2 см Цисплатин 75 мг/м2 и ифосфамид 1,2 г/м2, от 2 до 6 циклов (п = 7), включение препаратов платины — у всех пациенток 46 (п = 10)
27 с III и IV 86 с 11,7 (п=130),
стадией неизмеряемыми и 44 — с измеряемыми проявлениями заболевания Цисплатин 50 мг/м2 каждые у пациенток с
J. Thigpen и соавт. [l0] 132 и рецидивом (только с измеряемыми 3 нед до прогрессирования заболевания или достижения непереносимого уровня 5,2 (п=130) измеряемыми очагами и ответом на лечение —19, без ответа—
проявлениями заболевания) токсичности 4,7; с неизмеряемыми проявлениями — 15,8
E. Brown и соавт. [5] 65 53 28 с ОО < 2 см, 27 с ОО > 2 см, 10 — неизвестно Включение препаратов платины (п = 37), без ХТ (п = 22) 6,4 8,2 (п = 65)
Harris и соавт. 40 32 4 без ОО, 9 с ОО < 2 см, 27 с ОО > 2 см Включение препаратов платины (п = 26), ХТ не проводилась (п = 8) 8,7 (п = 40)
Данные только
Duska и соавт. 28 (26 - 1-я линия — таксол + карбопла-тин) 23 для пациенток с полным эффектом лечения: 10 с ОО < 2 см, 4 с ОО > 2 см, 2 — неизвестно Карбоплатин АиС5—7,5 и таксол (175 мг/м2) каждые 3 нед (1-я или 2-я линия) х 3—8 циклов (п = 13) 9 27,1 — все стадии, 25 — III—IV стадия
A.S. Sit и соавт. [l2] 13 10 6 без ОО, 4 с ОО >1 см, 1 с ОО 2 см, 2 с ОО > 2 см Карбоплатин АиС5 и таксол (175 мг/м2) каждые 3 нед — 1-я или 2-я линия (п = 6); цисплатин 50 мг/м2 и ифосфамид 5 г/м2 (+ месна 5 г/м2) 1 день — 1-я или 2-я линия (п = 8) 10 (группа с цисплатином и ифосфамидом, данные только по 8 пациенткам) 19 — группа таксола и карбоплатина, 23 — группа карбоплатина и ифосфамида
Преимущество в выживаемости 16 (п = 47, ЗСМО и СЯ);
A.K. Sood и соавт. [9] 47 (40 с ЗСМО и 7 с СЯ) 41 (ЗСМО и СЯ) 25 с ОО < 1 см, 22 с ОО > 2 см при применении режимов с включением препаратов платины (п = 27) по сравнению с другими режимами 10,5 5-летняя выживаемость (45% при оптимальной циторедукции, 8% — при субоптимальной)
T. Le и соавт. [l] 36 (стадиро-вание выполнено 26 22 из 35 с макроскопической ОО; 28 — группа ци-сплатин/доксору-бицин: 6 без ОО; 8 с ОО < 2 см, 14 с ОО > 2 см Цисплатин 50 мг/м2 и доксоруби-цин 50 мг/м2 каждые 4 нед — до 9 циклов 90% (19 из 21 пациенток) рецидивов диагностировано в течение 2 лет по- Группа цисплатин/ доксорубицин (п = 28): живы в течение 2 лет — 56%; 5-летняя выживаемость — 35%
для 35) сле постановки диагноза
*ОО — остаточная опухоль.
Гинекология
Гинекология
Медиана выживаемости составила 46 мес. Авторы подтвердили эффективность применения платиносодержащей ХТ после выполнения оптимальной циторедуктивной операции при лечении больных с данной патологией. Также была отмечена достаточно высокая токсичность этих режимов, особенно режима с включением ифосфамида. В ретроспективном исследовании T.L. Rutledge и соавт. [2] проведен анализ результатов адъювантного лечения 11 пациенток с начальными и запущенными стадиями ЗСМО яичников, получивших 6 циклов ХТ в режиме цисплатин в дозе 20 мг/м2 и ифосфамид — 1,5 г/м2 в течение 4 дней каждые 3 нед, и 16 больных, которым была проведена ХТ в режиме кар-боплатин — AUC 6 и паклитаксел — 175 мг/м2 каждый 21 день. Более высокие показатели выживаемости зарегистрированы в группе пациенток, получавших цисплатин/ифосфамид. Выживаемость без прогрессирования составила 12 мес в группе кар-боплатин/паклитаксел и до сих пор не определена в группе ифосфамид/цисплатин (р = 0,005). Общая выживаемость через 2 года в группе карбоплатин/ паклитаксел составила 55%, в группе ифосфамид/ цисплатин — 81% (р = 0,03). Данные различия, вероятно, обусловлены неадекватным отбором пациенток в группы. В аналогичном исследовании, проведенном A.S. Sit и соавт. [12], показатели выживаемости у пациенток, получавших карбоплатин/так-сол (п = 6) и ифосфамид/цисплатин (п=8), не имели значительных различий. В работе Santacruz и соавт. (2004) (п = 11) прогноз у больных с ЗСМО яичников, получавших адъювантно карбоплатин + так-сол или ифосфамид + цисплатин, был сходным, но последний режим сопровождался большей токсичностью. В ретроспективном исследовании, выполненном Duska и соавт. (2002, п = 28), эффективность лечения пациенток с ЗСМО комбинацией карбо-платина и паклитаксела составила 72%, в 55% случаев отмечен полный эффект. Медиана выживаемости этих больных — 27 мес. В сообщении Kosmas и соавт. (2005) приведены сведения об эффективности применения при этой патологии комбинации паклитаксела, карбоплатина и ифосфамида с приемлемой гематологической токсичностью, наблюдающейся при использовании колониестимулирующих факторов.
Роль ЛТ на сегодняшний день пока еще остается неопределенной. Ряд авторов считаю, что применение ЛТ при лечении ЗСМО яичников, которые в большинстве случаев диагностируются в запущенной стадии и клинически проявляются как РЯ (распространение по брюшине), нецелесообразно. ЛТ может назначаться пациенткам с резистентной к ХТ первичной опухолью или рецидивом, ограниченным малым тазом.
Несмотря на то, что ЗСМО яичников чувствительны к ХТ, прогноз при этой патологии неблагоприятный. В настоящий момент перспективным направлением для исследования является применение таргетной терапии в лечении ЗСМО. Эффективность подобного лечения зависит от наличия мишеней в опухоли. В исследовании М. Sawada и соавт. [20] у 9 из 16 пациенток с карциносаркомой матки обнаружена экспрессия Her-2/neu (c-erbB-2), и лишь в 1 случае амплификация гена Her-2 выявлена при флюоресцентной гибридизации in situ (FISH). В исследовании M.R. Raspollini и соавт. [21] положительная реакция Her-2 наблюдалась в 9 из 28 случаев, в 4 из них отмечена экспрессия Her-2+++, во всех образцах имела место амплификация Her-2 при FISH-реакции. В остальных исследованиях наличие экспрессии Her-2 было зафиксировано в 0—88% случаев. С учетом приведенных данных возникает вопрос о возможности применения трастузумаба, моноклонального антитела к Her-2, у больных с ЗСМО женских половых органов. Рецептор к эпителиальному фактору роста (EGFR) — мишень для ряда таргет-ных препаратов, таких как цетуксимаб, изучен в небольшой серии случаев ЗСМО женских половых органов. Экспрессия EGFR выявлена в 30% наблюдений. С-kit, одна из мишеней ингибиторов тирозин-киназы, по данным ряда исследований, также экспрессируется в ЗСМО женских половых органов с частотой 16—25% случаев. Cox-2 экспрессируется приблизительно в 33% наблюдений и может служить потенциальной мишенью для таких препаратов, как ингибиторы cox-2 и ряда других. Доказано, что экспрессия сосудистого эндотелиального фактора роста (VEGF) приводит к ухудшению прогноза при ряде злокачественных новообразований, в том числе и при ЗСМО яичников. В работе M.P. Zorzou и соавт. [19] экспрессия VEGF наблюдалась в 4 (44%) из 9 опухолевых образцов ЗСМО яичников. Следует отметить, что по результатам II фазы исследования по применению доксорубицина в комбинации с бева-цизумабом у пациентов с саркомами мягких тканей эффективность лечения была не выше, чем при проведении монотерапии доксорубицином. В исследовании J.P. Geisler и соавт. [22] обнаружена экспрессия рецепторов к эстрогенам в 6 (66,6%) из 9 образцов ЗСМО яичников. В более позднем исследовании, проведенном M.P. Zorzou и соавт. [19], в 9 образцах ткани этого морфологического типа СЯ экспрессии рецепторов ни к эстрогенам, ни к прогестерону не выявлено. В настоящее время пока нет данных о применении гормональной терапии при этой патологии.
Саркомы, в которых присутствует только саркоматозный компонент, относят к «чистым». «Чистые» саркомы встречаются крайне редко. Они могут быть
классифицированы как ЭСС, ФС, лейомио-, нейрофибро-, рабдомио-, хондро-, ангио- и липосаркомы.
Аденосаркома (АС) — двухфазная опухоль, характеризующаяся наличием очагов пролиферации эпителия мюллеровского типа, редко — с выраженной атипией, покрывающих или располагающихся в преобладающем саркоматозном компоненте. Большинство случаев АС описано у пациенток в возрасте 40—50 лет. Наиболее характерные клинические симптомы — одностороннее опухолевое поражение яичников, жалобы на возникновение дискомфорта и болей в брюшной полости, увеличение живота в размерах. Эта опухоль часто инфильтрирует окружающие ткани [23]. В единичных описаниях АС приводятся ссылки на связь распространения опухоли в брюшную полость с плохим прогнозом. В исследовании J.H. Eichhorn и соавт. [24], включившем 40 пациенток с АС, 5-летняя выживаемость больных составила 64%, 10-летняя — 46%, а 15-летняя — только 30%. Возраст пациентки старше 53 лет, разрыв капсулы опухоли и низкая степень диф-ференцировки — наиболее вероятные прогностические факторы рецидивирования и экстраовари-ального распространения опухоли. AC яичников характеризуется более неблагоприятным прогнозом, чем опухоль аналогичного гистологического строения маточной локализации, что обусловлено склонностью новообразований яичников к распространению по брюшине. В лечении пациенток с АС яичников основную роль отводят хирургическому методу. В некоторых случаях могут быть использованы ХТ и ЛТ, однако на данном этапе исследований, доказывающих эффективность их применения в лечении АС, не проводилось.
ЭСС яичников — злокачественная опухоль, которая характеризуется наличием диффузной пролиферации опухолевых клеток, схожих по строению со стромальными клетками пролиферативного эндометрия. Новообразование яичников, состоящее из клеток с умеренным или выраженным плеоморфизмом, ядерной анаплазией с содержанием большего количества цитоплазмы, чем это характерно для эндометриальных стромальных клеток, должно быть классифицировано как недифференцированная СЯ. ЭСС выявляется в возрасте 11—76 лет и преобладает у пациенток 50—60 лет. Клинические проявления ЭСС яичников не отличаются от симптомов, характерных для других опухолей яичников. Ко времени постановки диагноза у 50% больных имеет место распространение опухоли на органы малого таза или верхнего этажа брюшной полости. Главным прогностическим фактором является стадия заболевания. Дифференцировка опухоли — ЭСС или недифференцированная саркома (Wbrld Health Organization Classification of Tumours;
Pathology and Genetics of Tumours of the Breast and Female Genital Organs; Lyon, 2003) — также влияет на клиническое течение заболевания. ЭСС обладает преимущественно благоприятным прогнозом с выживаемостью > 5 лет даже в случаях экстраова-риального распространения опухоли. После 10 лет смертность возрастает, особенно в тех случаях, когда к моменту постановки диагноза были обнаружены экстраовариальные проявления болезни. Недифференцированная СЯ имеет быстрое течение и неблагоприятный прогноз. Стандартом лечения ЭСС яичников служит радикальная пангистерэктомия. В литературе имеются сведения об успешном применении гормональных препаратов, цитостати-ков и лучевого воздействия при лечении пациенток с данной патологией.
ФС встречаются в любом возрасте, но наиболее распространены они у пожилых женщин (рис. 2). Для ФС характерны одностороннее поражение, большие размеры опухоли, наличие очагов кровоизлияний и некроза в опухолевой ткани.
Рис. 2. ФС. Клеточная атипия от умеренной до выраженной степени, множественные митозы
Прогноз при этом заболевании неблагоприятный, наблюдаются быстрое метастазирование и резистентность к применению адъювантной ХТ.
Редкая встречаемость СЯ делает практически невозможным проведение проспективных рандомизированных исследований с целью определения эффективности тактики лечения. Несмотря на отсутствие более точных данных, больных с данной патологией рекомендуется подвергать полноценному хирургическому стадированию или оптимальной циторедукции в случае распространенности процесса. В настоящее время исследований, посвященных оценке эффективности применения неоадъювантной ХТ при СЯ, нет. В послеоперационном периоде больным должна быть проведена ХТ с включением препаратов платины. Динамическое наблюдение пациенток с СЯ соответствует таковому при раке той же локализации.
Гинекология
Гинекология
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Le T., Krepart G.V., Lotocki R.J., Heywood M.S. Malignant mixed mesodermal ovarian tumor treatment and prognosis: a 20 year experience. Gynecol Oncol 1997;65:237-40.
2. Rutledge T.L., Gold M.A.,
McMeekin D.S. et al. Carcinosarcoma of ovary — a case series. Gynecol Oncol 2006;100; 128—32.
3. Chang J., Sharpe J.C., A'Hern R.P. et al. Carcinosarcoma of the ovary: Incidence, prognosis, treatment and survival of patients. Ann Oncol 1995;6:755-8.
4. Leiser A.L., Chi D.S., Ishill N.M.,
Tew WP. Carcinosarcoma of the ovary treated with platinum and taxane: The memorial Sloan-Kettering Cancer Center experience. Gynecol Oncol 2007;105:651-61.
5. Brown E., Stewart M., Rye I. et al. Carcinosarcoma of the ovary: 19 years of prospective data from single center. Cancer 2004;100:2148-53.
6. Mano M.S., Rosa D.D., Azambuja E. et al. Current management of ovarian carcinosarcoma. Int J Gynecol Cancer 2007;17:316-24.
7. Berek J.S., Hacker N.F. Practical gynaecologic oncology. 4th ed. Lippincott: Williams and Wilkins, 2005; p. 511-41.
8. Berek J.S., Hacker N.F. Sarcomas of the female genital tract. In: The soft tissue sarcomas. F.R. Eilber et al eds. Orlando: Grune & Stratton, 1987; p. 229-38.
9. Sood A.K., Sorosky J.I., Gelder M.S.
et al. Primary ovarian sarcoma: Analysis of prognostic variables and the role of surgical cytoreduction. Cancer 1998;82(9):1731—7.
10. Thigpen J., Blessing J.A.,
DeGeest K. et al. Gynecologic Oncology Group. Cisplatin as initial chemotherapy in ovarian carcinosarcomas: a Gynecologic Oncology Group study. Gynecol Oncol 2004;93:336-9.
11. Mok J.E., Kim Y.M., Jung M.H. et al.
Malignant mixed Mullerian tumors of the ovary: experience with citoreductive surgery and platinum-based combination chemotherapy. Int J Gynecol Cancer 2006;16:101-5.
12. Sit A.S., Price F.V., Kelley J.L.
et al. Chemotherapy for malignant mixed Mullerian tumors of the ovary. Gynecol Oncol 2000;79:196-200.
13. Carlson J.A., Edwards C., Wharton J.T. et al. Mixed mesodermal sarcoma of ovary: Treatment with combination radiation therapy and chemotherapy. Cancer 1983;52:1473-7.
14. Anderson W., Young D.E., Peters W.A. et al. Platinum based combination chemotherapy for malignant mixed
mesodermal tumours of the ovary. Gynecol Oncol 1989;32:319-22.
15. Plaxe S.C., Dottino P.R., Goodman H.M. et al. Clinical features of advanced ovarian mixed mullerian tumours
and treatment with doxorubicin and cisplatin chemotherapy. Gynecol Oncol 1990;37:244-9.
16. Prendiville J., Murply D., Rennision J. et al. Carcinosarcoma of the ovary treated over a ten year period at the Christie Hospital. Int J Gynecol Cancer 1995;97:219-22.
17. Baker T.R., Piver M.S., Caglar H., Piedmonte M. Prospective trial of cisplatin, adriamycin, dacarbazine in metastatic mixed mesodermal sarcomas of the uterus and ovary. Am J Clin Oncol 1991;14: 246-50.
18. Crotzer D.R., Wolf J.K., Jenkins A.D. et al. A pilot study of cisplatine, ifosfamide and mesna in the treatment of malignant mixed mesodermal tumors of the ovary. Proc Am Soc Clin Oncol 2003;24:474.
19. Zorzou M.P., Markaki S., Rodolakis S. et al. Clinicopathological features
of ovarian carcinosarcomas: a single institution experience. Gynecol Oncol 2005;96:136-42.
20. Sawada M., Tsuda H., Kimura M. et al. Different expression patterns of KIT, EGFR, and HER-2 (c - erbB-2) oncoprotein between epithelial and mesenchymal components in uterine carcinosarcoma. Cancer Sci 2003;94:986-91.
21. Raspollini M.R., Susini T., Ammuni G. et al. Expression and amplification
of HER-2/neu oncogene in uterine carcinosarcomas a marker for potential molecularly targeted treatment? Int J Gynecol Cancer 2006;16:416-22.
22. Geisler J.P., Wiemann M.C., Miller G.A et al. Estrogen and progesterone receptors in malignant mixed mesodermal tumors of the ovary. J Surg Oncol 1995;59:45-7.
23. Czernobilsky B., Gillespie J.J.,
Roth L.M. Adenosarcoma of the ovary light-and electron-microscopic study with review of the literature. Diagn Gynecol Obstet 1982;4:25-36.
24. Eichhorn J.H., Young R.H.,
Clement P.B., Scully R.E. Mesodermal (mullerian) adenosarcoma of the ovary: a clinico-pathologic analysis of 40 cases and a review of the literature. Am J Surg Pathol 2002;26:1243-58.
25. Лазарева Н.И. Злокачественные мезенхимальные опухоли женских половых органов (клиника, диагностика, лечение, факторы прогноза). Автореф. дис. ... д-ра мед. наук. М., 2003.
26. Anderson B., Turner D.A., Benda J. Ovarian sarcoma. Gynecol Oncol 1987;26:183-92.
27. Calvert A.H., Newall D.R.,
Grumbell L.A.
et al. Carboplatin dosage prospective evaluation of a simple formula based on renal function. J Clin Oncol 1989;7: 1748-56.
28. Cicin I., Saip P., Eralp Y. et al. Ovarian carcinosarcomas: Clinicopathological prognosis factors and evaluation of chemotherapy regimens containing platinum. Gynecol Oncol 2008; 108:136-40.
29. Dass K.K., Biscotti C.V., Webster K., Saxton J.P. Malignant mixed mullerian tumours of the ovary. An analysis of two long term survivors. Am J Clin Oncol 1993;16(4):346-9.
30. Garamvoelgyi E., Guillou L.,
Gebhard S. et al. Primary malignant mixed mullerian tumour (metaplastic carcinoma) of the female peritoneum. Cancer 1994;74(3):854—63.
31. Hanjani P., Peterson R.O., Lipton S.E., Nolte S.A. Malignant mixed mesodermal tumours of the ovary: Report of eight cases and review of the literature. Obstet Gynecol Surv 1993;38:537-45.
32. Lele S.B., Piver M.S., Barlow J.J. Chemotherapy in the management of mixed mesodermal tumours of the ovary. Gynecol Oncol 1980;10:298-302.
33. Marshall R.J. Mixed mullerian tumour of the gynaecological system other than endometrial tumours. In: Textbook of uncommon cancers. Williams C., Krikonan J.G., Green M.R., Raghaven D. eds. Chichester, 1988.
34. Morrow C.P., Ablaing G., Brady L.W. et al. A clinical pathological study of
30 cases of malignant mixed mullerian tumours: A gynaecologic oncology group study. Gynecol Oncol 1984;18:278-92.
35. Morrow C.P., Bundy B., Hoffman J. et al. Adriamycin chemotherapy for malignant mixed mesodermal tumour of ovary. Am J Clin Oncol 1986;9:24-6.
36. Silasi D.-A., Illuzzi J.L., Kelly M.G., Rutherford T.J. Carcinosarcoma of the ovary. Int J Gynecol Cancer 2008;18:22-9.
37. Silverberg S.G., Kurman R.J. Atlas of tumour pathology, 3rd series Fascicle 3. Washington DC: Armed Forces Institute of Pathology, 1991.
38. Simon S.R., Wang S.E., Uhl M., Shackney S. Complete response of carcinosarcoma of ovary to therapy with doxorubicin, ifosfamide, and dacarbazine. Gynecol Oncol 1991;41:161-6.
cyberleninka.ru