Рак инситу молочной железы
Материалы конгрессов и конференций
ЛЕЧЕНИЕ ПРОТОКОВОГО РАКА IN SITU МОЛОЧНОЙ ЖЕЛЕЗЫ
В.В. Семиглазов ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Благодаря развитию маммографической техники и внедрению маммографического скрининга значительно возросла частота выявления клинически скрыто протекающих как минимальных форм рака молочной железы (РМЖ), так и карцином in situ (CIS). По данным мировой литературы, в настоящее время CIS составляет 20-40% от всех вновь выявляемых случаев РМЖ.
В 1908 г. Cornil описал схожесть клеток инвазивного рака с клетками, ограниченными эпителием протоков, а Cheatle и Cutler одними из первых предположили, что карцинома in situ является формой рака, представленного изначально пулом злокачественных клеток, ограниченных эпителием, не вовлекающих в процесс базальную мембрану, но потенциально способных к инвазии. Термин CIS молочной железы объединяет два типа заболевания, имеющих различную биологию, отличающихся риском развития инвазивного рака и методами лечения: протоковая карцинома in situ (ductal carcinoma in situ-DCIS) и дольковая карцинома in situ (lobular carcinoma in situ-LCIS). Наиболее часто диагностируют DCIS.
С морфологической точки зрения DCIS сравнительно гетерогенное заболевание. В основе большинства ее классификаций лежит морфологическая структура опухоли, что позволяет выделить два основные типа DCIS – комедо и некомедо DCIS. Такое разделение, с одной стороны, связано с диаметрально противоположной прогностической значимостью этих типов DCIS, а, с другой стороны, определено схожестью некоторых морфологических маркеров некомедо форм DCIS. Последние представлены криброзной, папиллярной, микропапиллярной, солидной и “цепляющейся” формами протокового рака.
Данная классификация, хотя и удобна для клиницистов, так как четко отграничивает прогностически благоприятные (некомедо) и неблагоприятные (комедо) формы DCIS, является чрезвычайно упрощенной, так как не полностью отражает биологические особенности роста внутрипротоковых карцином in situ и не учитывает пограничные формы DCIS.
Для того чтобы преодолеть недостатки традиционной гистологической классификации, в последнее десятилетие предложено множество альтернативных классификаций, в основе которых лежат такие факторы, как упомянутая выше степень злокачественности (основанная на морфологии клеточного ядра, Nuclear grade I, II, III) и наличие комедо-некроза. Используя комбинацию данных факторов, Lagios, Silverstein с соавт. предложили выделить при DCIS три степени гистологической злокачественности: высокую (ВСГЗ), промежуточную (ПСГЗ) и низкую степени (НСГЗ).
Наиболее эффективным методом лечения карциномы in situ по-прежнему остается хирургическое вмешательство. Мастэктомия приводит практически к 100% излечению от заболевания. На данный момент нет убедительных крупных рандомизированных клинических исследований, сравнивающих эффективность мастэктомии и органосохраняющих операций, тем не менее, первая остается “стандартом”, с которым сравнивают остальные методы лечения. Однако в последние два десятилетия большинство больных даже с инвазивной карциномой при определенных показаниях подвергаются органосохраняющему (консервативному) лечению, поэтому рутинное использование мастэктомии у больных с DCIS в настоящее время дискутабельно.
Споры в отношении объема оперативного вмешательства при DCIS продолжаются, так как до сих пор, несмотря на появление ряда классификаций, трудно предвидеть, какое лечение будет лучшим в том или ином случае. Тем не менее, существует категория больных с DCIS (приблизительно 25%), которые имеют абсолютные показания к мастэктомии:
- больные с большим размером опухоли (более 5 см), не позволяющим выполнить органосохраняющую операцию радикально;
- больные с множественными очагами DCIS при относительно малом размере молочной железы;
- больные, которые не могут подвергаться лучевой терапии (например, из-за сопутствующей патологии или предыдущей лучевой терапии на грудную клетку по поводу другого заболевания).
Органосохраняющее лечение. Первоначальным результатом широкого применения сохранных операций (в сочетании с лучевой терапией или без таковой) при DCIS стал значительный рост частоты развития местных рецидивов. Показатель рецидивирования возрос с 1-2% после мастэктомии до 30-50% после органосохраняющего лечения. Полученные данные заставили исследователей искать факторы риска, влияющие на частоту развития рецидивов.
При мультивариантном анализе Fisher с соавт. (1999 г.) определили статистически значимые признаки: гистологическая степень злокачественности, размер опухоли и ширина краев резекции. Silverstein, проанализировав данные по лечению DCIS, отметил значительные отличия в показателях местного рецидивирования в зависимости от степени гистологической злокачественности. Частота рецидивов в течение 84 мес. наблюдения при ВСГЗ, ПСГЗ и НСГЗ составила 41%, 16% и 0% соответственно. По данным Lagios с соавт., увеличение размера опухоли с 15 мм до 40 мм сопровождается удвоением количества рецидивов (25,5% и 57% соответственно), а увеличение ширины краев резекции от 1 мм до 10 мм наоборот приводит к снижению частоты местного рецидивирования практически в 5 раз (от 42% до 8,3%). Silverstein утверждает, что при достаточной ширине резекции (10 мм и более) размер опухоли и степень гистологической злокачественности практически не влияют на частоту развития местного рецидива.
Большинство рецидивов возникает либо в области резекции, либо в непосредственной близости от нее, что говорит о неадекватности хирургического вмешательства (недостаточно широком иссечении опухоли). Однако для достижения адекватной хирургической резекции молочной железы весьма сложно точно определить как истинную распространенность опухоли по протокам, так и необходимую ширину резекции. Еще R. Holland с помощью морфологических исследований показал, что протоковые карциномы in situ почти всегда уницентричные по генезу (т.е. вовлекают в процесс только один проток), но часто мультифокальные (так как множественные фокусы извитого протока попадают в микроскопический срез в одном сегменте молочной железы). Поэтому размеры очагов часто больше, чем ожидают, и они, как правило, распространяются за границы маммографически определяемых микрокальцинатов. В частности R. Holland (1984) отметил, что в 40% случаев микроскопические и рентгенологические размеры DCIS отличаются более чем на 2 см. Неточная ориентировка хирурга на рентгено-маммографические заключения отчасти объясняет высокую частоту местного рецидивирования при сверхэкономных операциях. Остатки внутрипротоковой карциномы in situ являются основным источником рецидивов, а в случае микроинвазии – регионарных метастазов.
Для того чтобы избежать появления рецидива и произвести своевременную “спасительную” повторную резекцию или даже мастэктомию, необходимо сфокусировать внимание на тщательном морфологическом исследовании краев хирургической резекции, так как “чистые” хирургические края – один из основных критериев органосохраняющего лечения DCIS. Кроме того, широкое распространение нашел рентгенологический метод исследования операционного материала, служащий для немедленного решения вопроса о расширении объема операции в случае обнаружения микрокальцинатов в операционном материале по краю резекции (при последующем срочном морфологическом подтверждении наличия остатков опухоли). С этой же целью часто производится постэксцизионная маммография.
В 90% случаев гистологическая структура рецидивного узла идентична структуре первичной протоковой карциномы in situ. Однако в ряде случаев рецидивы возникают вдали от первичного очага (хотя иногда в пределах одного квадранта), что говорит о развитии опухоли de novo, а не из остатков предшествующей DCIS, что отчасти может быть объяснено мультифокальной природой протоковой карциномы in situ. В результате расширение объема резекции не всегда препятствует развитию местных рецидивов. Однако истинная DCIS имеет характерные черты, которые делают радикальное удаление опухоли теоретически возможным:
- отсутствие стромальной инвазии;
- уницентричное распространение (в одной протоковой системе);
- отсутствие отдаленных и регионарных метастазов.
Таким образом, такие факторы как степень злокачественности, наличие комедо-некроза, размер опухоли и ширина краев резекции являются важными прогностическими факторами риска развития местного рецидива у больных, подвергшихся органосохраняющему лечению по поводу DCIS. Silverstein и Lagios, используя данные признаки в комплексе, попытались определить группы риска развития местных рецидивов. В результате исследователями предложен Ван Наэский прогностический индекс (Van Nuys Prognostic Index, ВНПИ). В основе ВНПИ лежит 3-балльная градация каждого из вышеперечисленных признаков: 1 – лучший прогноз, 3 – худший. Прогностический индекс равен сумме баллов, полученных при оценке размера опухоли, ширины краев резекции и морфологическом исследовании опухоли. Согласно данной градации, в каждом отдельном случае может быть получено от 3 до 9 баллов. При 3-4 баллах частота местного рецидивирования низкая (I), при 5-7 – умеренная (II), а при 8-9 баллах – высокая (III). Исследование выявило, что показатели безрецидивной выживаемости в каждой из этих групп статистически значимо отличаются друг от друга.
Кроме того, для решения вопроса о возможности проведения органосохраняющих операций можно учитывать следующие условия:
- размер DCIS не должен превышать 2-3 см в диаметре; если размер опухоли оценивается по микрокальцинатам на маммограмме, то его площадь не должна превышать 6 см2; при большем распространении опухоли органосохраняющая операция возможна только при достаточном размере молочной железы, позволяющем избежать значительной деформации в случае удаления большого объема тканей;
- ширина краев резекции должна быть не менее 10 мм;
- степень гистологической злокачественности должна быть низкой или промежуточной, хотя некоторые исследователи считают, что пациентки с DCIS высокой степени гистологической злокачественности тоже могут быть кандидатами для органосохраняющих операций, если есть возможность отступить от края опухоли на 10 мм или более;
- молочная железа должна выглядеть после операции эстетично; если этого добиться невозможно, предпочтительно выполнить мастэктомию (с последующей реконструкцией молочной железы).
Подмышечная лимфаденэктомия. Подмышечная лимфаденэктомия у больных с DCIS, как правило, не производится, так как количество оккультных инвазивных карцином, сопровождающихся метастазированием в аксиллярные лимфатические узлы, не превышает 1-3%. Больным, которым производится мастэктомия, в последнее время выполняется биопсия сторожевых узлов (sentinel node biopsy). Для идентификации этих узлов используют радиоизотопные щупы, фиксирующие накопление введенных рядом с опухолью радиофармпрепаратов (вместе с красителем blue dye для визуализации их точного расположения).
Лучевая терапия (ЛТ). Результаты исследований по оценке эффективности послеоперационной лучевой терапии больных с DCIS, полученные в настоящее время, весьма противоречивые.
В рамках NSABP (протокол В-17) было проведено первое проспективное исследование роли ЛТ при выполнении органосохраняющего лечения у больных с протоковой карциномой in situ. 818 больных подвергались либо только органосохраняющим операциям, либо органосохраняющим операциям c последующей лучевой терапией. В результате было зарегистрировано значительное снижение частоты развития местных рецидивов, в особенности рецидивов с инвазивным компонентом среди больных, подвергшихся послеоперационной лучевой терапии. 3-летняя частота рецидивирования больных с DCIS после органосохраняющих операций и лучевой терапии составила 10%, а после органосохраняющих операций без лучевой терапии - 21%. 8-летняя частота рецидивирования составила 12% и 27% соответственно, а через 10 лет – 13% и 31% соответственно. Полученные данные позволили NSABP рекомендовать проведение послеоперационной лучевой терапии всем больным с протоковой карциномой in situ, которым планируется выполнение сохранных операций.
Однако приблизительно для 30-40% больных с протоковой карциномой in situ, которым выполняются органосохраняющие операции, последующая ЛТ, как и мастэктомия, является избыточным лечением. Поэтому в ряде работ делается акцент на тщательном подборе больных, у которых вероятность дополнительного положительного эффекта ЛТ высокая.
Lagios с соавт. в своем исследовании попытался оценить эффективность ЛТ при DCIS с учетом факторов риска развития местных рецидивов. Отмечена высокая эффективность ЛТ при DCIS высокой степени гистологической злокачественности, но не обнаружено никакого преимущества ЛТ при низкой степени гистологической злокачественности. Кроме того, отмечено, что риск развития рецидива при DCIS высокой степени гистологической злокачественности увеличивается пропорционально увеличению объема опухоли, однако проведение ЛТ практически не влияет на показатели безрецидивной выживаемости, за исключением случаев, когда размер опухоли не превышает 15 мм.
В работе Lagios анализ влияния ширины хирургических краев на показатели безрецидивной выживаемости не показал статистически значимых отличий в группах с послеоперационной ЛТ и без нее. Частота местных рецидивов при ширине хирургического края 10 мм или более составила 4,5% без ЛТ и 5% в группе с ЛТ. ЛТ оказала положительный эффект только в группе больных с DCIS высокой степени гистологической злокачественности с шириной края 10 мм и 1-9 мм (частота рецидивов 0% и 29% соответственно против 8,3 % и 40,5% без ЛТ). При ширине края менее 1 мм ЛТ не имела преимущества перед обычной резекцией опухоли. При DCIS низкой и промежуточной степеней гистологической злокачественности ЛТ не оказала положительного эффекта вне зависимости от ширины хирургических краев.
Применение Ван Наэского прогностического индекса послужило основой для разработки алгоритма лечения, в т.ч. лучевой терапии протоковой карциномы in situ. Проанализированы результаты лечения трех групп риска развития местных рецидивов. В группе низкого риска рецидива (3-4 балла) ЛТ не оказала статистически значимого эффекта. В группе умеренного риска рецидива (5-7 баллов) при проведении ЛТ отмечено снижение частоты местных рецидивов на 13%. Наибольшее преимущество ЛТ зарегистрировано в группе высокого риска рецидива (8-9 баллов). Однако в последнем случае частота развития местных рецидивов была крайне высокой вне зависимости от того, проводилась ЛТ или нет.
Исходя из полученных результатов, были даны рекомендации по лечению DCIS. При суммарном индексе в 8-9 баллов, учитывая высокую степень риска развития местных рецидивов (более 60% за 5 лет), рекомендовано выполнять мастэктомию. При индексе в 5-7 баллов необходима широкая резекция с послеоперационной ЛТ, а при индексе в 3-4 балла достаточно секторальной резекции молочной железы.
Таким образом, показания к проведению послеоперационной ЛТ должны быть основаны на тщательном определении факторов риска местного рецидива заболевания.
Адъювантная лекарственная терапия. Адъювантная цитотоксическая терапия у больных с DCIS не проводится. Иначе дело обстоит с гормональным лечением. Рандомизированные клинические испытания, проведенные B. Fisher в проекте NSABP показали, что назначение тамоксифена в дозе 20 мг/сут. в течение 5 лет больным с DCIS, подвергшимся органосохраняющему лечению и ЛТ, снижает частоту инвазивных рецидивов в той же молочной железе. Кроме того, гормонотерапия существенно снижает частоту как инвазивных, так и неинвазивных рецидивов в контралатеральной молочной железе. Тамоксифен улучшает показатели безрецидивной выживаемости вне зависимости от состояния краев резекции и наличия комедо-типа некроза. Однако на показатели общей выживаемости назначение препарата не влияет.
Использовать ли тамоксифен рутинно у всех больных с DCIS или применять его только при рецептороположительных опухолях, пока не ясно. На данный момент нет достаточных данных со статистически значимым эффектом лечения тамоксифеном. В настоящее время исследуется эффективность селективных модуляторов рецепторов эстрогенов при лечении DCIS (ралоксифен).
Лечение больных с рецидивами после органосохраняющего лечения. При инвазивном рецидиве лечение соответствует лечению инвазивного РМЖ аналогичной стадии. Лечение неинвазивного рецидива зависит от первоначального лечения. Если больная подвергалась только локальному иссечению, то методами выбора являются реэксцизия, реэксцизия и ЛТ или мастэктомия. У некоторых больных можно производить повторные попытки локального иссечения опухоли. Если же проводилась лучевая терапия, то при наступлении рецидива, как правило, выполняется мастэктомия.
Наблюдение. Все больные, подвергшиеся лечению по поводу DCIS, требуют наблюдения в течение всей жизни. Маммография выполняется всем больным, подвергшимся органосохраняющему лечению ежегодно, причем первые два года после лечения маммография должна выполняться каждые 6 мес. Клиническое обследование больных в течение первых лет также должно выполняться каждые 6 мес., а затем - ежегодно. Другие дополнительные методы диагностики имеют относительные показания.
Заключение.
- DCIS - относительно частое заболевание. Благодаря маммографии выявляемость DCIS стремительно увеличивается, особенно за счет непальпируемых форм.
- Не все формы DCIS превращаются в инвазивный рак, однако если у пациентки обнаруживается карцинома in situ, то вероятность развития инвазивного рака у нее больше, чем у женщины без DCIS.
- DCIS высокой степени гистологической злокачественности протекают более агрессивно и обладают более высоким инвазивным потенциалом, чем DCIS низкой степени гистологической злокачественности.
- Частота регионарного метастазирования при карциноме in situ не превышает 1-2%, поэтому лимфаденэктомия для большинства больных является излишней.
- Успех лечения карциномы in situ зависит от выбора оптимального объема лечения, который основывается на тщательной оценке прогностических критериев и оценке риска рецидива.
rosoncoweb.ru
Рак Педжета молочной железы: симптомы, диагностика и прогноз
Ежегодно раком груди заболевают сотни тысяч женщин по всему миру. И только в редких случаях врачами диагностируется рак Педжета молочной железы. Эта форма заболевания, протекающая с поражением сосково-ареолярной зоны, может возникать, не только у женщин, но и у мужчин.
Причины развития заболевания
Болезнь Педжета проявляется на соске и в зоне вокруг него. В абсолютном большинстве случаев, превышающих девяносто пять процентов, данное заболевание сопровождается развивающимся в организме раком молочной железы.
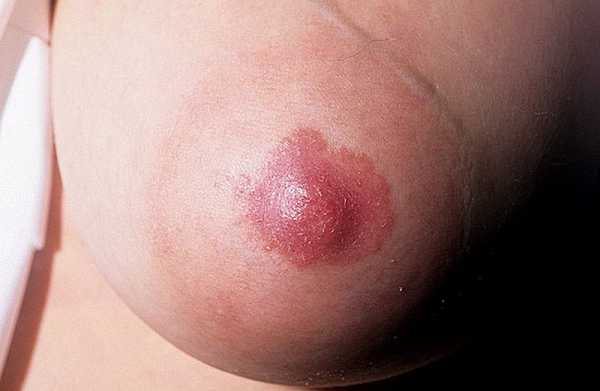 Рак Педжета
Рак ПеджетаЕдиной теории, объясняющей механизм возникновения и развития рака груди, именуемого болезнью Педжета, на сегодняшний день не существует. Догадки ученых подразделяются на два противоположных мнения:
- Переход образовавшихся в молочной железе раковых клеток на поверхность сосков через молочные протоки;
- Самопроизвольная мутация эпителиальных клеток сосков и ареол в злокачественные образования.
Вторая теория основывается на том, что в редких четырех-пяти случаях болезнь Педжета возникает без присутствия в организме рака молочной железы.
Вне зависимости от того, в какой зоне происходит образование раковых клеток, в молочной железе или сосково-ареолярной зоне, на их появление и развитие могут оказывать влияние следующие факторы:
- Вредные привычки в виде курения и алкоголизма;
- Контакт с вредными химикатами;
- Неблагоприятная экологическая обстановка;
- Применение гормональных препаратов;
- Воздействие радиации;
- Гормональный дисбаланс, выражающийся в поздней менопаузе.
Причинами злокачественных новообразований также могут выступать ожирение, позднее материнство, некоторые виды дерматологических заболеваний и наследственный фактор. В группу риска попадают лица, старше пятидесяти лет. Но не исключается заболевание и в более раннем возрасте.
Классификация рака Педжета
В зависимости от зоны распространения заболевания, рак Педжета молочной железы подразделяется на следующие три вида:
- Изменения происходят только в сосково-ареолярной зоне;
- Помимо изменений, охватывающих сосок и ареолу, наблюдается образование опухолевого узла в околососковой зоне молочной железы;
- Имеется только опухолевый узел в молочной железе. Такой вид тяжело диагностировать сразу.
Как видно, опухоль в виде узла и видимые изменения сосково-ареолярного комплекса могут быть не связаны между собой и развиваться, как одновременно, так и не зависимо друг от друга.
Еще одна классификация рака груди Педжета основывается на характере клинического течения и включает в себя следующие виды:
- Мелкая сыпь и образования в виде пузырьков;
- Наличие корочек, снятие которых ведет к образованию воспаленного участка кожи;
- Мелкая сыпь розового оттенка и сопровождающаяся образованием сухих чешуек;
- Образование язв;
- Наблюдается опухоль в молочной железе.
Таким образом, болезнь может протекать с различными наружными проявлениями, что может быть связано с индивидуальными особенностями организма. Более того, почти в десяти процентах случаев болезнь не имеет внешних признаков и диагностируется случайно.
Симптомы рака Педжета молочной железы
Коварность заболевания заключается в том, что первые симптомы и признаки рака Педжета могут слабо выражаться или не проявляться вовсе на протяжении нескольких месяцев, не вызывая тем самым опасений и беспокойства. Такой скрытый период в среднем продолжается от шести месяцев до года.
Самым первым видимым признаком развития рака становятся покраснение и сыпь на соске. Сопровождается это явление терпимым зудом и жжением. Механизм проявления симптомов обычно подразумевает поражение соска, затем ареолы, и после оставшейся части груди. Вторым сложным моментом рака Педжета является тот факт, что первые видимые признаки могут резко исчезнуть, что часто воспринимается людьми за ложный признак выздоровления.
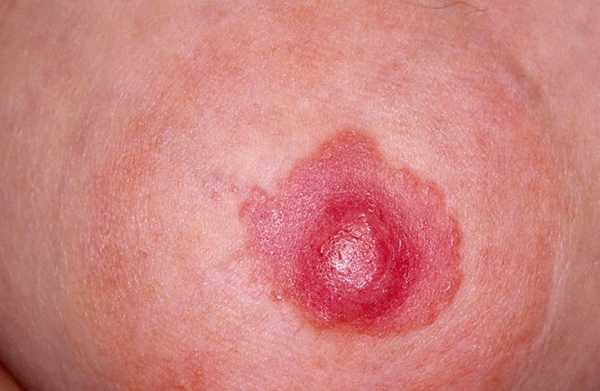 Внешние проявления рака Педжета
Внешние проявления рака ПеджетаС развитием болезни добавляются такие симптомы, как:
- Образование корочек в виде экземы;
- Усиливающийся зуд и жжение;
- Образование эрозий;
- Выделения из сосков;
- Болевые ощущения.
Не стоит считать, что без имеющегося пальпируемого образования, не может быть диагностирован рак Педжета. Только в половине случаев образуется комки и инфильтраты в груди. На самых поздних стадиях заболевания появляются серозные и кровяные выделения на пораженной области.
У мужчин рак молочной железы Педжета диагностируется гораздо реже. Симптомы при этом идентичны проявлению заболевания у женщин. Они также включают в себя покраснения, сыпь, образование корочек и неприятные ощущения в виде зуда и жжения.
Диагностика заболевания
Поскольку рак является одним из самых серьезных заболеваний и требует агрессивного лечения, точность диагностики в этом вопросе крайне важна. Для того чтобы подтвердить наличие болезни у пациента, недостаточно визуального осмотра или сдачи общих анализов. В данном случае требуется комплексное обследование, необходимо сделать рентген молочной железы, мрт или узи.
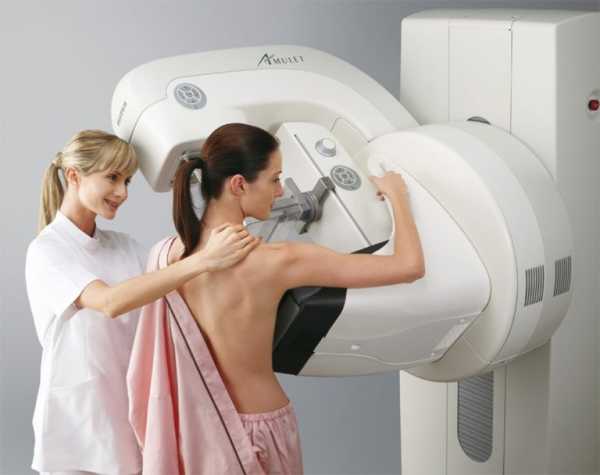 Маммография позволяет обнаружить опухолевый узел на ранних стадиях
Маммография позволяет обнаружить опухолевый узел на ранних стадияхРассмотрим, что подразумевают под собой основные методы первоначальной диагностики :
- Маммография. Это рентген молочной железы, позволяющий обнаружить опухолевый узел при его наличии. Помимо этого рентген позволяет оценить степень втянутости соска и толщину кожи в зоне ареолы. Поскольку рак Педжета не всегда сопровождается образованием узла, маммография может предоставить отрицательный результат при наличии болезни в организме;
- УЗИ молочной железы. Такой метод применяется, если маммография не в силах установить клиническую картину. При помощи ультразвукового исследования врач может оценить структуру тканей, обнаружить расширенный характер протоков и наличие образовавшегося инфильтрата;
- МРТ. Данный метод позволяет диагностировать болезнь еще на этапе, когда она протекает совсем бессимптомно. Процедура магнитно-резонансной томографии позволяет выявить опухолевое образование и изменяющуюся структуру желез и тканей.
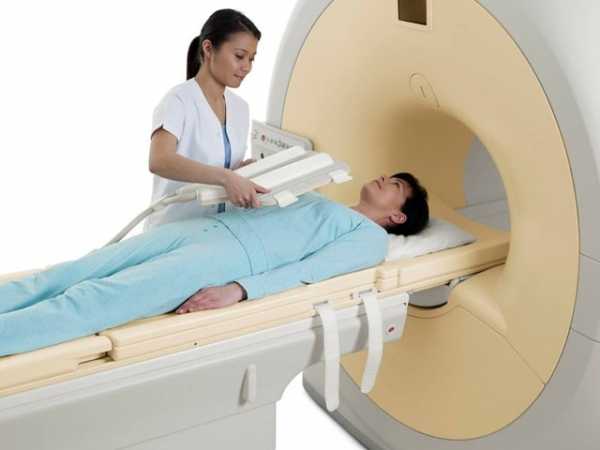 МРТ обследование молочных желез
МРТ обследование молочных железЕсли результат диагностики подтверждает протекающие изменения в сосково-ареолярной зоне и в молочной железе в целом, проводится гистологическое обследование тканей. Такая процедура называется биопсией. Во время процедуры из пораженной зоны изымается образец ткани, который впоследствии изучается в лабораторных условиях на предмет наличия раковых клеток.
Биопсия является наиболее часто применяемой процедурой при выявлении рака груди. Но существуют также варианты взятия соскоба клеток и иммуногистохимическое исследование. Последнее основывается на обнаружении в крови маркеров, свидетельствующих о наличии заболевания.
Тщательная диагностика, требующая проведения нескольких видов процедур, обосновывается схожестью клинической картины рака Педжета с иными распространенными заболеваниями. А именно: псориазом, меланомой, дерматитом, аденоматозом и прочими видами.
Лечение рака Педжета
Характер лечения рака Педжета зависит напрямую от стадии развития болезни. На самых ранних этапах возможно безоперационное лечение, которое включается в себя применение мазей на основе цитостатиков. Такой метод позволяет предотвратить размножение патологических клеток.
Но, к сожалению, заболевание часто диагностируется через несколько месяцев после его распространения в организме. В таком случае чаще всего применяется хирургическое вмешательство в виде радикальной мастэктомии. Такая операция подразумевает удаление молочной железы и лимфатических узлов.
Если болезни подвержен только сосково-ареолярный комплекс, при этом молочная железа остается здоровой, может быть проведена центральная сегментэктомия. Это хирургическая операция, которая позволяет удалить только сосок и часть околососковой зоны. Но это довольно редкий случай.
В большинстве случаев требуется послеоперационное лечение, которое в зависимости от степени тяжести заболевания, может включать в себя:
- Лучевую терапию;
- Химиотерапию;
- Гормональную терапию.
 Лучевая терапия рака Педжета
Лучевая терапия рака ПеджетаТакие меры необходимы не только для борьбы с симптомами рака, но и для профилактики возможного рецидива заболевания.
В положительных случаях, когда болезнь получилось победить и жизни женщины ничего не угрожает, допускается проведение пластических операций по восстановлению груди, реконструкции соска и ареолы. Дальнейший образ жизни пациент должен вести, согласно рекомендациям врачей. Одним из условий является соблюдение сбалансированной диеты.
Прогноз исхода рака Педжета
Никакой даже самый квалифицированный врач не сможет определить точный исход болезни. Прогноз же может основываться на многих факторах, включающих:
- Стадию заболевания;
- Возраст пациента;
- Наличие пораженных лимфатических узлов;
- Наличие пальпируемого узла и прочее.
Наилучший прогноз имеют пациенты, у которых рак был диагностирован на раннем этапе. При таком условии почти все случаи имеют положительный исход.
При более поздней стадии рака вероятность выздоровления может зависеть от вида заболевания.
В случае если болезнь не затронула молочную железу, а развитие раковых клеток наблюдается только в сосково-ареолярной зоне, процент положительного исхода значительно увеличивается и может достигать более восьмидесяти процентов. В случае поражения молочной железы этот показатель равен примерно шестидесяти процентам.
Рак Педжета молочной железы, как и другая онкологическая болезнь, является серьезным испытанием для организма, которое не всегда заканчивается положительно. Для профилактики заболевания рекомендуется соблюдать следующие меры:
- Здоровый образ жизни, отказ от вредных привычек;
- Регулярный медицинский осмотр;
- Здоровое питание, богатое белками.
Такие несложные методы позволят не только диагностировать заболевание на ранней стадии, но и снизить риск его возникновения в целом.
oonkologii.ru
рак инситу
Задайте вопрос | Рубрикатор | Все вопросыДмитрий Андреевич отправили блоки в Турцию пришел ответ:МИКРОСКОПИЯ: в ткани груди, в соединительной ткани, множественных протоках наблюдаются атипичные пролиферации. Они имеют твердую, решетчатую (сетчатую), микропапиллярную форму. Пролиферированные клетки в различных областях имеют различные характеристики, но наряду с этим ядрышки отчетливые, имеют вазикулярную хроматиновую структуру, указывающую на гиперхромию, нуклеомегалию, клетки эпителия атипичные, цитоплазмичные, с четким контуром, узкие. Во многих протоках зарегистрирован более отчетливый ядерный плеоморфизм с некрозом. ДИАГНОЗ: Дуктальная карцинома IN SITU. Комедокарцинома (приблизительно 70%), HIGH GRADE/ Подтипы: твердая, псевдорешетчатая, решетчатая, микропапиллярная (30%) Некроз: присутствует Микрокальцификация: присутствует В лимфоузлах метастазов не обнаружено (11 единиц) ПРИМЕЧАНИЕ: В ходе проведенного иммуногистохимического обследования большая часть областей тюморальной ткани окрашены позитивно с помощью Р63. Только в одной области тюморальные клетки диссоциированы в пределах стромы, которая частично наблюдается в жировой ткани. Так как данная область является окончанием ткани, ее продолжение не было видно. В данной области в рамках некоторых тюморальных фрагментов наблюдается окрашивание Р63. Наряду с тем, что данная область является артефактивной, есть сомнение по поводу инвазии в данной области. В результате, наряду с сомнительными очагами (микро) инвазий в тюморальных тканях, можно сделать вывод о наличии в морфологии дуктальной карциномы hıgh grade ın sıtu. Др.Нилгюн Дж.Оздемир Специалист по патологиям Что все это значит?
На вопрос отвечает: Красножон Дмитрий Андреевич, хирург-онколог, маммологЭто означает, что речь о раке in situ - начальной стадии рака молочной железы. Такая форма рака молочной железы является 0 стадией. Вам надо обсуждать все вопросы с лечащим врачом, который отправлял блоки на исследование.
www.krasnozhon.ru
Особенности инвазивной карциномы молочной железы
Онкологические заболевания среди представительниц слабого пола встречаются довольно часто. Среди таких болезней рак груди занимает ведущее место. Если патология диагностируется не на начальных стадиях развития, то говорят о таком заболевании, как инвазивная карцинома молочной железы. Такой диагноз ставится 80% больным женщинам. Он значит, что аномальные клетки распространились на пределы области, с которой они образовались, стремясь поразить жировую ткань и связки. Такая раковая опухоль является агрессивной, так как метастазы попадают в лимфатическую систему и разносятся на внутренние органы.
Описание рака молочной железы
Инвазивная карцинома – злокачественная патология молочных желез на поздних стадиях развития, которая образуется из клеток эпителия и прорастает внутрь органа, затрагивая со временем большие его объемы, лимфатические узлы, распространяет метастазы в кости, печень, головной мозг.
Обратите внимание! Данная форма ракового заболевания является агрессивной. Развивается оно из карциномы, о которой большой период времени женщина может не подозревать.
В онкологии принято выделять несколько типов данной патологии:
- Инвазивный протоковый рак (ИПР), характеризующийся образованием первых раковых клеток в молочных протоках, по которым у женщин при лактации поступает к соску молоко. Инвазивный протоковый рак молочной железы считается самым опасным, так как аномальные клетки склонны попадать в ток крови или лимфы и разноситься по организму. По мере роста раковая опухоль распространяется в зону около сосков, деформируя их и провоцируя патологические выделения. Этот тип карциномы подразделяется на подтипы:
- Высоко дифференцированный рак.
- ИПР промежуточный.
- ИПР низкой дифференцировки.
- Прединвазивная внутрипротоковая карцинома молочной железы, что формируется из аномальных клеток молочных протоков, но не склонна к распространению на соседние ткани. Патология может перейти в предыдущую форму.
- Инванзивный дольковый рак молочной железы обуславливается развитием опухоли в дольках железы в виде узлов, которые могут распространяться на вторую молочную железу. Данная патология наблюдается в 15% случаев.
- Инвазивная карцинома неспецифического типа (маммарный рак), который может быть представлен несколькими видами:
- Медуллярный рак, характеризующийся медуллярным строением, медленным распространением в соседние ткани и быстрым разрастанием в пределах собственного участка.
- Инфильтрирующий протоковый рак, что стремительно прорастает в ближайшие ткани и распространяет метастазы.
- Воспалительная карцинома характеризуется образованием в молочной железе уплотнения, окруженного покровной тканью красного оттенка.
- Опухоль Педжета, что локализуется в районе соска и ареола.
Обратите внимание! В большей части случаев все данные виды рака груди могут лечиться при помощи гормональной терапии с использованием эстрогена.
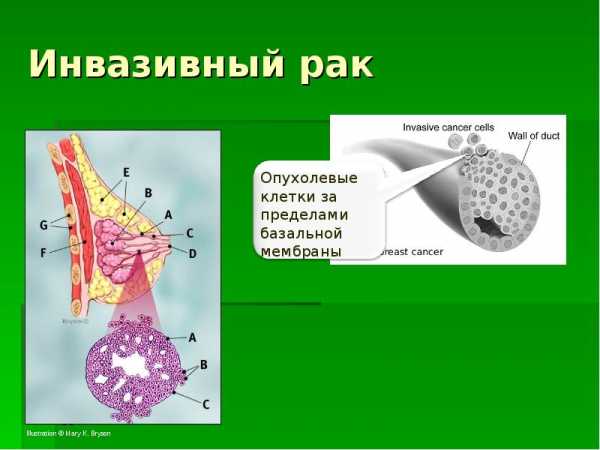
Причины развития инвазивной карциномы
В медицине не установлены точные причины, по которым развивается инвазивная карцинома груди. Принято только выделять некоторые факторы, влияющие на образование раковых клеток:
- Наследственность.
- Наличие в одной молочной железе неспецифического онкологического заболевания.
- Новообразование в груди доброкачественного характера (киста, фиброаденома, мастопатия).
- Воздействие радиации как естественной, так и в лечебных целях.
- Нарушение эндокринной системы (диабет, ожирение, гипертония).
- Прием гормональных препаратов в качестве контрацепции, гормональные нарушения.
- Особенности полового развития женщины (преждевременное созревание, бесплодие, ранняя менопауза и прочее).
- Искусственное прерывание первой беременности.
- Отсутствие грудного кормления.
- Хронические заболевания мочеполовой системы.
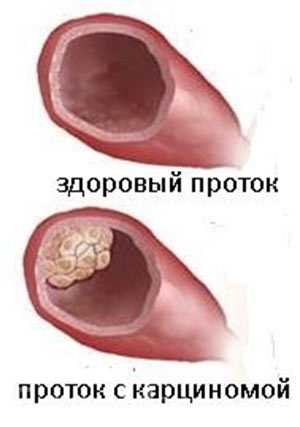
Стадии развития рака
Существует четыре степени злокачественности ракового заболевания у женщин:
- Первая стадия, на которой развивается инвазивная карцинома – злокачественное новообразование размером до двух сантиметров, что не распространяется в соседние ткани и не дает метастазов.
- Вторая стадия, когда образуется инвазивный протоковый рак – опухоль размером до пяти сантиметров, которая дает одиночные метастазы в лимфатические узлы.
- Третья стадия, на которой появляется инвазивная карцинома неспецифического типа G2 – средне дифференцируемая опухоль, что дает множественные метастазы в ближайшие ткани.
- Четвертая стадия характеризуется наличием раковой опухоли с распространенными по организму метастазами.
Симптомы и признаки онкологического заболевания
Длительное время симптомы и признаки заболевания не проявляются. Первые проявления патологии отмечается на поздних стадиях ее развития:
- образование уплотнения в молочной железе, которое не зависит от менструального цикла;
- изменение внешнего вида одной груди;
- образование кровянистых или светлых выделений из соска;
- изменение кожи на груди, появление морщин и шелушения;
- увеличение лимфатических узлов в области подмышек.
На поздних стадиях патология проявляет следующие признаки у женщины:
- отек ареолы, уплотнение соска;
- сморщивание некоторых участков груди;
- деформация молочной железы;
- развитие метастазов, которые можно обнаружить;
- болевые ощущения и чувство жжения в соске;
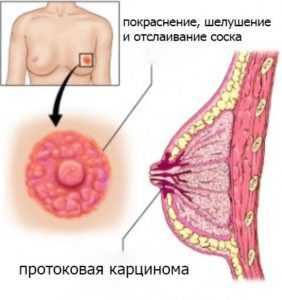
Обратите внимание! Рак груди может проявляться по-разному в зависимости от стадии развития патологии. На ранних стадиях женщины ничего не ощущают, дискомфорт может возникнуть при прощупывании груди.
К общим признакам заболевания можно отнести появление слабости и утомляемости, деформация кожных покровов, увеличение лимфатических узлов.
Диагностика патологии груди
Диагностика заболевания начинается с осмотра и исследования груди женщины. Пальпацию проводят в первые семь дней менструального цикла.
Обратите внимание! На ранней стадии патологии пальпация не дает возможности обнаружить раковую опухоль из-за ее незначительных размеров.
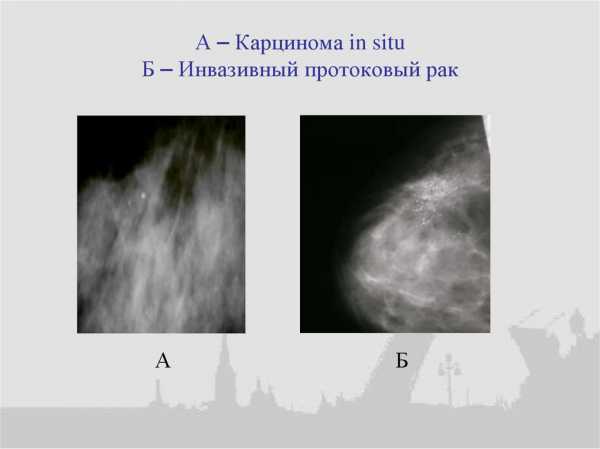
Врач назначает следующие методы диагностики:
- маммография;
- УЗИ груди;
- МРТ и КТ, ПЭТ;
- дуктография – рентген с использованием контраста,
- пневмокистография;
- пункция и биопсия.
Медики дифференцируют рак с такими заболеваниями, как мастопатия, аденома, мастит.
Лечение раковой опухоли
Рак груди предполагает использование различных методов лечения: оперативное вмешательство, лучевая и химиотерапия, гормональная или биологическая терапия. Выбор методов лечения зависит от постановки точного диагноза, наличия метастаз, степени злокачественности опухоли, ее размера.
Сначала врачи проводят гормональную терапию с использованием эстрогена с целью уменьшения размера новообразования, нарушения ее спаянности с соседними тканями. Затем хирург проводит операцию по иссечению раковой опухоли с частью здоровой ткани и пораженными лимфатическими узлами или проводится полное удаление молочной железы. После хирургического вмешательства используется химиотерапия. К полному удалению груди прибегают в случае наличия инвазивной карциномы третьей или четвертой степени злокачественности. После операции форму и объем железы восстанавливают с помощью метода эндопротезирования. Но часто после использования хирургического лечения женщины испытывают психологический дискомфорт. В запущенных случаях врач назначает паллиативное лечение, целью которого выступает облегчение жизни больного.
Прогноз
В зависимости от стадии развития рака прогноз может быть разным. На первой стадии протоковая карцинома молочной железы прогноз имеет благоприятный, эффективное лечение обеспечивает выживаемость в 90% случаев. На второй стадии патологии выживаемость достигает 65%, на третьей – 40%, на четвертой стадии – 10%. Снижает процент выживаемости наличие нескольких патологических новообразований, отека молочной железы и верхней конечности.
Профилактика
Возможность развития карциномы молочной железы существует для каждой женщины после сорока пяти лет. Профилактика патологии дает возможность снизить риск развития раковой опухоли. Врачи рекомендуют периодически проводить обследование груди у маммолога, вести здоровый образ жизни, своевременно лечить вирусные и инфекционные болезни, избегать стрессовых ситуаций, соблюдать здоровый рацион питания, не принимать гормональные средства без назначения врача, а также не допускать абортов и травмирования груди.
Особенности инвазивной карциномы молочной железы Ссылка на основную публикациюoncoved.ru