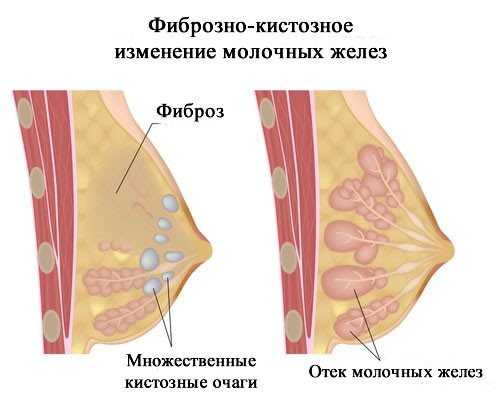
Отдаленные результаты лечения рака молочной железы
Отдаленные результаты
Поскольку летальность после оперативных вмешательств при раке молочной железы не превышает 0,1 — 0,5% (Холдин С. А., Дымарский Л. Ю., 1975), т. е. печальные исходы в определенной мере случайны, отдаленные результаты являются главным критерием для суждения об эффективности того или иного вида лечения злокачественных опухолей.
В середине 30-х годов статистические исследования привели к заключению, что пятилетний срок наблюдения можно считать достаточным для подсчета результатов, поскольку через этот срок процентное соотношение частоты рецидивов и отдаленных метастазов рака у леченых, по данным того времени, было идентично риску первичного заболевания среди здоровых женщин. В настоящее время пятилетний срок наблюдения при раке молочной железы, рекомендуемый в качестве критерия стойкого выздоровления, недостаточен. По данным Института онкологии, около 1/3 больных, погибших от рака этой локализации, умерли спустя 5 лет и более после окончания лечения, причем не представляют особой редкости случаи выявления отдаленных метастазов через 15—25 лет после мастэктомии. Это связано не только с улучшением учета и уточнением причин смертности населения, но и с успехами лечения, в частности, широким использованием дополнительных методов как компонентов комплексных воздействий. По данным Я. Л. Бавли и Л. Ю. Дымарского (1976), применение химиотерапевтических препаратов после мастэктомии отодвигает проявление рецидивов и метастазов в отдаленные органы на 2—3 года, а применение химиогормонотерапии при лечении больных генерализованными формами позволяет продлить жизнь больных на 18—26 мес.
Таким образом, правильнее говорить о клиническом выздоровлении, определенном в момент обследования, так как возможность проявления отдаленных метастазов или развития опухоли во второй железе практически остается вероятной в течение всей последующей жизни больной, леченной по поводу рака молочной железы. В то же время незыблемым остается правило исчисления отдаленных результатов от момента радикальной операции, а у неоперабельных больных — от начала лечения. Следует иметь в виду, что больные, не прослеженные в течение всего срока или умершие по неизвестной причине, условно причисляются к погибшим от рака. Наконец, не менее важной, чем правильность исчисления результатов, является необходимость стратификации больных. С этой целью предложена Международная классификация TNM. Сравнение результатов, полученных у больных, разделенных на группы по принципу размеров опухоли, наличия прощупываемых подмышечных узлов и определимых отдаленных метастазов, простое по выполнению и доступное специалистам любой квалификации, по мнению авторов предложенной классификации, позволяет добиться однородности и однотипности при расчетах. Однако большинство исследователей, в том числе и мы, остаются сторонниками изучения отдаленных результатов после получения сведений о гистологическом подтверждении изменений в лимфатических узлах. В таблице 13 приводятся пятилетние результаты лечения в ведущих онкологических клиниках, где подсчет результатов основан на гистологических данных.
Как видно, отдаленные пятилетние результаты находятся в прямой корреляции с распространенностью процесса, в частности с поражением метастазами регионарных лимфатических узлов.
По современным данным, при доклинических формах (ТО), пяти- и десятилетняя выживаемость (при отсутствии местных рецидивов и отдаленных метастазов) достигает 98% (Leis, 1977). В связи с этим ранняя и сверхранняя диагностика остается краеугольным камнем проблемы улучшения отдаленных результатов лечения.
Особо следует остановиться на отдаленных результатах лечения при применении после мастэктомии дополнительной химиотерапии, а также на значении расширенных операций при медиальных и центральных локализациях первичного очага. Эти вопросы относятся к дискутабельным, поэтому представляет интерес опыт Института онкологии (таблица 14).
Поскольку все остальные компоненты комплексного лечения у анализируемых групп больных были идентичными, применение расширенных вмешательств привело к улучшению отдаленных результатов главным образом у больных с подмышечными метастазами за счет удаления метастазов в парастернальном лимфатическом коллекторе. Наиболее демонстративно это проявлялось при одиночных поражениях как подмышечных, так и парастернальных узлов. Наоборот, применение расширенных вмешательств у больных с множественными метастазами в регионарных коллекторах не приводит к улучшению результатов и должно быть признано нецелесообразным.
Данные Института онкологии (Бавли Я. Л.) отчетливо показывают преимущества применения после мастэктомии дополнительной многокурсовой химиотерапии при всех стадиях рака. Остальные дополнительные мероприятия (гормонотерапия, лучевое лечение) у обеих групп больных были идентичными (таблица 15).
Пятилетние результаты лечения рака грудной железы у мужчин хуже, чем у женщин. Поскольку классифицирование их по стадиям не всегда возможно, придерживаются деления на больных с метастазами в регионарных лимфатических узлах и без них. По данным Crichlow (1977), при отсутствии метастазов в подмышечных узлах пятилетнее безрецидивное течение наблюдалось у 79% мужчин, а при поражении —у 28%, по данным Института онкологии (47 наблюдений) — соответственно у 61 и 30,5%.
Представленные выше материалы, отражающие в основном опыт Института онкологии, подтверждают прямую корреляцию отдаленных результатов с распространением первичной опухоли, поражением регионарных узлов и примененным лечением. Однако мы еще не располагаем убедительными данными о влиянии биологических механизмов на конечные результаты лечения. В последующие годы на основании представлений о патогенетических формах опухоли как показания, так и методы лечебных воздействий, очевидно, будут меняться в зависимости от конкретных эндокринных и обменных изменений организма, темпа и характера течения опухоли. Несомненно, что восстановление и стимуляция иммунозащитных механизмов повысят возможность достижения стойкого выздоровления при раке молочной железы.
www.medical-enc.ru
Отдаленные результаты лечения оккультного рака молочной железы
Выводы
1. АЭСДИ-ОМП позволят диагностировать все формы инвагинации кишечника у детей.
2. АЭСДИ-ОМП - безопасный способ диагностики и консервативного лечения кишечной инвагинации.
3. Применение АЭСДИ-ОМП позволяет полностью исключить лучевую нагрузку на пациента и медицинский персонал.
4. Автоматизация выполнения ОМП повышает достоверность диагностики инвагинации кишечника, создаёт удобства для выполнения манипуляции и позволяет фиксировать проводимые исследования на различных электронных носителях, что является неотъемлемым требованием доказательной медицины.
5. АЭСДИ-ОМП обеспечивает возможность контроля над расправлением инвагинации.
6. Применение прибора АЭСДИ-ОМП позволяет снизить пребывание на хирургической койке пациентов с инвагинацией кишечника более чем в 5 раз.
Список литературы
1. Акжигитов Г.Н., Шишкова Л.Г. Диагностика и лечение инвагинации кишок у детей // Советская медицина. - 1976. - № 9. - С. 86 -91.
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ ОККУЛЬТНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Т.В. Кукленко
ГБУЗ Челябинский областной клинический онкологический диспансер
Кукленко Татьяна Викторовна,
врач-онколог маммологического отделения ГБУЗ «ЧОКОД», 454087, Россия, г. Челябинск, ул. Блюхера, д. 42, тел. 8 (351) 232-78-77, e-mail: kuklek_t@mail.ru
Количество пораженных, метастазами лимфоузлов (ЛУ) у больных, раком молочной железы (РМЖ) является наиболее важным фактором, предсказывающим выживаемость пациентов. В данной статье приведен ретроспективный и проспективный анализ общей выживаемости, частоты отдаленного метастазирования и локального рецидивирования у 35 пациенток с диагнозом оккультного рака молочной железы (ОРМЖ), представленном подмышечными метастазами TxN1-2M0 (1 группа) и 150 пациентками с пальпируемым раком молочной железы (ПРМЖ) T1-3N1-2M0 с поражением подмышечных. ЛУ (2 группа), проходившим лечение в Челябинском областном клиническом онкологическом диспансере за период с 1997 по 2012 гг. Целью работы было сравнение отдаленных, результатов лечения больных, этих, групп для оптимизации лечебно-диагностической тактики при ОРМЖ. В результате исследования было установлено, что общая 5-летняя выживаемость, оцененная методом Каплана-Майе-ра, при ОРМЖ в подгруппе с N2 достоверно ниже, чем при ПРМЖ и составила 46,6% и 63,3% соответственно (р=0,02). Частота отдаленного метастазирования за 5-летний срок наблюдения у больных. 1 группы составила 66,6%, а у больных. 2 группы - 51,6% (р=0,04) в подгруппе с N2. Различия статистически достоверны. Таким образом, мы доказали более худший прогноз у больных. I группы, чем у II-ой в подгруппе с N2, что требует более агрессивной лечебной тактики у данной категории пациенток.
Ключевые слова: оккультный рак молочной железы, пальпируемый рак молочной железы, лимфоузлы, подмышечные метастазы, прогноз.
2. Андронеску А. Анатомия ребенка: Пер. с венг.
- Бухарест, 1970. - 360 с.
3. Ашкрафт К.У., Холдер Т.М. Детская хирургия: Пер. с англ. - СПб., 1997. - Т 2. - С. 93-97.
4. Долецкий С.Я., Исаков Ю.Ф. Детская хирургия. - М.: Медицина,1970. - 1071 с.
5. Изосимов А.Н. Значение объемно-манометрической пробы для диагностики и контроля над расправлением кишечной инвагинации у детей // Вестник Самарского государственного университета. - 2004. - №4(34). - С. 159-165.
6. Подкаменев В.В., Урусов В.А. Диагностика и лечение инвагинации кишечника у детей. - Иркутск, 1986.
7. Рошаль Л.М. Острый живот у детей. - Л., 1980.
- 184 с.
8. Фельдман Х.И. Инвагинация и эвагинация кишок в детском возрасте. - М.: Медицина, 1977. -156 с.
9. Филиппкин М.А., Левин М.Д. Диагностика и консервативное лечение инвагинации кишечника у детей // Вестник рентгенологии и радиологии. -1989. - №2. - С. 67-72.
THE LONG-TERM RESULTS OF OCCULT BREAST CARCINOMA
TREATMENT
T.v. kuklenko
Regional Oncological Dispensary
In breast cancer patients, axillary status continues to be the most powerful predictor of survival. This article contains retrospective and prospective analysis for 5-year survival, regional and distant recurrences of 35 patients with occult breast cancer (OBC) presenting as isolated axillary nodal metastasis TxN1-2M0 (I group) and 150 cases of node-positive palpable breast cancer (PBC) T1-3N1-2M0 (II group) during the period from 1997 to 2012 according the materials of Chelyabinsk regional oncology dispensary. The aim of this investigation is to compare prognoses of these groups patients after complex treatment to optimistic treating and diagnostic tactic of OBC. Five-year Kaplan-Meier estimate of overall survival among groups of our patients who had had lymph node metastasis status as N2 in I and II group had been allocated as 46,6% and 63,3% respectively (p=0,02). Five-year distant recurrences of disease among groups of our patients who had had lymph node metastasis status as N2 in I and II group had been allocated as 66,6% and 51,6% respectively (p=0,04). The differences observed between patients of these groups were statistically significant. The OBC prognosis is worse than PBC in N2 subgroup that demand more aggressive therapy for patients of I group.
Keywords: occult breast cancer, palpable breast cancer, lymph node, axillary lymph node metastasis, prognosis.
Актуальную проблему для исследователей представляет поиск эффективной лечебно-диагностической тактики и изучение прогноза у больных такой редкой формой рака молочной железы (РМЖ) как оккультный рак, который не выявляется ни клиническим, ни рентгенологическим методами диагностики, а представлен только подмышечными метастазами [2,3,5,12]. Несмотря на то, что оккультный рак молочной железы (ОРМЖ) остается редкой клинической формой с частотой возникновения от 0,3% до 2 %, диагностика и лечение больных с данной патологией представляет особенно трудную задачу, а прогноз остается неудовлетворительным [1,3,4]. Несвоевременная диагностика, позднее начало лечения, высокая вероятность раннего метас-тазирования при наличии первичного очага очень малых размеров, трудности дифференциальной диагностики, отсутствие единого лечебно-диагностического алгоритма объясняют растущий интерес исследователей к проблемам ОРМЖ [6,8,9,10,11]. В литературе мало данных по сравнению ОРМЖ с пальпируемым раком молочной железы (ПРМЖ) II-III стадий по критериям общей выживаемости, частоте отдаленного метастазирования и местного рецидивирования. При данной местнораспростра-ненной форме РМЖ число вовлеченных лимфатических узлов (ЛУ) более всего влияет на прогноз, хотя и большое значение имеет выбранная лечебная тактика [7,10,11]. Мы решили продолжить изучение этих вопросов на современном этапе времени, сравнить течение заболевания и прогноз у больных ОРМЖ с больными II-III стадиями ПРМЖ в рамках комбинированного и комплексного лечения.
Цель исследования
Оценить отдаленные результаты лечения ОРМЖ в сравнении с ПРМЖ для повышения эффектив-
ности лечебно-диагностической тактики при этой форме онкологического процесса.
Задачи исследования
1. Провести сравнительное исследование эффективности комбинированного и комплексного лечения больных ОРМЖ и ПРМЖ II-III стадии с поражением подмышечных ЛУ N1 или N2 по показателям общей выживаемости, частоте отдаленного метастазирования и местного рецидивирования.
2. Оптимизировать лечебно-диагностическую тактику при ОРМЖ.
Материалы и методы
Исследование выполнялось в ГБУЗ «Челябинский областной клинический онкологический диспансер» (ЧОКОД) на базе кафедры онкологии, лучевой диагностики и лучевой терапии ГБОУ ВПО «Южно-Уральский государственный медицинский университет» в период с 2006 г. по 2012 г. Материалом, послужившим основой настоящей работы, было ретроспективное и проспективное исследование результатов лечения пациенток с пальпируемыми и непальпируемыми формами РМЖ II-III стадии с поражением подмышечных ЛУ N1 (поражение 1-3 ЛУ) или N2 (поражение 4 - 9 ЛУ), проходившим лечение в ЧОКОД с 1997 по 2012 годы. Группы составлялись методом сплошной выборки. Таким образом, в I группу вошли 35 больных ОРМЖ, характеризующимся односторонним метастатическим поражением подмышечных ЛУ при невыявленном клинически и рентгенологически первичном очаге в молочной железе - TxN1-2M0. II группа была сформирована из 150 больных пальпируемыми формами РМЖ II и III стадии с поражением подмышечных ЛУ - T1-3N1-2M0. Основным параметром, объединяющим и разделяющим эти две группы, стал об-
щий для этих групп критерий N так как сравнение по величине первичного очага невозможно из-за его отсутствия в I группе. Сравнительный анализ проводили с учетом этих подгрупп. Сравниваемые группы были сопоставимы по всем основным показателям: стадии заболевания, возрасту, гистологическому строению опухолей молочных желез, особенности онкологического и соматического статуса, объему оперативных вмешательств, вариантам комбинированного и комплексного лечения. Это позволило считать группы идентичными и явилось основанием для проведения сравнительного исследования.
Распределение больных по возрасту отражено в таблице 1.
Таблица 1
Возрастные группы больных РМЖ
Возраст 30-39 40-49 50-59 60-69 70-79 всего
1 группа 1 8 14 10 2 35
2 группа 15 42 52 36 5 150
Всего 16 50 66 46 7 185
Распределение больных по количеству пораженных ЛУ представлено в таблице 2.
Таблица 2
Распределение больных обеих групп по критерию N
Группы больных Объем регионарного метастазирования Всего
N1 N2
I группа 20 (57%) 15 (43%) 35
II группа 90 (60%) 60 (40%) 150
Гистологическое строение первичных опухолей молочных желез представлено в таблице 3.
Таблица 3
Морфологическое строение опухолей молочных желез больных сравниваемых групп
Морфологический вариант первичной опухоли молочной железы Группы больных Всего
I II
Протоковый рак 18 (72 %) 131 (87,3 %) 149 (85,1 %)
Медуллярный рак 3 (12 %) - 3 (1,7 %)
Дольковый рак 4 (16 %) 16 (10,6 %) 20 (11,4%)
Недифференцированный рак - 3 (2,0 %) 3 (1,7%)
Итого 25 150 175
В I группе данному исследованию подвергли только 25 опухолей, так как в 9 случаях первичный очаг не был выявлен даже на препарате. Пациентки обеих групп проходили комбинированное либо комплексное лечение. Варианты лечебной тактики представлены в таблице 4.
Таблица 4
Виды лечебной тактики больных сравниваемых групп.
Группы больных Виды лечения больных сравниваемых групп Всего
хирургический комбинированный комплексный
I - 4 (11,4%) 31 (88,5%) 35
II - 33 (22,0%) 117 (78,0%) 150
Итого - 37 148 185
Частота использования различных объемов хирургического лечения представлена в таблице 5.
Таблица 5
Объемы хирургического лечения больных сравниваемых групп
Группы больных Объем хирургического лечения Всего
мастэк-томия по Холсте-ду-Май-еру мастэк-томия по Пейти мастэк-томия по Маддену орга-но-сохра-няющие методики
I 1 (2,8%) 20 (57,0 %) 11 (31, 4 %) 3 (8,57 %) 35
II 16 (10,6 %) 61 (40,6 %) 30 (20,0 %) 43 (30,6 %) 150
Итого 17 81 41 49 185
Пациенткам сравниваемых групп в большинстве случаев проводили полихимиотерапию как необходимое системное лечение при местнорас-пространенном РМЖ. Мы использовали следующие схемы лечения: CMF, CАF, АС. Частота использования различных схем системной терапии, а также гормонотерапии представлена в таблице 6.
Таблица 6
Схемы системной терапии РМЖ в сравниваемых группах
Схемы лечения I группа П = 31 II группа п = 117 Всего
Лечение по схеме CMF 19 93 112
Лечение по схеме CАF/ АС 12 24 36
Гормонотерапия 13 77 90
В плане комбинированного лечения больных обеих групп проводилась гамма-терапия в режиме динамического фракционирования дозы до СОД 40-50 Гр в случае поражения трех и более подмышечных ЛУ. В I группе 29 (82%) человек прошли данный вид лечения, а во II - 111 (74%).
Результаты и обсуждение
Результаты лечения оценивались по показателям 5-летней выживаемости, частоте отдаленного метастазирования и локального рецидивирования.
Изучение данных показателей проводили с учетом зависимости от критерия N. Медиана наблюдения составила 43 месяца.
Таблица 8
Показатели 5-летней выживаемости пациенток сравниваемых групп после лечения (под-
группа N1)
Сроки наблюдения Сравниваемые группы Всего
I группа п=20 II группа п = 90
1 год 20 (100%) 90 (100%) 110 (100%)
3 года 19 (95%) 86 (95%) 105 (95%)
5 год 18 (90%) 64 (71%) 82 (74%)
Примечание: в таблицах 8 -13 использовались точный критерий Фишера (односторонний его вариант) и критерий хи-квадрат. Р -достоверность отличий между показателями основной группы и группы сравнения
В таблице 8 представлены цифры 1-, 3- и 5-летней выживаемости больных исследуемых групп в подгруппе с N1, где видно, что выживаемость в обеих группах равномерно снижалась за 5-летний промежуток времени. Исследование проводилось по методу Каплана-Майера. При сопоставлении данных таблицы 8 не установлено статистически значимых различий в показателях выживаемости сравниваемых групп (р>0,05). По такому же принципу был проведен анализ выживаемости пациенток исследуемых групп, у которых степень метастазирования в подмышечные ЛУ расценена как N2 - таблица 9.
Таблица 9
Показатели 5-летней выживаемости пациенток сравниваемых групп после лечения (под-
группа N2)
Сроки наблюдения Сравниваемые группы Всего
I группа п=15 II группа п=60
1 год 15 (100%) 60 (100%) 75 (100%)
3 года 14 (93,3%) 49 (81,6%) 63 (84%)
5 лет 7 (46,6%); Р = 0,02 38 (63,3%) 45 (60%)
При сравнительном анализе данных таблицы 9 не установлено статистически значимых различий в показателях годичной и 3-х летней выживаемости пациенток изучаемых групп. Установлено более резкое снижение показателя выживаемости в I группе в интервале с 3-х до 5-ти лет: с 93,3% до 46,6% в сравнении со II группой, где данный показатель снизился с 81,6% до 63,3% за тот же интервал времени. Таким образом, при анализе выживаемости больных обеих групп было установлено, что у больных I группы на пятилетнем сроке наблюдения происходит достоверное снижение данного показателя в подгруппе N2 в сравнении со II группой - 46,6% и 63,3% соответственно (Р=0,02).
Также был проведен анализ показателя отдаленного метастазирования на 1-ом, 3-ем и 5-ом
году наблюдения у больных обеих групп как при регионарном метастазировании, соответствующем N1, так и N2. Результаты исследования представлены в таблицах 10 и 11.
Таблица 10
Частота отдаленных метастазов в сравниваемых группах после лечения (подгруппа N1)
Сроки наблюдения Сравниваемые группы Всего
I группа п=20 II группа п = 90
1 год 0 4 (4,4%) 4 (3,6%)
3 года 3 (15%) 26 (28,8%) 29 (26,3%)
5 лет 5 (25%) 30 (33,3%) 35 (31,8%)
Как видно из таблицы 10, частота отдаленных метастазов у пациенток изучаемых групп в подгруппе с N1 увеличивалась к пятилетнему сроку наблюдения. Во II группе наибольшее число метастазов выявлено на сроке от 1 до 3-х лет. Несмотря на тенденцию к увеличению этого показателя у больных II группы в течение первых трех лет наблюдения, нами не было выявлено статистически достоверного различия в частоте данного показателя к 5-ти годам наблюдения. По такому же принципу проанализирована частота отдаленного метастазирования в исследуемых группах с регионарным метастазированием N2. В I группе наибольшее число случаев с метастазами пришлось на интервал с 3-х до 5-ти лет. Данный показатель возрос с 20% до 66,6% к 5-ти годам наблюдения. Во II группе наибольшее количество случаев с отдаленными метастазами пришлось на интервал с 1 до 3 лет. Эти данные представлены в таблице 11.
Таблица 11
Частота отдаленных метастазов в сравниваемых группах после лечения (подгруппа N2)
Сроки наблюдения Сравниваемые группы Всего
I группа п=15 II группа п=60
1 год 0 13 (21,6%) 13 (17%)
3 года 3 (20,0%) 30 (50,0%) 33 (44%)
5 лет 10 (66,6%); Р = 0,04 31 (51,6%) 41 (54%)
При сравнительном анализе данных таблицы 11 не было установлено статистически значимой разницы в показателях отдаленного метастазирования на сроках 1 и 3 года наблюдения у больных обеих групп в подгруппе с N2. Однако, к 5 годам наблюдения было выявлено статистически значимое увеличение этого показателя в I группе в сравнении со II - 66,6% и 51,6% соответственно (Р=0,04).
Также был проведен анализ частоты локального рецидивирования у больных обеих групп. За пятилетний период наблюдения за группой больных ОРМЖ с регионарным метастазированием, соответствующим N1, не выявлено ни одного случая локального рецидива. В группе же сравнения максималь-
КЯвати1н9я1ницуРпия1и18нкоВВпиЯ
опыт ЛЕЧЕБНЫХ УЧРЕЖДЕНИИ
ное количество рецидивов пришлось на интервал с 3 до 5 лет. Эти данные представлены в таблице 12.
Таблица 12
Частота локальных рецидивов в сравниваемых группах с регионарным метастазировани-ем N1 после лечения
Сроки наблюдения Сравниваемые группы
I группа n=20 II группа n=90 Всего
1 год 0 0 0
3 года 0 5 (5%) 5
5 лет 0 5 (5%) 5
При сравнительном анализе данных таблицы 12 не обнаружено статистически значимых различий в частоте возникновения локальных рецидивов заболевания у больных обеих групп за 5-ти летний срок наблюдения (р>0,05). Аналогично проведен анализ частоты локальных рецидивов в исследуемых группах за пятилетний период наблюдения в подгруппе с N2. Эти данные отражены в таблице 13.
Таблица 13
Частота локальных рецидивов в сравниваемых группах с регионарным метастазировани-ем N2 после лечения
Сроки наблюдения Сравниваемые группы
I группа n=15 II группа n=60 Всего
1 год 0 1 (1,6%) 1
3 года 0 1 (1,6%) 1
5 лет 0 1 (1,6%) 1
Сравнительный анализ данных таблицы 13 не выявил статистически значимого различия в частоте возникновения локальных рецидивов заболевания у больных обеих групп (р>0,05).
ОРМЖ - довольно редкая клиническая форма рака, и поэтому в исследование вошло небольшое количество больных, что повлияло на статистическую обработку данных. В дальнейшем планируется продолжить исследование с увеличением времени наблюдения и количества больных.
Выводы
1. Пятилетняя выживаемость больных I группы (подгруппа с N2) составила 46,6%, а больных II группы в данной подгруппе достоверно выше -63,3% (Р=0,02).
2. Частота отдаленного метастазирования у больных I группы (подгруппа с N2) составила 66,6%, а у больных II группы в данной подгруппе достоверно ниже - 51,6% (Р=0,04).
3. Полученные нами результаты свидетельствуют о том, что статистически значимые различия в частоте отдаленного метастазирования и пятилетней выживаемости больных ОРМЖ в подгруппе с N2 в сравнении с аналогичной подгруппой больных ПРМЖ отра-
жают более агрессивную и злокачественную природу данной формы РМЖ, что диктует необходимость выполнения более полного локорегионального контроля у этой группы больных с выполнением мастэкто-мии и подмышечной лимфаденэктомии I-III уровня. При этом органосберегающие операции в сочетании с лучевой терапией возможны при выявлении первичного очага в молочной железе на предоперационном этапе и только в подгруппе с N1 с выполнением подмышечной лимфаденэтомии I-II уровня, так как апикальные ЛУ (III уровень) будут не доступны из ак-силлярного доступа, используемого при органосбе-регающих операциях на молочной железе.
4. Необходимо проведение более агрессивных схем полихимиотерапии и адекватной гормонотерапии для улучшения прогноза у этих больных.
Список литературы
1. Комаров И.Г., Комов Д.В. Метастазы злокачественной опухоли без выявленного первичного очага. - М.: «Триада-Х», 2002. - С. 37-55.
2. Blanchard D. Retrospective study of women presenting with axillary metastases from occult breast carcinoma / D. Blanchard, D. Farley // World J. Surg. -2004. - Vol. 28. - P. 535-539.
3. Presentation of axillary lymphadenopathy without detectable breast primary (T0N1b breast cancer): experience at Institut Curie / F. Campana, A. Fourguet, M. Ashby et al. // Radiother Oncol. -1989. -Vol. 15. - P. 321-325.
4. Foroudi F. Occult breast carcinoma presenting as axillary metastases / F. Foroudi, K.W. Tiver // Int. J. Radiat. Oncol. Biol. Phys. - 2000. - Vol. 47. - P. 143-147.
5. Clinical experience with axillary presentation breast cancer / V. Galimberti, G. Bassani, S. Monti et al. // Breast Cancer Res. Treat. - 2004. Vol. 88. - P. 43-47.
6. Hainsworth J. Management of patients with cancer of unknown primary site / J. Hainsworth, F. Greco // Oncology. 2000. Vol. 14. P. 563-579.
7. Clinicopathological characteristics of non-palpable breast cancer presenting as axillary mass / T. Kyokane, S. Akashi-Tanaka, T. Matsui et al. // Breast Cancer. - 1995. - Vol. 2. - №2. - P. 105-112.
8. Cancer of unknown primary: changing approaches. A multidisciplinary case presentation from the Toan Karnell center of Pennsylvania Hospital / D. Mintzer, M. Warhol, A. Martin et al. // The Oncologist. - 2004. - Vol. 9. - №3. - P. 330-338.
9. Occult primary breast carcinoma presenting as axillary lymphadenopathy / C. Shannon, G. Walsh, F. Sapunar et al. // Breast. 2002. - Vol. 11. - P. 414-418.
10. Prognosis of occult breast carcinoma presenting as isolated axillary nodal metastasis / R. Varadarjan, S. Edge, J. Yu et al. // Oncology. - 2006. - Vol. 71. - P. 456-459.
11. Feasibility of breast preservation in the treatment of occult primary carcinoma presenting with axillary metastases / G. Vlastos, M. Tean, A. Mizza et al. // Ann. Surg. Oncol. - 2001. - Vol. 8. - P. 425-431.
12. Population-based analysis of occult primary breast cancer with axillary lymph node metastasis / G. Walker, G. Smith, G. Perkins et al. // Cancer. 2010. -Vol. 116. - P. 4006-4006.
21
cyberleninka.ru
Комбинированный метод лечения
Комбинированный метод лечения, который начинают применять в основном со IIб стадии, слагается из хирургического вмешательства и последующей химиотерапии по различным схемам. Такое лечение не повышает показатели 5-летней выживаемости, которая, как видно из данных, представленных в таблице, составляет 72,5%.
Отдаленные результаты лечения больных раком молочной железы в зависимости от примененного метода
| Метод | Число больных | Из них прожили | |||||
| 1 год | 3 года | 5 лет | |||||
| абс. | % | абс. | % | абс. | % | ||
| Хирургический | 201 (I — IIа) стадия | 201 | 100 | 201 | 100 | 181 | 90,2 |
| Комбинированный | 131 (IIб) | 131 | 100 | 120 | 91,6 | 95 | 72,5 |
| Комплексный | 582 (III) | 513 | 88,2 | 424 | 72,8 | 249 | 42,9 |
| Всего | 914 | 845 | 92,4 | 745 | 81,5 | 525 | 57,4 |
При использовании комплексного метода лечения, который в основном применяют при III стадии заболевания, 5-летняя выживаемость составляет 42,9%.
Как было показано выше, проведение предоперационного облучения по радикальной программе на фоне химиотерапии и выполнение в последующем операции (радикальная мастэктомия по Пейти) с адъювантной химио- и гормонотерапией является методом выбора при лечении этой категории больных.
Следует отметить, что выбор метода гормонотерапии должен основываться на результатах исследования рецепторов стероидных гормонов в опухоли, проведенного до начала лечения и в динамике.
Новым подходом к лечению этих больных является применение антиэстрогенных препаратов (тамоксифена) при менопаузе длительностью более 5 лет и наличии положительных рецепторов стероидных гормонов в опухоли.
Исследование опухолевых маркеров, в частности раково-эмбрионального антигена (РЭА), в динамике после окончания первичного лечения позволяет получить чрезвычайно важную информацию, используя которую, можно задолго до клинических проявлений рецидивирования и метастазирования выявить и успешно лечить этот процесс.
Наиболее действенным и разработанным методом лечения больных с рецидивами и метастазами следует признать лекарственную терапию в режиме полихимиотерапии.
Химиотерапия была проведена 370 больным метастатическим раком молочной железы. Средняя продолжительность жизни больных, получавших комбинированную химиотерапию с адриамицином, у которых был достигнут выраженный лечебный эффект, составила 13,2 мес, лечившихся без адриамицина — 9,5 мес.
Наиболее эффективна лекарственная терапия при метастазах в мягких тканях и лимфатических узлах: 3-летняя выживаемость составила 42,1%. Отдаленные результаты у больных, лечение которых сопровождалось объективным эффектом (первая группа), значительно лучше, чем у тех, у кого не получено эффекта (вторая группа). 1 год прожили 100% больных первой группы и только 38% — второй.
При лечении метастазов в костях с помощью комплексного метода, включающего длительное гормональное воздействие и лучевую терапию, у 86,8% удалось получить лечебный эффект, при этом 3-летняя выживаемость составила 24%, 5-летняя — 11,1%.
Средняя продолжительность жизни больных, получавших только гормонотерапию, составила 28,2 мес, при сочетании гормонотерапии с облучением метастатических очагов — 30 мес, при комплексной терапии, включающей облучение гипофиза, — 20,8 мес.
При комбинированной химиотерапии с включением адриамицина на фоне гормонотерапии средняя продолжительность жизни больных, у которых был достигнут лечебный эффект, была наибольшей — 38,6 мес.
При различных методах лечения рака молочной железы у мужчин 5-летняя выживаемость составила 51,6%. Это обусловлено тем, что почти у 25% больных были опухоли I — IIа стадии.
«Лечение опухолей молочной железы»,Н.Н.Трапезников, В.П. Летягин
www.medchitalka.ru
Материалы конгрессов и конференций
ОРГАНОСОХРАНЯЮЩИЕ МЕТОДЫ ЛЕЧЕНИЯ БОЛЬНЫХ ПЕРВИЧНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
(СОСТОЯНИЕ И ПЕРСПЕКТИВЫ РАЗВИТИЯ)
В.П. Летягин ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
В России злокачественные опухоли молочной железы были обнаружены в 2000 г. у 44840 пациенток (38,24 на 100 тыс. населения). Диагноз морфологически верифицирован в 93% случаев. У 60,3% пациенток был рак молочной железы (РМЖ) I-II стадии, у 26,1% - III стадии, у 12,4% - IV стадии.
Наиболее высокие уровни заболеваемости и темпы прироста показателей в 2000 г. отмечены в возрастных группах 60-64 и 75 лет и старше: 134,6 и 137,68 на 100 тыс. населения соответственно. Эти показатели увеличились в указанных возрастных группах по сравнению с 1991 г. в 1,5 и 1,95 раза соответственно.
Стандартизованный показатель смертности женщин от злокачественных новообразований молочной железы вырос с 1991 по 2000 гг. на 17,29% и составил в 2000 г. 17,24 на 100 тыс. населения. Среднегодовой темп прироста - 1,79%.
Наибольший повозрастной показатель смертности женского населения от злокачественных новообразований молочной железы наблюдается в возрастных группах 75-79 и 80-84 лет - 88,87 и 89,35 на 100 тыс. соответственно.
В 2000 г. в России находилась под наблюдением 353201 больная РМЖ, из них 5 лет и более – 190030 женщин. Средний показатель 5-летней выживаемости при данной патологии в России равен 55%. Следует подчеркнуть «значительное постарение» РМЖ и относительно неплохие отдаленные результаты (1).
Различия в течении заболевания у разных пациентов обусловлены биологическими особенностями опухолей.
Определение прогноза любого онкологического заболевания, включая и РМЖ, предполагает по существу идентификацию маркеров, которые в той или иной степени связаны с перечисленными биологическими особенностями опухоли и позволяют прогнозировать развитие «естественной истории», подбирать оптимальную лечебную тактику и предсказывать ее эффективность.
Наиболее значимые прогностические параметры для больных РМЖ:
- размер опухоли;
- наличие метастазов в регионарных лимфатических узлах;
- гистологическая степень злокачественности;
- уровень рецепторов стероидных гормонов (эстрогенов и прогестерона);
- маркеры активности синтеза ДНК:
- индекс метки;
- фракция S-фазы;
- активность тимидинкиназы;
- Ki-67;
- плоидность или индекс ДНК;
- рецепторы факторов роста или регуляторов роста, включая онкогены:
- рецепторы эпидермального фактора роста (EGF-R);
- HER2/nеu;
- рецепторы инсулиноподобного фактора роста (IGF-R);
- рецепторы к соматостатину;
- опухолевосупрессорные гены:
- другие изучаемые параметры:
- heat-shock protein (hsp27);
- pS2;
- протеин, связанный с гаптоглобином;
- трансформирующий фактор роста альфа;
- катепсин D;
- активаторы плазминогена урокиназного типа;
- способность к колонеобразованию in vitro;
- концентрация в тканях ферритина;
- экспрессия рецепторов ламинина;
- белок, связывающий цАМФ;
- NRCR 11 (2, 3)
Практически выбор метода лечения определяется стадией опухолевого процесса, гистологической структурой опухоли (и степенью ее злокачественности), уровнем рецепторов стероидных гормонов (эстрогенов и прогестерона).
Наряду с традиционным особое место отводится иммуноморфологическому стадированию РМЖ.
В основе метода иммунодиагностики метастазов лежит специфика экспрессии ряда генов, присущая только эпителиальным клеткам. Экспрессия эпителиальных генов может быть установлена также на уровне мРНК методом обратной транскрипции и полимеразной цепной реакции (ПЦР).
Чувствительность иммуноморфологических методик с использованием моноклональных антител (МКА) и чувствительность ПЦР примерно одинакова, но значительно превышает чувствительность морфологических методов (4).
Условием успешного оперативного лечения РМЖ является правильное установление стадии заболевания. При начальных стадиях процесса хирургический метод остается основным и наиболее эффективным. При применении же комплексной терапии операция остается важнейшим звеном при лечении РМЖ. В последние годы в связи с внедрением восстановительных операций требования к оперативному вмешательству еще более повысились. Операции должны проводиться с минимальной травматизацией тканей при соблюдении всех принципов радикализма.
Совершенствование методов лечения РМЖ ведет к уточнению показаний к различным видам оперативного вмешательства. Основным критерием является степень распространенности процесса и возможность сочетания хирургического метода с другими. В широкой онкологической практике можно выделить следующие варианты оперативных вмешательств.
В 1891 г. W. Halsted впервые опубликовал результаты предложенного им оперативного вмешательства. Почти одновременно с ним W. Меуег в 1894 г. представил свой опыт использования аналогичной операции. Так возникла и затем сложилась классическая операция по Halsted-Meyer, которая в течение длительного времени была основной в хирургическом лечении РМЖ.
В 1948 г. D. Patey и W. Dyson предложили свой вариант радикальной операции, который предусматривал сохранение большой грудной мышцы. При выполнении этого вмешательства в комбинации с облучением результаты лечения были такими же, как и при операции по Холстеду.
Следующим этапом в развитии щадящих методик операции было предложение J. Madden (1965) удалять лимфоузлы подмышечной межпекторальной области в едином блоке с молочной железой, сохранив обе грудные мышцы.
С 90-х гг. XX века впервые в отечественной практике в клинике опухолей молочных желез в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России выполняется модифицированный вариант радикальной мастэктомии с сохранением большой и малой грудных мышц:
- при ранних стадиях РМЖ в качестве самостоятельного метода лечения;
- при местно-распространенных формах РМЖ - после предварительной неоадъювантной химиолучевой терапии.
Мастэктомия - это удаление молочной железы с фасцией большой грудной мышцы. Данный тип операции применяется либо как паллиативное мероприятие при изъязвлениях, распадающихся опухолях, либо при противопоказаниях к радикальной мастэктомии в связи с сопутствующими заболеваниями, возрастом и т.д.(2, 3, 5).
Радикальная резекция молочной железы. Операция заключается в удалении сектора молочной железы в одном блоке с лимфатическими узлами надключично-подмышечно-подлопаточной зоны.
В настоящее время в широкую клиническую практику вошли оперативные вмешательства меньшего, чем радикальная резекция, объема. Это - туморэктомия, лампэктомия, которые используются при ранних стадиях РМЖ, когда достаточно велики размеры самой молочной железы, а границы резекции проходят, отступя 1 см от видимого края опухоли. При этом необходимо подчеркнуть два обязательных обстоятельства: рентгенологический контроль удаленного препарата и обязательное срочное гистологическое исследование краев резекции. Выполнение этого типа операции возможно только при отсутствии указаний на поражение краев разреза.
Тенденция к сокращению объема операций на молочной железе коснулась и лимфодиссекции при ранних стадиях РМЖ. В этой связи В.М. Cabanas и др. выдвинул концепцию «сторожевого» лимфатического узла, куда в первую очередь осуществляется лимфоотток из пораженного участка. Узел является своеобразным фильтром для опухолевых клеток и, таким образом, первым поражается метастазами. Для определения возможных путей лимфогенного метастазирования и «сторожевых» лимфоузлов применяются лимфотропный РФП (99mТе «Наноцисс»), обзорная сцинтиграфия с использованием компьютерного гамма-томографа и портативного гамма сканера C-TRAC (Arrow-Medical, США), состоящего из датчика-щупа и счетной камеры. А для визуализации «сторожевых» лимфатических узлов применяется синий краситель, вводимый в несколько точек по периметру опухоли за 1 ч до оперативного вмешательства. В последующем выполняется морфологическое исследование удаленных лимфоузлов с изготовлением парафиновых блоков, окрашенных гематоксилин-эозином, причем «сторожевые» лимфатические узлы исследуются на 10 срезах, а все остальные - с изготовлением 3 срезов с каждого лимфоузла. Истинно-положительным считается результат, при котором в «сторожевом» лимфатическом узле выявляли метастазы рака; истинно-отрицательным - при котором ни в «сторожевых», ни в других лимфоузлах метастатического поражения не обнаружено. Точность и чувствительность метода составляет 96,8% и 93,2% соответственно. В результате методика позволяет значительно сократить объем оперативного вмешательства на зонах регионарного метастазирования и может быть рекомендована для широкого применения (2, 3, 5, 8).
Проблема лучевой терапии при РМЖ чрезвычайно важна. Этот метод лечения, получивший широкое распространение, может применяться как самостоятельно, так и в сочетании с другими методиками. В ходе развития лучевой терапии постоянно менялись варианты и способы лучевого воздействия: от использования ортовольтовой рентгенотерапии до применения тормозного излучения и электронного пучка бетатронов и линейных ускорителей, от дополнительного к операции лечебного фактора до самостоятельного метода лечения и от строго локального метода рационального воздействия до опосредованного угнетения функции гипофиза с помощью протонного медицинского пучка.
Желание изучить непосредственные и отдаленные результаты лечения привело к идее сочетанного использования облучения и операции, т.е. комбинированного лечения.
Существует 3 метода комбинированного лечения:
- облучение в предоперационном периоде с последующим оперативным вмешательством;
- операция с последующей лучевой терапией;
- лучевая терапия, проводимая как до, так и после операции.
Облучение в предоперационном периоде с последующим оперативным вмешательством. При операбельных опухолях (T1-2N0M0 И T1N1M0) используется методика предоперационного облучения крупными фракциями первичной опухоли и подключично-подмышечной зоны в течение 5 дней до СОД 20 Гр. Вызывая гибель малодифференцированных и анаплазированных клеточных популяций и подавляя дополнительные участки злокачественного роста, а также микрометастазы в лимфоузлах и лимфатических сосудах, данная методика является оправданной с онкологических позиций и не осложняет хирургического вмешательства, проводимого в ближайшие 1-3 дня после окончания облучения.
Операция с последующей лучевой терапией. Адъювантное облучение после сохраняющих операций является наиболее частым вариантом применения послеоперационной лучевой терапии. В зону лучевого воздействия включаются молочная железа и ложе опухоли. РОД равняется 2 Гр, подводится 5 раз в неделю до СОД 50 Гр при помощи гамма-установки «Рокус» или линейного ускорителя. При наличии метастазов в регионарных лимфоузлах в зону облучения включается подмышечная зона.
Регионарные зоны рекомендуется облучать в следующих случаях:
- при медиальной локализации - облучение парастернального коллектора;
- в случае поражения >50% аксиллярных лимфоузлов и при неблагоприятных морфологических признаках, а также при центральной локализации опухоли - подмышечный и подключичный коллекторы.
Регионарные зоны облучаются до СОД 45 Гр. Начинать послеоперационную лучевую терапию рекомендуется не ранее 2-й и не позднее 5-й недели от момента выполнения оперативного вмешательства.
Основной задачей послеоперационного облучения молочной железы после сохранной операции является снижение числа местных рецидивов.
Дистанционная гамма-терапия в качестве самостоятельного метода лечения применяется достаточно редко.
Показания к консервативной лучевой терапии:
- абсолютные противопоказания к проведению оперативного вмешательства (пожилой возраст, тяжелая соматическая патология и т.д.);
- отказ больной от хирургического лечения;
- неоперабельная или отечно-инфильтративная форма РМЖ.
В данных случаях облучение производится в 2 этапа до СОД на опухоль молочной железы 60-70 Гр и 50 Гр — на зоны регионарного метастазирования.
Лучевая терапия является одним из важнейших компонентов комбинированного и комплексного лечения местно-распространенного РМЖ.
За исключением преинвазивных форм РМЖ, программа лечения строится из двух компонентов: локального, к которому относятся хирургическая операция или лучевая терапия, и системного, осуществляемого с помощью химио- и гормонотерапии (2, 3).
С этой точки зрения все формы РМЖ можно разделить следующим образом:
- неинвазивные карциномы (LCIS, DCIS) - стадия 0;
- операбельные инвазивные карциномы, к которым следует отнести РМЖ I-II и частично IIIA стадии;
- неоперабельные (при первичном обращении) инвазивные карциномы (некоторые формы IIIA и стадия IIIB);
- метастатические или рецидивирующие карциномы.
Отличительной чертой лечебных методов для больных раком молочной железы является все более широкое использование органосохраняющих операций, особенно у больных ранними стадиями. Стадия 0.
Внутридольковая инфильтрирующая карцинома (LCIS). Возможны несколько вариантов:
- наблюдение (т.к. риск развития инфильтративного рака является низким - около 21%, т.е. 7,8 на протяжении 15-летнего срока наблюдения). Прием тамоксифена на протяжении 5 лет обеспечивает снижение риска развития рака на 56% (National Surgical Adjuvant Breast and Bowel Project, NSABP);
- двухсторонняя мастэктомия с первичной маммопластикой, т.к. риск установления диагноза LCIS является одинаковым для обеих молочных желез.
Внутрипротоковая неинфильтративная карцинома (DCIS).
Также возможны несколько вариантов:
- радикальная мастэктомия с сохранением обеих грудных мышц (если имеется поражение нескольких квадрантов, опухоль на фоне микро- и макрокальцинатов и т.д.), возможно, с первичной маммопластикой;
- мастэктомия без лимфодиссекции (с предварительным удалением «сторожевого» лимфоузла при отсутствии его метастатического поражения), возможно, с первичной маммопластикой;
- радикальная резекция с последующей лучевой терапией;
- секторальная резекция (с исследованием «сторожевого» лимфатического узла) с последующей лучевой терапией (2, 6).
Стадии I, IIа, Iib.
Местное лечение. На сегодняшний день существуют два варианта хирургического вмешательства:
- радикальная мастэктомия с сохранением обеих грудных мышц (с возможной первичной маммопластикой);
- радикальная резекция с последующей обязательной лучевой терапией (оценка состояния подмышечных лимфатических узлов осуществляется путем исследования «сторожевых» лимфатических узлов).
Радикальная резекция невозможна при:
- центральной локализации опухоли;
- мультицентричном характере роста;
- у мужчин;
- заведомо неудовлетворительных косметических результатах;
- беременности.
Лечение рака молочной железы Т1N0М0
При центральной локализации и отказе больной от выполнения органосохраняющего вмешательства - радикальная мастэктомия с сохранением обеих грудных мышц с возможной первичной или отсроченной маммопластикой. При медиальной локализации обязательно использование видеоторакоскопической лимфодиссекции с последующим применением контактной или дистанционной лучевой терапии на парастернальную зону.
Во всех остальных случаях - радикальная резекция с последующей лучевой терапией.
При наличии неблагоприятных прогностических факторов у молодых менструирующих больных показано использование 6 курсов системной адъювантной химиотерапии (CAF). В менопаузальной группе при положительных стероидных рецепторах в опухоли возможно использование гормонотерапии 1-й линии (тамоксифен не менее 5 лет, а также фемары и других ингибиторов ароматазы). Гормонотерапия у молодых больных применяется после соответствующего воздействия на яичники (эндоскопическая или лучевая кастрация или использование золадекса)
Лечение больных Т2N0М0 (IIа стадия).
В ряде случаев, при опухолях размером >3 см возможно использование курса предоперационной лучевой терапии в режиме укрупненного фракционирования, либо нескольких (не менее 4) циклов неоадъювантной полихимиотерапии в целях возможного увеличения числа больных, которым может быть предложено органосохраняющее лечение.
Во всех остальных случаях тактика лечения сходна с таковой, применяемой при Т1N0М0 стадии первичного РМЖ.
Лечение больных Т1N1М0 (IIа стадия).
Лечение больных данной категории практически начинается с установления степени распространения опухолевого процесса по лимфатическим узлам на основании цитологических данных пунктата или при исследовании «сторожевого» лимфатического узла. Инициальным моментом комплексной терапии может быть крупно-фракционная лучевая терапия с последующим выполнением операции:
- при центральной локализации - радикальная мастэктомия с возможной первичной или отсроченной маммопластикой, а при медиальной локализации первичной опухоли – возможное использование видеоторакоскопической лимфодиссекции с последующим применением контактной или дистанционной лучевой терапии на парастернальную зону;
- радикальная резекция (при внутренней локализации опухоли - из двух разрезов с возможной видеоторакоскопической лимфодиссекцией). Курс послеоперационного облучения (брахитерапия иди дистанционный режим) обязателен. При метастатическом поражении 1-3 регионарных лимфатических узлов — 6 курсов полихимиотерапии (либо антрациклиновые комбинации, либо классический CMF). При поражении 4 и более регионарных лимфатических узлов - 4 цикла с антрациклинами с последующим использованием 8 циклов классического режима CMF. При положительных рецепторах эстрогенов в опухоли - тамоксифен 20 мг/сут в течение 5 лет (у молодых больных - после выключения функции яичников).
Лечение больных Т2N1М0 и Т3N0М0 (IIb стадия).
Лечебные мероприятия для данной категории больных, как и в предыдущих случаях, состоят из местного и общего воздействий.
В отличие от предыдущих стадий, рассчитывая на возможность выполнения органосохраняющего оперативного вмешательства, целесообразно проведение нескольких курсов неоадъювантной химиотерапии с антрациклинами (4 цикла) с последующей лучевой терапией или их комбинации вне зависимости от локализации первичной опухоли. Трепанобиопсия опухоли с целью получения материала для изучения рецепторов стероидных гормонов и некоторых других прогностических факторов производится до начала специфической терапии. Повторное изучение факторов прогноза в динамике проводится после выполнения оперативного вмешательства.
В ситуациях, когда первичная опухоль не превышает 3 см, лечение может быть начато с курса предоперационной лучевой терапии укрупненными фракциями или же с операционного этапа:
- радикальная мастэктомия с сохранением грудных мышц (при центральной локализации) с возможной видеоторакоскопической парастернальной лимфодиссекцией. Обязательным этапом адъювантного лечения следует считать лучевую терапию тем же самым способом на парастернальную зону. Возможна первичная или отсроченная маммопластика;
- радикальная резекция (при медиальной локализации операция выполняется из двух разрезов с возможной торакоскопической парастернальной лимфодиссекцией). Обязательно проводится послеоперационная лучевая терапия.
Адъювантная химиогормонотерапия проводится по тем же показаниям и в тех же режимах, что и при лечении предыдущих стадий болезни. Следует отметить, что весьма перспективным является адъювантное применение таксанов, особенно в комбинации с антрациклинами (ТАС).
Лечение больных местно-распространенным раком молочной железы III стадии.
Лечение местно-распространенного рака молочной железы складывается из 3 этапов:
- предоперационного (индукционного);
- местного (операция или лучевая терапия, или их сочетание);
- адъювантной терапии;
Такая тактика, общепринятая в настоящее время, сложилась не сразу. Исходно местно-распространенный рак был идентифицирован как иноперабельный.
Поэтому начинать лечение местно-распространенного рака как системной болезни следует с проведения индукционной системной и регионарной химиотерапии, что позволяет увеличить число оперированных больных, уменьшить частоту возникновения местных и отдаленных рецидивов и тем самым улучшить результативность лечения в целом.
Наиболее часто применяемые схемы химиотерапии: АС, FACVP, CMFA, CMFAV, AVCF, VAM, VCAF, CAMP, CAP или таксаны в комплексе с антрациклинами (AT, TAC). Считается, что на этапе индукции больная должна получить не менее 4-6 циклов химиотерапии (2, 8).
Вопрос комбинации неоадъювантной химиотерапии и лучевой терапии рассматривается неоднозначно. По общему мнению, предоперационное химиолучевое лечение обеспечивает наибольшую продолжительность жизни при РМЖ III стадии, а оптимальным является многокомпонентный подход к лечению (химиолучевое лечение + операция + химиогормонотерапия).
Основным типом оперативного вмешательства при этой стадии болезни является радикальная мастэктомия с сохранением обеих грудных мышц с возможной первичной, а лучше отсроченной маммопластикой. Однако успехи неоадъювантного этапа делают возможным выполнение органосохранных вмешательств, таких как радикальная резекция.
Адъювантная химиотерапия должна проводиться обязательно, и количество курсов должно быть не менее 6. Вопрос об использовании гормонотерапии 1-й линии (тамоксифен) решается традиционно: при положительном рецепторном статусе опухоли у молодых менструирующих женщин препарат назначается в стандартной дозировке не менее 5 лет после предварительной кастрации (оперативной, лекарственной или лучевой), у пожилых пациенток - без какого-либо воздействия на яичники или использование ингибиторов ароматазы – фемары (2, 3).
Паллиативные хирургические вмешательства.
У больных с местно-распространенным иноперабельным или метастатическим процессом по витальным показаниям (кровотечение или абсцедирование распадающейся опухоли) могут выполняться паллиативные оперативные вмешательства. Паллиативная операция, выполняемая у больной, не имеющей отдаленных метастазов, или при перспективах подавления диссеминированной болезни, по возможности должна носить все признаки радикальной операции. Совершенно не исключено, что после проведения адъювантного лечения первая пациентка окажется радикально излеченной, а второй будут подарены годы жизни.
Представленные выше стандарты лечения больных первичным раком молочной железы легли в основу лечения 7048 больных, находившихся под наблюдением ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России и затем прослеженных в отдаленные сроки с 1994 по 2000 гг. Распределение больных по стадиям представлено в табл. 1.
Таблица 1. Распределение больных по стадиям.
| I стадия | 1968 | 27,8 |
| II стадия | 3552 | 50,4 |
| III стадия | 1326 | 18,9 |
| IV стадия | 202 | 2,9 |
| Итого | 7048 | 100 |
Обращает на себя внимание факт преобладания больных с I и II стадиями заболевания (78,4%), что свидетельствует о несомненном повышении качества дооперационной диагностики. Это по всей вероятности связано с созданием федерального маммологического центра (директор - академик Харченко В.П.) и маммологического центра в г. Москве.
Распределение больных по видам лечения представлено в табл. 2.
Таблица 2. Распределение больных по видам лечения.
| Хирургическое | 1268 | 17,9 |
| Комбинированное | 3370 | 47,8 |
| Комплексное | 1876 | 26,7 |
| Консервативное | 534 | 7,6 |
| Итого | 7048 | 100 |
Обращает на себя внимание факт наиболее частого использования комбинированного (47,8%) и комплексного (26,7%) методов лечения, что указывает на широкое использование «консервативной хирургии», лучевой и лекарственной терапии. Снижение частоты использования чисто хирургического метода до 17,9% говорит о качественном подходе к лечению больных, позволяющих шире и обоснованно использовать лучевые и лекарственные методы, а также хирургический метод при паллиативном лечении больных, имеющих различного рода осложнения (изъязвления, распад, кровотечение и т.д.). Разработка чисто консервативных методов при распространенном опухолевом процессе и у пожилых пациентов с целым рядом сопутствующих заболеваний позволяет реальным образом помочь этой тяжелой группе онкологических больных.
Детальная характеристика хирургических видов лечения представлена в табл. 3.
Таблица 3. Распределение больных по видам лечения, включая операцию.
| Хирургическое | - | 967 77,1% | 301 22,9% | - | - | 1268 17,9% |
| Комби- нированное | - | - | 1345 39,9% | 2025 50,1% | - | 3370 47,8% |
| Комплексное | 18 49,8% | - | 1473 78,6% | 205 10,9% | 14 0,7% | 1876 26,7% |
| Итого | 18 42,8% | 967 14,7% | 3119 47,9% | 2230 34,2% | 14 0,3% | 6514 100% |
Обращает на себя внимание тот факт, что основными типами оперативных вмешательств в настоящее время являются радикальная мастэктомия с сохранением большой или обеих грудных мышц. В равной степени это относится и к комбинированному методу, при котором эти операции выполняются почти у 2/3 больных (78,6%). В комбинированном методе радикальные резекции составляют 50,1%, т.е. являются операцией выбора. Использование радикальной резекции в комплексном методе стало возможным только при использовании эффективных неоадъювантных методов, что удалось применить у 205 больных.
Отдаленные результаты лечения (5-летняя общая и безрецидивная выживаемости) в зависимости от стадии болезни представлены в табл. 4.
Таблица 4. Общая и безрецидивная 5-летняя выживаемость.
| I стадия | 89,1 | 80,9 |
| II стадия | 90,3 | 78,9 |
| III стадия | 65,9 | 40,5 |
Особый интерес представляют отдаленные результаты использования органосохраняющих оперативных вмешательств у больных III стадией заболевания. Эти данные представлены в табл. 5.
Таблица 5. Распределение больных по методам лечения и объему оперативного вмешательства.
| Хирургический | 5 | 2,2 | 4 | 1,8 |
| Комбинированный | 24 | 10,6 | 63 | 28,6 |
| Комплексный | 198 | 87,2 | 153 | 69,6 |
| Всего | 227 | 100 | 220 | 100 |
Повышение эффективности лучевой и лекарственной терапии позволяет существенно расширить возможности использования органосохраняющих операций не только при начальных стадиях РМЖ, но и при местно-распространенных T2-3NO-1MO, TO-3N1-2MO стадиях. Однако возможность выполнения органосохраняющих операций при местно-распространенном раке остается спорной. Практически не разработаны клинические и морфологические критерии отбора больных РМЖ T2-3NO-1MO, TO-3N1-2MO стадии для проведения органосохраняющего лечения. Не ясна роль неоадъювантной терапии при выполнении органосохраняющих операций у больных местно-распространенным РМЖ. Таким образом, необходима дальнейшая оценка возможности выполнения, а также роли и места органосохраняющих операций в комплексном лечении больных местно-распространенным РМЖ.
Среди анализируемых больных по радикальной резекции показатели общей 3- и 5-летней выживаемости составили 92,8+2,8% и 86,5±2,7%, при проведении радикальной мастэктомии - 85,4±3,6% и 81,3±4,0% (р>0,05). Безрецидивная выживаемость при 3- и 5-летнем сроке наблюдения при различном объеме оперативного вмешательства существенно не отличалась: при радикальной резекции - 77,3±3,2% и 68,8+3,4%, при радикальной мастэктомии - 73,9+4,6% и 71,2±4,7% (р>0,05). Частота местного рецидивирования в группе органосохраняющего лечения была несколько выше (4,0%), чем в группе радикальных мастэктомии (2,0%). Наиболее часто местные рецидивы при органосохраняющих операциях наблюдались у больных с IIIа стадией, которым в неоадъювантном режиме проведена только химиотерапия без лучевого лечения (1,8%), независимо от стадии процесса у больных с инфильтративным дольковым раком (1,3%). Невысокий процент местных рецидивов можно объяснить обязательным назначением лучевой терапии после органосохраняющих операций. Частота отдаленного метастазирования, как при органосохраняющих операциях.
Органосохраняющие операции в плане комплексного лечения больных раком молочной железы IIб и IIIа стадии можно считать альтернативным методом по отношению к радикальной мастэктомии. При органосохраняющих операциях и радикальных мастэктомиях общая и безрецидивная 5-летняя выживаемость не отличается: общая выживаемость составляет 86,5±2,7% и 81,3±4,0%; безрецидивная - 68,8±3,4% и 71,2±4,7% (р>0.05). Частота локальных рецидивов в группе органосохраняющего лечения достигает 4%, в группе радикальных мастэктомии - 2%.
Особенно перспективным с нашей точки зрения является консервативная терапия, когда операция, даже самого небольшого объема, противопоказана по возрасту и сопутствующим заболеваниям или выполнение ее не целесообразно в связи с распространенностью опухолевого процесса. В этих ситуациях показано проведение лучевой терапии на фоне лекарственной.
На первом этапе облучалась молочная железа, подмышечные и над-подключичные лимфатические узлы на стороне поражения РОД по 2 Гр 5 раз в неделю. Молочная железа и подмышечная область облучались с двух противоположных полей, над- и подключичная область - с одного поля. Парастернальные лимфатические узлы включались в программу облучения при медиальных локализациях и местнораспространенной стадии заболевания. Суммарная общая доза первого этапа на молочную железу составляла 40 Гр, на регионарные зоны - 36-40 Гр (в зависимости от выраженности кожной реакции на облучение).
Второй этап радикальной программы начинался через 3-4 недели. Доза лучевой терапии на молочную железу составляла 30 Гр; к подмышечной области при наличии метастатических лимфатических узлов с поля уменьшенного размера подводили 10-15 Гр; при наличии надключичных метастазов суммарную дозу увеличивали на 10 Гр, парастернальную область облучали до суммарной дозы 30 Гр.
Суммарная доза на молочную железу за весь курс равнялась 70 Гр, на регионарные зоны - 40-50 Гр и 30 Гр - на парастернальную зону.
С первого дня лучевой терапии всем пациенткам назначались антиэстрогены (тамоксифен, зитазониум, нольвадекс) в суточной дозе 20 мг, а в последние годы использовались ингибиторы ароматазы, в частности - фемара. Отмена препарата была связана только с началом прогрессирования.
Лечение проводилось в амбулаторных условиях.
В изучаемую группу включены пациентки в возрасте от 60 до 82 лет с различными стадиями первичного рака молочной железы (всего 124 человека), соматическая патология у которых являлась абсолютным противопоказанием к оперативному вмешательству или использованию неоадъювантной химиотерапии. Основную группу составили больные 60-69 лет (46,8%) и 70-79 лет (47,9%). Группа больных старше 80 лет была самой малочисленной (5,3%).
На долю первично неоперабельных форм (Т3-4N1-3М0) РМЖ в изучаемой группе приходилось более половины наблюдений (55,3%). При исследовании все больные с успехом закончили лечение и в последующем продолжали прием тамоксифена или фемары.
Оказалось, что как общая, так и безрецидивная выживаемость в возрастной группе старше 70 лет ниже по сравнению с возрастной группой 60-69 лет. Безрецидивная выживаемость при 3- и 5-летнем интервале наблюдения в группе 60-69 лет составила 83,3±7,1 % и 81,5±7,3%; старше 70 лет - 81,4±6,9% и б9,4±9,8% соответственно.
В 3- и 5-летние промежутки в группе 60-69 лет общая выживаемость составила 95,4±4,4% и 90,3±5,2%; а в группе 70-79 лет - 86,7±7,6% и 70,4±5,7% соответственно.
Анализ продолжительности жизни при различном распространении опухолевого процесса выявил следующее: 5-летняя общая и безрецидивная выживаемости при локализованном РМЖ (стадия Т1-2N0М0) составляет 83,3±15,2% и достоверно не отличается в разных возрастных группах. Для стадии Т1-2N1М0 эти показатели равняются 80,5±16,7% и 77,6±9,0%.
5-летняя продолжительность жизни при местнораспространенном раке (стадия Т1-2N2-3М0, Т3-4N0-3М0) соответствовала 70,4±13,5% для общей и 67,7±14,8% для безрецидивной.
Более детальный анализ отдаленных результатов в зависимости от критерия N установил четкую закономерность их снижения по мере увеличения поражения регионарных лимфатических узлов. Так, при цитологически подтвержденном отсутствии регионарных метастазов (Np) 5-летняя общая выживаемость соответствовала 92,8±б,8%, а безрецидивная - 84,3±10,6%, тогда как при N2 (то есть конгломерате аксиллярных лимфатических узлов) аналогичные показатели равнялись 75,0±15,1% и б8,8±15,2% соответственно. Различия статистически достоверны (р
rosoncoweb.ru