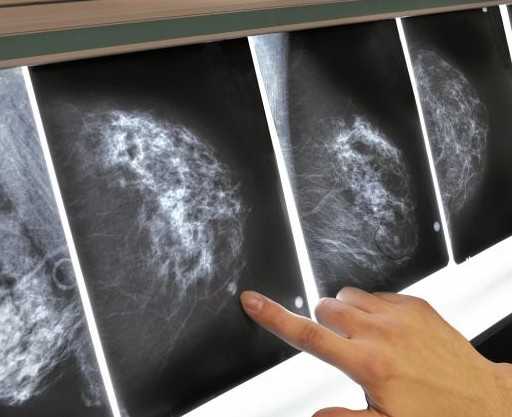
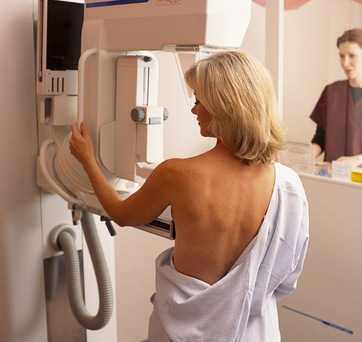
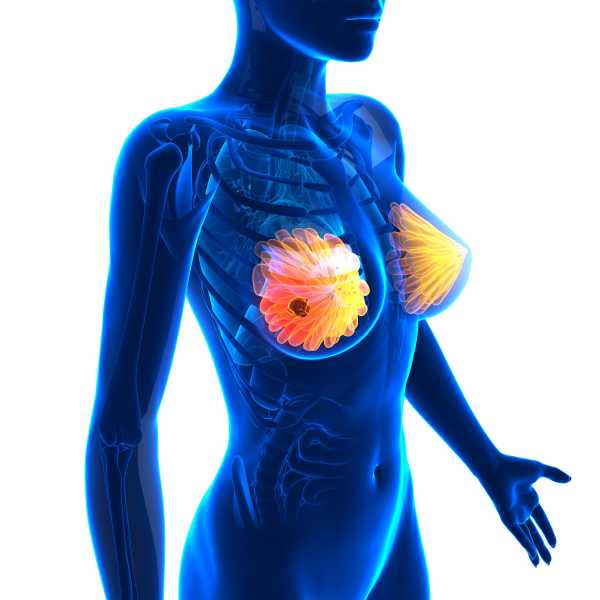
Генетический рак молочной железы
Наследственный рак молочной железы
Рак груди – это злокачественное образование, которое может развиваться как в одной, так и в обеих молочных железах. На сегодняшний день считается, что наследственный рак молочной железы связан с генами BRCA1 и BRCA2. Зачастую патологии генов, которые отвечают за это онкологическое заболевание, диагностируют у молоденьких женщин, не достигших 40 лет. Эти гены проводят регулировку полноценного разрастания клеток молочных желез и снижают возможность появления в них раковых образований. Но при имеющейся патологии в этих генах становится выше риска РМЖ. Патология генов BRCA1 и BRCA2, по статистике, составляет около 10% всех случаев заболевания.
Наследственные причины рака груди
Первый раз аномальные гены определили в процессе изучения семей, в которых молодые женщины уже имели рак груди. Высокая вероятность того, что аномальные гены, провоцирующие РМЖ, передаются наследственно, бывает по таким причинам:
- Имеются прямые родственники женского пола по линии одного из родителей, у которых диагностировали рак груди в возрасте, не достигнув пятидесяти лет.
- В семье имеются женщины, которые на сейчас больны РМЖ.
- У прямых родственников было заболевание рака обоих молочных желез.
- В семье был диагностирован РМЖ у представителя мужского пола.
Какие бывают наследственные формы рака молочной железы?
Существуют такие наследственные формы РМЖ:
- Дуктальная, при которой клетки рака дислоцируются только в молочных протоках железы и не переходят на ткани, которые ее окружают. Такой наследственный рак зачастую поддается лечению.
- Лобулярная, которая начинается, поражая дольки молочной железы.
- Инфильтративная – когда клетки ракового образования начинают выходить за пределы молочных протоков.
- Воспалительная, которой характерны признаки проходящего воспалительного процессе: краснота и отек груди, при пальпации она горячая.
- Болезнь Пэджета, которая характеризуется появляющейся на соске сыпи, похожей на экзему.
- Тубулярная — когда онкологические клетки формой похожи на трубочку.
- Слизистая — начинающаяся из молочных протоков. Клетки богаты на содержание слизи.
- Мозговая – когда опухолевое образование напоминает ткань мозга.
- Папиллярная, при которой онкологические клетки похожи на ворсинки.
Многие ошибаются думая, что наследственный рак груди протекает более агрессивно, чем приобретенный. Но исследования доказали, что РМЖ, спровоцированный наследственным фактором, наоборот, менее агрессивен.
Как часто встречается наследственный РМЖ и кто в группе риска?
Если у кого-либо из вашей семьи были обнаружены аномальные клетки, провоцирующие развитие рака груди, это не значит, что вам заболевание достанется наследственно. Предположим, что у вашей мамы или папы присутствуют аномальные гены BRCA1 или BRCA2. Риск унаследовать их будет примерно 50%. А ваши дети рискуют унаследовать такие гены с вероятностью в 25%.
У представительниц женского пола, имеющих аномальные гены, вероятность развития РМЖ в старости очень высокая. Но не обращая внимания на высокие риски нужно знать, что РМЖ появляется не у каждого, кто имеет наследственные склонности. Все зависит от того, какой человек ведет образ жизни, какая вокруг него окружающая среда, как другие гены проводят защиту организма от раковых образований и т.д.
Как на сегодняшний день определяется наследственный рак молочной железы?
Первым делом правильнее будет обратиться за консультацией к врачу-генетику. Онкогенетика достигла такого уровня, когда стало очень легко проводить профилактику и раннюю диагностику рака молочной железы, а также сформировывать новые способы скрининга РМЖ, в состав которых входит генотипирование. Для проведений консультаций больных, находящихся в группе риска развития РМЖ, предпочтительным является генетический анализ генов BRCA1/2, TP53, CHEK2.
Другой вариант исследования — генетический тест слюны на наличие наследственного рак груди. В ряде случаев, даже отрицательный результат теста (отсутствие аномалии гена), не значит, что отсутствует наследственная склонность к онкологии. Поэтому, когда получены результаты теста, женщину консультирует врач-генетик, который, если возникает такая необходимость, определяет дополнительные меры наблюдения пациентки.

Что такое генетический анализ на РМЖ?
Генетический анализ на рак груди помогает представительницам женского пола узнать, имеют ли они наследственные аномальные гены, повышающие вероятность появления РМЖ. Анализ проводят, чтобы найти изменения в генах, напрямую связанных с этим онкологическим заболеванием (BRCA1 и BRCA2). Изменения в этих генах диагностируются редко, но, если они находятся, у женщины растут шансы столкнуться с раком.
Что делать, если анализы подтвердили предрасположенность к наследственному раку?
Если генетический анализ показал наличие аномальных генов, повышающих вероятность появления рака МЖ, рекомендовано постоянно контролировать свое состояние. Для этого подойдет исследование при помощи МРТ. Также, рекомендуется проходить УЗИ молочных желез и сдавать кровь на онкомаркеры, отвечающие за наличие РМЖ. Если специалисты разрешат, в целях профилактики онкологии, можно принимать медицинский препарат “Тамоксифен”. Необходимо вести здоровый образ жизни: правильно питаться, заниматься спортом, вести контроль веса и отказаться от вредных привычек (сигареты и спиртные напитки).
Женщинам, у которых определили наследственную склонность к раку груди, необходимо избегать факторов, которые увеличивают риск заболевания:
- имеются ли доброкачественные изменения в молочных железах (мастопатия);
- очень рано или наоборот, поздно началась менструация;
- до 35 лет женщина не рожала, или последний ребенок рожден после этого возраста;
- лечение гормонами в период после менструации;
- наличие вредных для организма привычек, таких как курение и употребление алкогольных напитков в большом количестве;
- лишний вес, сахарный диабет, болезни печени и щитовидки;
- недостаточность витамина D, необходимого для полноценного функционирования организма;
- ионизирующая радиация.
Все эти факторы оказывают влияние на смену гормонального фона и способствуют повышению вероятности появления рака груди у женщин, имеющих наследственную склонность к болезни, и даже у тех, кто ее не имеет.
В чем заключается тактика наблюдения здоровых носителей наследственных мутаций?
Какова будет тактика наблюдения здорового носителя наследственной мутации определяется сугубо индивидуально, специалистом и пациентом. Проинформировать кровных родных о подтверждении имеющейся наследственной аномалии генов, отвечающей за РМЖ, и имеющемся у них наследственном риске, должен в обязательном порядке сам пациент.
Процедуры, способствующие снижению онкологического риска, подразделяют на несколько групп:
- наблюдение (скрининг);
- хирургия в профилактических целях;
- лечение лекарственными препаратами.
Наиболее часто используемой является тактика наблюдения. Снизить вероятность развития и повысить шансы раннего диагностирования рака груди можно проходя каждый год клиническое обследование, а также МРТ или маммографию молочных желез. Такая тактика помогает существенно снизить вероятность появления РМЖ, но зависима от того, соблюдает ли человек рекомендации, которые были даны специалистами.
Рекомендации женщинам-носительницам генов с мутацией
Необходимо с умом подходить к планированию беременности и рождения ребенка. В целях профилактики рекомендуют не затягивать с беременностью, а также, если это возможно, не принимать гормональные препараты, отдав предпочтение контрацептивам барьерного типа.
Женщинам, имеющим аномальные гены BRCA1 или BRCA2, можно сделать операцию по удалению молочной железы (мастэктомию). Но прежде, чем пойти на этот шаг, необходимо хорошо подумать, взвесив все за и против.
Выводы
Если имеется наследственная предрасположенность к появлению РМЖ, не стоит паниковать. Далеко не всегда это означает, что наследственный рак молочной железы у вас проявится. Чтобы максимально избежать этого заболевания, носителям аномальных генов рекомендуется проводить профилактику заболевания и регулярно консультироваться с врачом-генетиком.
orake.info
Рак молочной железы с семейной историей
Статья на конкурс «био/мол/текст»: Результат генетического тестирования здоровой женщины может прозвучать как смертный приговор. Но внимательный индивидуализированный подход врача к пациентке с наследственным раком молочной железы способен помочь в выборе верной стратегии. Имеет ли смысл удаление груди — или лучше, понадеявшись, что «пронесет», ждать болезнь?
Главный спонсор конкурса — дальновидная компания Генотек.Конкурс поддержан ОАО «РВК».
Обратите внимание!
Эта работа представлена на конкурс научно-популярных статей «био/мол/текст»-2014 в номинации «Лучший обзор».
Спонсором номинации «Биоинформатика» является Институт биоинформатики. Спонсором приза зрительских симпатий выступила фирма Helicon. Свой приз также вручает Фонд поддержки передовых биотехнологий.
«Решение сделать мастэктомию далось нелегко. Но я счастлива. Теперь риск рака молочной железы у меня ниже 5%», — сказала Анжелина Джоли, сообщив об уже проведенной подкожной мастэктомии с одновременным протезированием. На радикальную профилактику РМЖ актриса, активный общественный деятель и мать шестерых детей согласилась, узнав о мутации в гене BRCA1, из-за которой риск возникновения РМЖ врачи оценили почти в 90% (рис. 1).
Профилактическая мастэктомия — один из наиболее эффективных и дискуссионных способов предупреждения рака груди. Хотя распространенность наследственного рака невысока (10–15% от всех случаев РМЖ), шанс заболеть у женщин-носительниц предполагаемых мутаций повышается — вплоть до почти 100% вероятности в некоторых случаях. Роковые цифры рассчитывают для каждой пациентки индивидуально.
И если с помощью профилактической мастэктомии риск наследственного РМЖ удается снизить на 95%, это является значимым аргументом в пользу операции. Хотя достоверно оценить пользу для конкретной пациентки очень сложно, в масштабе всего мира ученые оценивают превентивную мастэктомию положительно. К тому же женщинам сейчас можно меньше волноваться из-за эстетической стороны вопроса: реконструктивные операции стали широко доступны. Импланты вставляют незамедлительно после удаления молочной железы — это так называемая подкожная мастэктомия с одновременным протезированием. Однако возникает и новая проблема: у небольшой части женщин, вместо серьезного взвешивания «за» и «против» операции, на первый план выходит соблазн подправить форму/размер груди даже при относительно маленьком риске развития рака.

Рисунок 1. Анджелина Джоли на премьере фильма «Малефисента» (2014).
Число женщин, выбирающих превентивную мастэктомию, увеличивается с каждым годом. В Англии, по данным NHS (национальной системы здравоохранения), операцию на здоровых железах в 2002 году провела 71 пациентка, а в 2011 — уже 255 [4].
Частота подобной операции больше всего растет в США: как сообщил Доктор Келли Хант на ежегодной конференции американского общества клинической онкологии (ASCO), в 2010 году в Anderson Cancer Center (Хьюстон, США) здоровые железы удалили 8% пациенток, в 2011 году — 12,6%, в 2012 — уже 14,1% [5]. Что же это: массовая истерия или разумный выход из положения?
Отеческая забота
Первое зафиксированное хирургическое вмешательство при РМЖ связано, как часто бывает, с древними греками: врач Леонид советовал выжигать грудь раскаленной кочергой до грудной клетки. Практика «постоперационного» ухода за пережившей это пациенткой началась еще на сотню лет позже. В эпоху Ренессанса всё, что могли сделать хирурги, — это отрезать грудь как можно скорее и, желательно, неожиданнее. «По факту, хирурги появлялись в доме женщины без предупреждения», — пишет Кристина Ларонга в историческом обзоре «The changing face of mastectomy: an oncologic and cosmetic perspective». — «Несколько мужчин, сопровождавших хирурга, держали женщину на ее же кухонном столе, позволяя доктору выполнить необходимую процедуру...» [3].
Первая профилактическая мастэктомия была проведена еще в 1917 году, и ее необходимость обосновывали парадоксально: «страх получить увечье заставляет женщину избегать как диагностики, так и лечения, позволяя заболеванию прогрессировать...» [1]. Едва ли не насильственную превентивную мастэктомию можно объяснить, наверное, отеческой заботой, говорит не без сарказма Франсуа Айзингер из французского института Паоли-Кальметте в этико-историческом обзоре по РМЖ [2].
В наше время уровень безопасности и качество помощи при мастэктомии несоизмеримо возросли, и сейчас женщины нередко сами настаивают на операции, несмотря на то, что заболевание должно проявиться только через десятилетия. Цель профилактической (превентивной) мастэктомии — это снижение риска РМЖ, то есть именно заболевания, а не его исхода. Айзингер пишет, что при выборе превентивной мастэктомии обеспокоенность женщин по поводу лучевой и химиотерапии идет не на последнем месте. «Я не боюсь второго рака, но я не хочу заново проходить химиотерапию», — так пациентки с мутациями в BRCA1 объясняют свой интерес к проведению контралатеральной мастэктомии при локализации опухоли в одной груди.
ДНК под микроскопом
Развитие наследственного рака напрямую связано с двумя процессами — насколько оперативно клетка замечает повреждение генома и как она его чинит. На настоящий момент «опасных» генов уже выделено более 40, а мутации в них обуславливают около 14% заболеваний РМЖ. На BRCA1 и BRCA2, например, приходится 2,5% всех случаев рака груди. Помимо BRCA, среди так называемых генов восприимчивости к РМЖ с высокой пенетрантностью — то есть, с наибольшими шансами развития опухоли среди носителей мутации — есть еще p53, PTEN, STK11/LKB1 и CDh2. К умеренно-пенетрантным, то есть связанным с меньшим риском возникновения РМЖ, относятся, например, ATM, CHECK2, BRIP1 и PALB2. Около 70% случаев наследственного РМЖ соотносят с аллелями низкопенетрантных генов или с неизвестными генетическими факторами. Граница разделения пока не очень четкая, хотя все-таки считается, что мутации в высокопенетрантных генах увеличивают риск РМЖ в 5–20 раз, в низкопенетрантных генах — максимум в 1,5 раза [8].
Рисунок 2. Генетическая структура рака молочной железы. Слева: Генетическая предрасположенность к развитию рака груди составляет около 10–15% от всех случаев РМЖ, причем высокопенетрантные гены ответственны примерно за четверть опухолей, передающихся по наследству [6]. Справа: Соотношение основных генов, мутации в которых задействованы в развитии наследственного РМЖ: среди известных генов BRCA1 и 2 занимают лидирующую позицию [7].
Высокопенетрантные гены
Еще в начале 90-х годов BRCA1 и BRCA2 были идентифицированы как гены предрасположенности к раку молочной железы и раку яичников. Они находятся в длинных плечах 17-й и 13-й хромосом и имеют 24 и 27 экзонов соответственно, причем мутации чаще всего встречаются в самом крупном — одиннадцатом экзоне. Ортологи BRCA1 и BRCA2 определены и у других млекопитающих; всего в генах BRCA зарегистрировано свыше 2000 (!) различных мутаций, среди которых есть и делеции, и вставки, и замена одиночных нуклеотидов.
Ген BRCA1 кодирует ядерный белок, который участвует в восстановлении двухнитевых разрывов ДНК (double-strand breaks, DSB), транскрипции, регуляции гомологичной рекомбинации (процесса обмена двух одинаковых или идентичных молекул ДНК нуклеотидными последовательностями, чаще всего именно при DSB), контроле митотических чекпойнтов (система, следящая за состоянием клетки, которая может «запретить» ее дальнейшее деление, если что-то идет не так — например, при вероятности ракового перерождения; если же этот контроль ослабевает или выключается, то клетка с поломкой продолжает делиться, и через какое-то количество делений получается опухоль). Совместно с другими супрессорами опухолей, сенсорами повреждения ДНК и прочими молекулами он образует сложный комплекс из множества субъединиц — BRCA1-associated genome surveillance complex, контролирующий стабильность генома. Регуляция транскрипции происходит через взаимодействие домена BRCT с гистондеацетилазами — белками, которые с помощью удаления ацетильных групп с гистонов увеличивают плотность упаковки ДНК и тем самым снижают скорость транскрипции генов.
Помимо рака молочной железы, мутации в гене BRCA1 проявляются при раке яичников, причем оба типа опухолей развиваются в более раннем возрасте, чем при ненаследственном РМЖ. BRCA1-ассоциированные опухоли в целом связаны с неблагоприятным прогнозом для пациентки, поскольку чаще всего относятся к трижды негативному РМЖ. Этот подтип назван так из-за отсутствия в клетках опухоли экспрессии сразу трёх генов — HER2, рецепторов эстрогенов и прогестерона, поэтому и лечение, основанное на взаимодействии лекарств с этими рецепторами, невозможно.
Ген BRCA2 также вовлечен в процессы репарации ДНК и поддержание стабильности генома, — отчасти вместе с комплексом BRCA1, отчасти через взаимодействие с другими молекулами (например, белком RAD51). «Отличительными чертами мутаций BRCA2 являются более частое возникновение рака молочной железы у мужчин и больший риск развития молочно-яичникового синдрома», — пишут Е.М. Бит-Сава и М.Б. Белогурова в обзорной статье по наследственному раку молочной железы [13].
Наиболее распространены мутации в BRCA1/2 у евреев Ашкенази. Мутации, характерные для определенных сообществ и географических групп, описаны также и для жителей нашей страны. Так, в России мутации BRCA1 представлены в основном пятью вариациями, 80% из которых — 5382insC. Мутации генов BRCA1 и BRCA2 приводят к хромосомной нестабильности и злокачественной трансформации клеток молочной железы, яичников и других органов. Кумулятивный риск рака молочной железы и яичников у всех женщин с мутацией BRCA1/BRCA2 на протяжении всей жизни оценивается как минимум в 60–80% (средний суммарный риск — 65% для BRCA1 и 45% для BRCA2). Однако, обращают внимание ученые, едва ли не большинство случаев семейного РМЖ и рака яичников невозможно объяснить уже изученными мутациями, поэтому биологи изучают возможные вариации в других генах, контролирующих клеточный цикл.
Один из наиболее известных генов, на активность которого влияют белки BRCA1, — это специфический регулятор транскрипции TP53 (tumor protein 53 из 17p13.1). Им кодируется «страж генома» — белок p53, не дающий сосудам прорастать в «горячую точку» — опухоль — и участвующий в процессах апоптоза и репарации ДНК. Количество различных мутаций оценивается примерно в полторы тысячи; влияние этого гена на развитие РМЖ отмечено в 20–35% случаев. Например, мутации в этом гене вызывают синдром Ли-Фраумени — довольно редкое заболевание с высокой ранней смертностью, характеризующееся возникновением множественных опухолей.
PTEN (phosphatase and tensin homologue) кодирует фермент, среди субстратов которого — фосфатидилинозитол-3-фосфаты, важнейшие передатчики сигнала по пути PI3K/AKT/mTOR, который вовлечён в развитие опухоли. После «общения» с ферментом белки теряют свою активность (за счет чего и осуществляется антиопухолевое действие), поэтому PTEN называют негативным регулятором этого сигнального пути. При появлении в гене мутаций риск развития новообразований повышается — например, риск РМЖ увеличивается на 4%. И именно этому гену приписывают «заслугу» в развитии болезни Коудена (синдром множественных доброкачественных узловых образований — гамартом).
CDh2 кодирует Е-кадгерин — молекулу, обеспечивающую межклеточную адгезию, т.е. скрепление клеток между собой. Ученые используют Е-кадгерин и эстрогеновый рецептор (ER, рецептор основной группы «женских» гормонов) в клинической практике как первичные маркеры одного из типов РМЖ — люминального эпителиального рака. У женщин с мутацией в CDh2 риск развития РМЖ повышен на 39–52%, а пониженная экспрессия Е-кадгерина связана с большим количеством метастазов и худшим прогнозом. Это в общем-то предсказуемо — чем хуже соединены клетки друг с другом, тем легче они распространяются по организму. Зародышевые мутации CDh2 также связывают с развитием диффузной желудочной карциномы и раком прямой кишки.
К активно изучаемым генам с высокой пенетрантностью относятся и STK11/LKB1 (он кодирует белок, который участвует в регуляции клеточного цикла, поддержании полярности клеток — что особенно важно при метастазировании — и может менять активность других белков), PALB2 (образует мостик-связку между белками BRCA1 и BRCA2, и, соответственно, помогает синхронизировать их работу при репарации ДНК), комплекс MRE11A/RAD50/NBN (благодаря им, клетка «узнает» о разрывах хромосом и активирует в ответ на это «спасательную бригаду» других белков).
Гены с умеренной и низкой пенетрантностью
Большинство умеренно- и низкопенетрантных генов напрямую взаимодействует с BRCA1 (например, BARD1, ABRAXAS, BRIP1, BABAM1), следовательно, их поломки мешают ему нормально выполнять свою работу.
Ген CHEK2 кодирует белок под названием «чекпоинт-киназа 2», который может взаимодействовать с p53 и BRCA1. CHEK2 не дает клетке делиться дальше, если ее геном поврежден, — клеточный цикл останавливается на стадии G1.
Белок, кодируемый геном ATM, выполняет множество функций, связанных с ответом на повреждение и с репарацией ДНК, в том числе в сигнальных путях, включающих TP53, BRCA1 и CHEK2.
RAD51 и его паралоги (т.е. гены, появившиеся в результате дупликаций RAD51 внутри генома) — это ключевые медиаторы гомологической рекомбинации. Самые важные с «онкологической» точки зрения — это RAD51C и RAD51D, которые взаимодействуют с BRCA2.
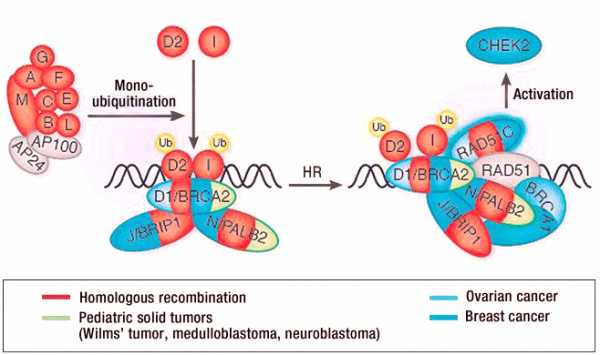
Рисунок 3. Белковый комплекс репарации ДНК. На заключительном этапе — гомологической рекомбинации — требуются Rad51 и RAD51C и их взаимодействие с BRCA1 и BRCA2. RAD51C также активирует CHEK2. Окраска белков соотносится в мутациями в соответствующих генах, отвечающих за развитие заболевания: анемия Фанкони (красный), детские солидные опухоли (зеленый), РМЖ (темно-синий), рак яичников (светло-голубой). Ub — убиквитин [11, 12].
«Семена и почва»
Поскольку до 90% смертей от рака вызваны не первичной опухолью, а ее метастазами, то наиболее интересная тема научной дискуссии — это изучение активности генов в метастазах. Пока корреляция между наследственными факторами, агрессивностью опухоли и ее способностью к метастазированию не подтверждена: исследований конкретно этой связи практически нет, но это не значит, что связь отсутствует. К примеру, в некоторых работах установлено, что риск метастазирования увеличивается при наличии, например, полиморфизмов в генах Rrp1b и SIPA1, а также и гомо- или гетерозиготности по ним [15].
Остаются невыясненными многие факторы, приводящие к «расселению» рака, и связанные с ними сигнальные каскады. Сейчас существуют несколько теоретических моделей — например, модель Ноувелла (Nowell) и модель Вейсса (Weiss); также изучается роль стволовых клеток. Кажется невероятным, но, всего лишь посмотрев на геном опухолевой клетки, возможно предсказать ее склонность к метастазированию и локализацию будущих метастазов. К примеру, если раковые клетки гиперэкспрессируют один набор генов (CXCR4, PLHLP, IL11, MMP1 и OPN), то они обладают способностью образовывать метастазы в костной ткани, если другой (COX, EREG, ANGPTL4) — то в легких, а если третий (ST6GALNAC5, COX2, HBEGF, ANGPTL4) — то в нервной системе [16]. Если не знать результатов изучения генной экспрессии, то можно подумать, что ученые изобрели магический шар с провидческой функцией.
Изучение метастатических ниш в будущем может указать не только на орган, но и на месторасположение будущего метастаза в этом органе, уверены исследователи.
Профилактика РМЖ
«...Ка-кой там дурак любит за характер!?! ... Кому нужна одногрудая?! ... Да как же я на пляж пойду?!» — так А. Солженицын в романе «Раковый корпус» описывает переживания Аси, у которой врачи обнаружили рак груди. Действительно, несмотря на возможности современной реконструктивной хирургии, утрату женственности, связанную с мастэктомией, врачи и сейчас относят едва ли не к основным психологическим проблемам пациентки. Здоровые женщины, у которых нашли наследственные мутации, находятся под дамокловым мечом психологического и эмоционального стресса — поддержка необходима не только им, но и их родственникам. «Я не хочу делать ничего кардинального с моим телом», «Я хочу завести детей, двух или трех подряд, и потом удалю это все к черту», «Вы чувствуете себя так, будто только что диагностирован рак, хотя этого и не было», — вот как комментируют женщины результаты генетического тестирования.
Превентивный подход предусматривает несколько альтернатив [18]:
- самостоятельное обнаружение уже появившегося рака на ранней стадии (регулярные маммографические и МРТ обследования, самообследование груди на предмет опухоли);
- двухсторонняя радикальная мастэктомия;
- профилактическая овариэктомия / сальпинго-овариэктомия — удаление яичников/яичников и матки;
- химиопрофилактика (пока что все еще находится в процессе разработки и изучения).
Значимо выигрывают, к сожалению, только те, кто прошел через удаление и молочных желез, и яичников. Ученые считают, что если психологический гнет для женщины слишком силен, у нее уже есть дети и ее не устраивает длительный прием препаратов, то радикальные операции могут быть оптимальным решением — ведь после них пациентка может вести более-менее нормальную жизнь.
Например, профилактическая сальпинго-овариэктомия в зависимости от возраста пациентки может снизить вероятность возникновения рака от 60% до 90%: на 75–96% рака яичников и фаллопиевых труб и примерно на 50% — риск РМЖ, если ее провели до менопаузы [20]. Однако принимая во внимание предпочтения и качество жизни женщин, удаление яичников рекомендуют делать лишь после 40 лет, и если угроза жизни действительно высока.
National Cancer Institute советует лекарственную терапию женщинам с «промежуточными» рисками; все еще не критические, но высокие по сравнению с общей популяцией. Правда, для пациенток именно с мутациями в генах BRCA1/2 достоверных данных на этот счет еще не получено [21].
Пиар и пустоцвет
Список генов, связанных с развитием опухоли и метастазированием, значительно расширен. Найдены новые взаимодействия белков, уточнены сигнальные пути и механизмы защиты нормального функционирования ДНК, внесены свежие данные по возникновению ракового перерождения. Новые технологии секвенирования помогут сделать еще не одно открытие и создать новые пути применение генетики для продления и спасения жизней.
«Ищите информацию и медицинских экспертов», — именно так закончила свое публичное выступление Джоли, которая сейчас, по заявлениям в прессе, готовится к овариэктомии. — «В жизни много препятствий. Но нас не должны пугать те, в которых мы можем что-то контролировать».
Не все оценивают действия Джоли позитивно: есть мнение, что в ее случае мастэктомия и публичные выступления — это пиар. Не давая оценку действиям Джоли, ученые и врачи констатируют: уровень знаний о наследственном РМЖ необходимо поднимать, а хороший шанс сделать это не был использован должным образом. «Из 2500 американцев более 75% знают об истории Джоли», — пишут исследователи в Genetics in Medicine [22]. — «Но менее 10% опрошенных могут ответить на вопросы о наследственном РМЖ и генетических рисках».
- Jacobson N. (1998). The socially constructed breast: breast implants and the medical construction of need. Am. J. Public Health. 88, 1254–1261;;
- Eisinger F., Roussel C., Morère J.-F., Viguier J. (2011). Cancer screening: reaching the limits or terra incognita? Lessons from the EDIFICE surveys. Eur. J. Cancer Prev. 20, S42—S44;
- Laronga C., Lewis J.D., Smith P.D. (2012). The Changing Face of Mastectomy: An Oncologic and Cosmetic Perspective. Cancer Control. 19, 286–294;;
- Neuburger J., Macneill F., Jeevan R., van der Meulen J.H., Cromwell D.A. (2013). Trends in the use of bilateral mastectomy in England from 2002 to 2011: retrospective analysis of hospital episode statistics. BMJ Open 3, e003179;
- ASCO conference (2013). Data Indicate Double Mastectomies On The Rise Among Breast Cancer Patients;
- Rizzolo P., Silvestri V., Falchetti M., Ottini L. (2011). Inherited and acquired alterations in development of breast cancer. Appl. Clin. Genet. 4, 145–158;;
- van der Groep P., van der Wall E., van Diest P.J. (2011). Pathology of hereditary breast cancer. Cell Oncol. (Dordr). 34, 71–88;;
- Melchor L., Benitez J. (2013). The complex genetic landscape of familial breast cancer. Hum. Genet. 132, 845–863;;
- Dever S.M., White E.R., Hartman M.C., Valerie K. (2012). BRCA1-directed, enhanced and aberrant homologous recombination. Mechanism and potential treatment strategies. Cell Cycle 11, 687–694;;
- Helleday T. (2011). The underlying mechanism for the PARP and BRCA synthetic lethality: Clearing up the misunderstanding. Mol. Oncol. 5, 387–393;;
- Levy-Lahad E. (2010). Fanconi anemia and breast cancer susceptibility meet again. Nat. Genetics 42, 368–369;;
- Meindl A., Ditsch N., Kast K., Rhiem K., Schmutzler R.K. (2011). Hereditary Breast and Ovarian Cancer: New Genes, New Treatments, New Concepts. Dtsch. Arztebl. Int. 108, 323–330;;
- Бит-Сава Е.М., Белогурова М.Б. «Наследственный рак молочной железы»;
- Guirouilh-Barbat J., Wilhelm T., Lopez B.S. (2010). AKT1/BRCA1 in the control of homologous recombination and genetic stability: the missing link between hereditary and sporadic breast cancers. Hereditary Breast and Ovarian Cancer. Oncotarget 1, 691–699;;
- Hsieh S.M., Look M.P. (2009). Distinct inherited metastasis susceptibility exists for different breast cancer subtypes: a prognosis study. Breast Cancer Res. 11, R75;
- Ribelles N., Santonja A., Pajares B., Llácer C., Alba E. (2014). The seed and soil hypothesis revisited: Current state of knowledge of inherited genes on prognosis in breast cancer. Cancer Treat. Rev. 40, 293–299;;
- Leonarczyk J., Mawn B.E. (2014). Cancer Risk Management Decision Making for BRCA+ Women. West J. Nurs. Res.;
- Burke W., Daly M., Garber J., Botkin J., Kahn M.J., Lynch P., McTiernan A., Offit K., Perlman J., Petersen G., Thomson E., Varricchio C. (1997). Recommendations for Follow-up Care of Individuals With an Inherited Predisposition to Cancer. II. BRCA1 and BRCA2. JAMA 277, 997–1003;;
- Pal T., Vadaparampil S.T. (2012). Genetic Risk Assessments in Individuals at High Risk for Inherited Breast Cancer in the Breast Oncology Care Setting. Cancer Control 19, 255–66;;
- Finch A., Evans G., Narod S.A. (2012). BRCA carriers, prophylactic salpingo-oophorectomy and menopause: clinical management considerations and recommendations. Women’s Health 8, 543–555;;
- National Cancer Institute: Breast Cancer: Prevention, Genetics, Causes;
- Borzekowski D.L., Guan Y., Smith K.C., Erby L.H., Roter D.L. (2013). The Angelina effect: immediate reach, grasp, and impact of going public. Genet. Med. 16, 516–521..
biomolecula.ru
НАСЛЕДСТВЕННЫЕ ПРИЧИНЫ РАКА ГРУДИ
Рак груди // Наследственные причины рака груди
В настоящее время большинство наследственных случаев рака молочной железы связано с генами BRCA1 и BRCA2. Обычно аномалии генов, отвечающих за развитие рака молочной железы, чаще всего встречаются среди женщин моложе 40 лет. Как минимум у 25% из них аномалия генов BRCA1 или BRCA2 не связана с наследственностью. Роль данных генов заключается в том, что они регулируют нормальный рост клеток молочной железы и предупреждают возможный раковый рост. Но при наличии в аномалий или мутаций в этих генах, они способствуют повышению риска рака молочной железы. Аномалия генов BRCA1 и BRCA2 может составлять 10 % всех случаев рака молочной железы. Причиной всех видов рака молочной железы является аномалия генов в клетках. Аномалии же (или мутации) в этих генах могут носить или наследственный характер (то есть передаться от матери), либо быть приобретенными.
Наследственная аномалия генов: у некоторых людей аномалия генов может быть с рождения. Это аномалия передается им от родителей.
Приобретенная аномалия генов: в других случаях мутация генов происходит по причине воздействия на клетку различных факторов – радиации, диеты, уровня половых гормонов, токсические факторы окружающей среды либо неизвестные причины. Приобретенная генная аномалия считается причиной рака молочной железы в 85 – 90%. Независимо от того, как Вы получили генную аномалию: в результате наследственности или других факторов, если в клетке есть хоть один нормальный ген, который продолжает работать и отвечать за продуцирование особого белка, он будет обеспечивать профилактику рака. Но если страдают оба гена в клетке, результатом становится рак молочной железы.
У женщин, страдающих раком молочной железы при обнаружении аномалии генов BRCA1 и BRCA2 часто встречается семейная предрасположенность к раку молочной железы, яичников или и того и другого. Но кроме того, важно помнить, что у большинства женщин с раком молочной железы нет семейной предрасположенности к этой патологии. Обнаружение взаимосвязи между риском рака молочной железы и аномальными генами BRCA1 и BRCA2 привело к новым методам снижения риска, выявления и лечения рака молочной железы у таких больных.
Впервые аномальные гены были выявлены в исследованиях семей, где у женщин в очень молодом возрасте встречался рак молочной железы, рак яичников или обе эти патологии. Большая степень того, что у Вас могут быть аномальные гены, отвечающие за рак молочной железы, может быть в следующих случаях:
- Наличие прямых родственников (мать, бабушка, сестра, тетя) с материнской или отцовской стороны, у которых был выявлен рак молочной железы в возрасте до 50 лет.
- Наличие в Вашей семье родственницы с раком молочной железы и яичников.
- Если в Вашей семье были случаи рака обеих молочных желез.
- Если Вы относитесь к некоторым национальностям (например, евреи восточной Европы).
- Если в Вашей семье был случай рака грудной железы у мужчины.
Следует помнить, что если у одного члена Вашей семьи обнаружены аномальные гены рака молочной железы, это вовсе не означает, что этот ген будет у всех членов семьи. Допустим, у Вашей матери или отца имеются аномальные гены BRCA1 или BRCA2. Риск перенять эти гены по наследству составляет 50%. У Ваших же детей риск принять эти гены от Вас в данном случае, будет составлять 25% - то есть 50% от Ваших 50%
В среднем у женщин без наследственной генетической аномалии к 90 годам жизни риск развития рака молочной железы составляет 12%. В отличие от них, у женщин с наличием аномальных генов к 70 годам риск развития рака молочной железы составляет 85%. Кроме того, у женщин с указанной аномалией имеется и риск развития рака яичников. Этот риск в течение всей жизни составляет около 55% у женщин с аномалией гена BRCA1 и 25% с аномалией гена BRCA2. Для сравнения, у женщин без такой аномалии генов риск развития рака яичников составляет 1,8%. Кроме того, важно отметить, что при наличии аномалии генов BRCA1 и BRCA2 повышается и риск других онкологических заболеваний. Однако, риск возникновения других видов рака (например, рака кожи или ЖКТ) при этом намного ниже, чем риск развития рака молочной железы или рака яичников.
Несмотря на повышенный риск, важно помнить, что рак молочной железы возникает не у каждой женщины с аномалией генов BRCA1 и BRCA2. Этот риск зависит от: образа жизни и факторов окружающей среды, от того, как другие гены BRCA1 и BRCA2 защищают Ваш организм от рака, степень, и как она влияет на продукцию протеина, который предположительно защищает молочную железу от рака.
Следует добавить, что многие женщины ошибочно предполагают, что рак, причиной которого служит наследственная аномалия генов BRCA1 и BRCA2, более агрессивен в своем течении. На самом же деле, как подтвердили последние исследования, такой вид рака молочной железы менее агрессивен, по сравнению с теми женщинами, у которых нет такой наследственной аномалии генов.
Аномалия генов BRCA1 и BRCA2 и рак грудной железы у мужчин
У мужчин, которым по наследству передались аномальные гены BRCA1 и BRCA2, отмечается повышенный риск развития рака грудной железы. Этот риск в течение всей жизни составляет 6%. Это почти в 80 раз выше, чем риск рака у мужчин без таких аномалий генов. Кроме того, заметим, что у мужчин с аномалией генов BRCA1 и BRCA2 в 3–7 раз выше риск развития рака простаты. Как и в случае с женщинами, при наличии данной аномалии у мужчин высок риск развития рака кожи или ЖКТ, но все же он значительно меньше, чем рак молочной железы.
Как аномалия генов способна вызвать груди
В норме гены BRCA1 и BRCA2 предотвращают развитие рака молочной железы, продуцируя особый белок, который контролирует нормальный рост клеток молочной железы. Как мы уже сказали, в каждой клетке человека (у женщин и мужчин) имеется 2 копии генов. Исключение составляют лишь половые клетки (там гены лишь в «одном наборе»). До тех пор, пока хотя бы одна из копий генов в клетках молочной железы функционирует нормально и продуцирует указанный выше белок, риск возникновения рака равен нулю (при отсутствии других факторов, естественно). Однако если обе копии генов в клетках подвергается мутации (или возникает аномалия), клетка больше не может продуцировать необходимый для контроля ее роста белок. В этом случае клетки молочной железы начинают быстро и бесконтрольно размножаться. Некоторые из таких клеток могут проникнуть в здоровые ткани (так называемая инвазия в ткани).
Генетические мутации вдвое увеличивают риск развития рака молочной железы
Британские исследователи сообщают, что они нашли новую генетическую мутацию, которая может быть ответственная за увеличение риска рака молочной железы в два раза. Это ген называется BRIP1. Его функция, как и других генов, ответственных за развитие рака молочной железы, заключается в восстановлении разрушенной ДНК. Кроме того, как и аномалии гена BRCA2, аномалии гена BRIP1 могут приводить к такому заболеванию, как анемия Фанкони.
Как говорят ученые, рак молочной железы встречается в два раза чаше у ближайших родственниц (сестер и матерей) тех, кто страдает раком молочной железы.
Мутации в генах BRCA1, BRCA2 и TP53 увеличивают риск развития рака молочной железы к 60 годам в 10 – 20 раз. Мутации таких генов, как CHEK2 и ATM, увеличивают риск рака молочной железы в два раза. Все вместе эти гены повышают риск развития рака на 25 %.
Что делать если генетический риск велик?
Многие женщины, стремящиеся провести генетический анализ, делают это потому, что считают, что риск развития рака молочной железы у них выше, чем на самом деле. Другой причиной этого является то, что они хотят узнать, нет ли у них аномальных генов, так как в их семье был случай рака молочной железы. Особое беспокойство женщины испытывают, если рак возник в раннем возрасте. Если Вы решили пройти оценку генетического риска, специалист в генетике поможет Вам подготовить так называемое генеалогическое древо. Это поможет ограничить число всех родственников в каждом поколении. В идеале, такое древо составляется в пределах трех поколений назад. Но зачастую, большинство из нас не помнит или не знает что-либо о состоянии здоровья наших родственников старше бабушек и дедушек. После составления такого древа врач-генетик анализирует характер рака молочной железы в родословной.
Родословная Вашей семьи может быть распределена по следующим категориям:
- Спорадическая: это означает, что в Вашей семье появление рака молочной железы не носит регулярный характер. Такой характер проявления семейного проявления рака встречается у 70% женщин.
- Семейный: это означает, что в Вашей семье случаи рака молочной железы прослеживаются более чаще, но при этом нельзя точно выяснить, передался ли рак молочной железы по наследству или нет. Так этот тип встречается в 20% случаев.
- Наследственный: при этом в родословной четко прослеживается взаимосвязь между заболеваниями раком в каждом поколении. Такое встречается лишь у 10% женщин. В этом случае наследование рака объясняется генами BRCA1 и BRCA2.
Что делать после получения положительного результата генетического исследования
Итак, что же нужно делать после того, как у Вас выявили аномальные гены, отвечающие за развитие рака молочной железы? Рекомендуется с раннего возраста проводить регулярный контроль состояния – с 25-летнего возраста или на 10 лет ранее того возраста, при котором был выявлен рак молочной железы у члена Вашей семьи. Прекрасным методом такой диагностики является МРТ.
Рекомендуется ежегодна проверка состояния яичников у гинеколога, контрольные УЗИ органов малого таза и молочных желез, а также анализ крови на специфический маркер CA-125. Спросите у своего врача о необходимости профилактического приема тамоксифена. Постарайтесь изменить образ жизни в более здоровую сторону: это касается изменения диеты, занятие физическими упражнениями, контроль веса тела и отказ от алкоголя и курения.
Старайтесь разумно планировать такие моменты Вашей жизни, как, например, рождение детей – рекомендуется более ранняя беременность, как один из профилактических факторов, а также избегать любой (по возможности) необходимости гормональной терапии. Если Вы не собираетесь иметь детей, не применяйте таблетированные или инъекционные формы гормональных противозачаточных. Вместо этого используйте барьерные формы (презервативы или диафрагмы).
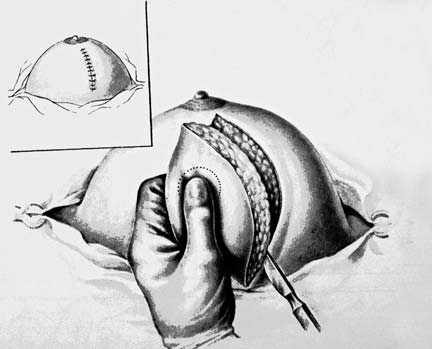
Примите решение о профилактической операции. У женщин с аномальными генами BRCA1 или BRCA2 весьма полезной может быть профилактическая мастэктомия, а также удаление яичников.
(495) 51-722-51 - лечение рака груди в Москве и за рубежом
ОФОРМИТЬ ЗАЯВКУ на ЛЕЧЕНИЕ
breastcancer.su
Ген рака молочной железы – это не приговор!
Анджелина Джоли согласилась пройти двойную мастэктомию в качестве профилактической меры
Анджелина Джоли недавно сообщила о своем решении пройти двойную мастэктомию, чтобы избежать рака груди. Она узнала о том, что имеет наследственную мутацию гена, связанного с раком груди и яичников. В то время как женщины с геном восприимчивости к раку молочной железы (BRCA) имеют на 45-65% повышенный риск развития рака молочной железы, только около 2% диагностированных случаев рака молочной железы обусловлены дефектами гена BRCA.
Почти весь геном человека защищен патентами. Это создало монополии, которые препятствуют научно-техническому прогрессу, а также делает связанную с геном медицину неоправданно дорогой. Важно понимать, что несмотря на то, что вы можете быть носителем дефектного гена, это не означает, что генетическая черта будет выражена у вас. Есть много альтернатив, позволяющих снизить риск рака молочной железы.
Генетическое тестирование на рак молочной железы и радикальная мастэктомия
Все происходящее похоже на дурной сон. Новейшей и самой лучшей «профилактической» стратегией в отношении генетически предрасположенных к раку молочной железы женщин является ампутация.
Парадоксально, что Анджелина Джоли согласилась пройти двойную мастэктомию в качестве профилактической меры. Такое ее личное решение может оказать огромные последствия для населения.
Мать Анджелины Джоли умерла от рака яичников в возрасте 56 лет. У Джоли был выявлен наследственный ген, связанный с раком молочной железы и яичников. Врачи выявили у нее 87% риск развития рака молочной железы и 50% риск развития рака яичников. На самом деле риск рака отличается у каждой женщины. Лишь небольшая часть случаев рака молочной железы возникает в результате наследственной мутации гена. У лиц с дефектным геном BRCA1 обычно определяют 65% риск рака молочной железы. По оценкам врачей, после мастэктомии риск рака молочной железы снижается до 5%. Непостижимо, как любой исследователь может давать такие точные прогнозы будущего риска рака на основе генетических данных. Единственное объяснение заключается в полном неведении об науке эпигенетике, которая изучает влияние разных факторов на экспрессию наших генов (См. статью: Метилирование – секрет биохимии здоровья).
Сколько стоит генетический тест на определение мутаций в гене BRCA?
Генетический тест проверяет наличие мутаций в генах BRCA1 и BRCA2 (The BRCA означает «ген предрасположенности к раку молочной железы») и стоит около 4000$. По иронии судьбы, если вы обнаружите, что являетесь носителем мутации гена BRCA, то стандартная рекомендация в США заключается в проведении маммографии и МРТ по крайней мере один раз в год. На самом деле, даже если у вас есть генетическая предрасположенность к раку молочной железы, было бы разумно максимально избегать ионизирующего излучения, но не наоборот!
Несколько европейских стран, включая Великобританию, Нидерланды и Испанию, уже изменили свои рекомендации скрининга для женщин с мутациями BRCA. Они рекомендуют таким женщинам проводить магнитно-резонансную томографию (которая не выделяет ионизирующего излучения), а маммографию – в возрасте до 30 лет. Исследования показали, что женщины с этими генетическими мутациями являются более чувствительными к радиации.
Например, опубликованные в British Medical Journal результаты исследований показали, что женщины с неисправными генами BRCA более склонны к развитию рака молочной железы, если они подвергаются воздействию рентгена грудной клетки в возрасте до 30 лет. Согласно Cancer Research UK: «Облучение в 20 лет повышает риск развития рака молочной железы на 43%. Любая экспозиция в возрасте до 20 лет повышает этот риск на 62%». Поэтому некоторые ученые настаивают на том, что странам, применяющим маммографию у женщин в возрасте до 30 лет, следует пересмотреть свои руководящие принципы. Снизить риск рака молочной железы можно, применяя магнитно-резонансную томографию.
Генетические дефекты не являются основным фактором риска рака молочной железы
В то время как у женщин с BRCA дефектом риск развития рака молочной железы повышен на 45-65%, только около 2% диагностированных случаев рака молочной железы обусловлено наличием дефектов в этом гене. Таким образом, этот генетический дефект не является основной причиной рака молочной железы. Очевидно, другие негенетические факторы играют гораздо более значимую роль в развитии рака молочной железы.
Таким образом, личная история Анджелины Джоли не имеет абсолютно никакого отношения к 99% всех женщин, потому что они просто не имеют BRCA1 или BRCA2 мутации. Большинство женщин не несут эту мутацию, а в большинстве случаев рак молочной железы носит спорадический характер.
Кроме того, важно понимать, что даже если вы являетесь носителем дефектного гена, это еще не означает, что искомый ген должен экспрессироваться (проявиться). Другими словами, наличие дефекта BRCA не является автоматическим смертным приговором. Вы можете снизить свой риск рака молочной, если измените свой образ жизни, который оказывает огромное влияние на вашу экспрессию генов.
Ген рака молочной железы не связан с профилактикой этого заболевания!
С середины 1940 гг. геномика и патентование генов значительно выросли. В настоящее время почти 20% человеческого генома (около 4000 генов) защищены патентом США. Они включают в себя гены, связанные с болезнями, раком толстой кишки, болезнью Альцгеймера, астмой и т.д. Патент на BRCA1 и BRCA2 гены принадлежит исключительно компании Myriad Genetics.
После того, как была проведена мастэктомия, акции компании быстро взлетели на фондовых рынках. Джоли также удалила яичники, чтобы снизить риск рака яичников. Таким образом, она находится в состоянии «хирургической менопаузы», которая требует тщательного гормонального мониторинга.
Не поддавайтесь на эффект Анджелины!
Обман в сельском хозяйстве, пищевой, биотехнологической, химической и других видах промышленности является главной движущей силой в развитии большинства хронических заболеваний. По всей видимости, Анджелина Джоли стала жертвой сложных и умных методов, которые успешно поставили здравый смысл с ног на голову. Она научилась доверять и верить системе, которая создала это безумие. Не попадайтесь в сети самых прибыльных отраслей в мире. Только Myriad Genetics имеет ежегодный доход примерно полмиллиарда долларов. Диагностика на наличие дефектов в гене рака молочной железы составляет 85% от общего дохода компании, которая владеет патентом на BRCA.
По иронии судьбы, несмотря на то, что мы входим в век индивидуальной медицины, способность врачей на самом деле использовать такие достижения на благо своих пациентов в настоящее время глубоко ограничена. Ведь врач не может анализировать ДНК, не нарушая при этом патентных прав!
Травма ткани и хирургия могут повысить риск заболевания раком!
Модели эпителиальных клеток показали, что травма груди сама по себе может вызвать рак. Латентный период между травмой и раком обычно составляет около 5 лет. Таким образом, физическая травма может вызвать рак молочной железы.
Новое исследование показало, что малейшие царапины у мышей могут спровоцировать рост раковых клеток. Поэтому некоторые виды рака группируются вокруг ожогов, хирургических шрамов и других повреждений. Если у вас есть предрасположенность к раку, травма может повысить риск его развития. Эти данные свидетельствуют о том, что развитие рака возможно в оставшейся или окружающей ткани груди после радикальной операции (и даже после двойной мастэктомии!). Игольчатая биопсия также может стать причиной рака!
Эпигенетика – ответ для тех, кто ищет методы профилактики рака молочной железы
Эпигенетика доказывает, что ваш генетический код не может быть приговором, как считалось ранее. На самом деле есть возможность контролировать экспрессию генов. Гены экспрессируются или подавляются в зависимости от среды, в которой они оказались. То есть играет роль наличие или отсутствие соответствующих питательных веществ и токсинов. На наше здоровье даже влияют мысли и чувства, которые вызывают гормональные колебания в организме.
В научно-исследовательской работе под названием «Дело против тестирования BRCA1 и BRCA2», опубликованной в журнале «Хирургия» 30 июня 2011 года, четыре автора из отделения хирургии Калифорнийского университета объясняют то, что многие онкологи не хотят слышать:
«Получается, что, как и книга, ген может быть прочитан назад и вперед. Небольшие участки (или главы) в пределах большого гена могут «быть прочитаны» в одиночку. Трехмерной структурой ДНК управляет процесс метилирования, который вообще предотвращает от «чтения» многие главы. Кроме того, короткие сегменты РНК (22 пары оснований микро-РНК) могут вернуть цикл обратно, чтобы управлять транскрипцией ДНК. Таким образом, ДНК – это только отправная точка. Являются BRCA1 и BRCA2 уникальными? Или, как и у других генов, их экспрессия регулируется внутриклеточными отношениями (эпигенетическими и экологическими) индивидуального пациента?
BRCA1 и BRCA2 кодируются ядерными белками, которые также известны как супрессоры генов опухолей, способные ремонтировать поврежденную ДНК. Обе мутации увеличивают пожизненный риск рака молочной железы у женщин. У менее 5% женщин с диагнозом карцинома протоков или инвазивный рак протоков диагностируют гены BRCA».
В целом, авторы утверждают, что для скрининга и лечебных целей, генетическое тестирование BRCA1 и BRCA2 является лишь «дорогим способом определения», поскольку: 1) Последовательность пары оснований ДНК у всех людей идентичны на 99,6%; 2) Эпигенетические факторы существенно обрабатывают РНК и влияют на сообщения ДНК; 3) Есть тысячи вариантов последовательности генов BRCA1 и BRCA 2 генов; 4) Семейная история с генами BRCA1 и BRCA2.
Профилактика рака молочной железы
Таким образом, важно понимать, что, хотя многие благонамеренные врачи и средства массовой информации будут стремиться убедить вас в ценности скрининга рака, это не в коей мере не приравнивается к профилактике рака. Хотя раннее обнаружение важно, очень популярные методы скрининга могут причинить больше вреда, чем пользы.
В крупнейшем обзоре, проведенным Американским институтом исследований рака, было показано, что около 40% случаев рака молочной железы в США можно было бы предотвратить, если бы люди изменили свой образ жизни. Если вы будете строго соблюдать приведенные ниже рекомендации, то сможете снизить свой риск рака молочной железы на 75%.
- Не употребляйте сахар, особенно фруктозу. Все формы сахара вредны для здоровья в целом и способствуют раку.
- Оптимизация витамина Д. Витамин Д влияет практически на каждую клетку организма человека и является одним из самых мощных истребителей рака. Витамин Д способен войти в раковые клетки и вызывает их апоптоз (гибель клеток). Если у вас рак, ваш уровень витамина Д должен быть между 70 и 100 нг/мл. Если вы принимаете перорально высокие дозы добавок витамина Д3, то должны увеличить употребление витамина K2.
- Оптимизация витамина А. Существует доказательство того, что витамин А играет роль в профилактике рака молочной железы. Лучше получать это вещество из богатых витамином А продуктов (яичные желтки, сырое масло, сырое цельное молоко, говядина или куриная печень).
- Лимфатический массаж груди повышает естественную способность вашего организма устранять раковые токсины.
- Не поджаривайте сильно мясо, потому что такой способ приготовления связан с повышенным риском рака молочной железы. Во время жарки мяса образуется очень вредный канцероген акриламид.
- Не употребляйте пресные соевые продукты. Неферментированная соя содержит много растительных эстрогенов, или фитоэстрогенов. В некоторых исследованиях показано, что соя работает совместно с эстрогеном человека, увеличивая пролиферацию клеток молочной железы, что повышает шансы на мутацию и образование раковых клеток.
- Постарайтесь улучшить чувствительность рецепторов к инсулину. Лучший способ сделать это – избегать сахара и зерновых продуктов, а также выполнять физические упражнения.
- Поддерживайте здоровую массу тела. Это произойдет естественным образом, если вы начнете правильно питаться и регулярно выполнять упражнения. Важно потерять лишний жир тела, поскольку он производит эстроген.
- Ежедневно пейте 0,5 л органического зеленого овощного сока.
- Употребляйте качественные животные омега-3 жиры (как масло криля). Дефицит омега-3 жиров является общим основополагающим фактором для рака.
- Куркумин – это активный ингредиент в куркуме, который в высоких концентрациях может быть очень полезной добавкой в лечении рака молочной железы. Эта добавка показала огромный терапевтический потенциал в профилактике метастазов рака молочной железы.
- Избегайте алкоголя или ограничьте количество алкогольных напитков до одного в день.
- Кормите ребенка грудью до шести месяцев. Исследования показывают, что грудное вскармливание может снизить риск рака молочной железы.
- Не носите бюстгальтеры на косточках. Существует много данных, что такие бюстгальтеры могут усилить риск развития рака молочной железы.
- Избегайте электромагнитных полей. Даже электрические одеяла могут увеличить риск развития рака.
- Избегайте синтетической гормональной терапии. Рак молочной железы является эстроген-связанным раком. Есть также риски для молодых женщин, применяющих пероральные контрацептивы. Противозачаточные таблетки, которые также состоят из синтетических гормонов, связаны с раком шейки матки и раком молочной железы.
- Избегайте BPA, фталатов и других ксеноэстрогенов. Эти эстрогеноподобные соединения связаны с повышенным риском рака молочной железы.
- Убедитесь, что в вашем организме нет дефицита йода. Существуют убедительные доказательства, связывающие дефицит йода с раком молочной железы.
Спросите себя, что вы будете делать, если узнаете, что являетесь носителем гена рака молочной железы. В идеале, такой результат теста должен стимулировать вас серьезно заняться профилактикой. Но даже если у вас нет мутации, факторы образа жизни по-прежнему определяют риск рака молочной железы. Помните, процент выявленных случаев рака молочной железы при наличии мутантного гена составляет менее 5%!
medimet.info