Актовегин при миоме матки
Актовегин в гинекологии. Эндометрий. Бесплодие. ЭКО
Гинекология и Актовегин. Хронический эндометрит. Лечение бесплодия
С момента своего изобретения Актовегин за короткий срок вышел за рамки тех областей медицины, для которых его собственно и изобрели (неврология, кардиология). В настоящее время Актовегин нашел широкое применение в разных областях медицины, о чем мы уже немало писали в своих статьях.
В данной же статье мы поговорим о применении Актовегина в акушерско – гинекологической практике, в которой этот лекарственный препарат зарекомендовал себя как эффективное средство в борьбе с рядом проблем в патологии беременности. Об одной из таких проблем, а именно о проблеме плацентарной недостаточности, мы уже писали в статье Актовегин и беременность.
Сейчас мы поговорим о другом заболевании, которое может привести к женскому бесплодию (заболевание эндометрия), и о применении Актовегина для лечения этой патологии.
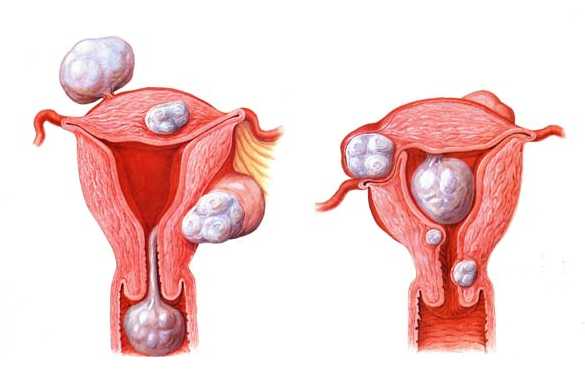
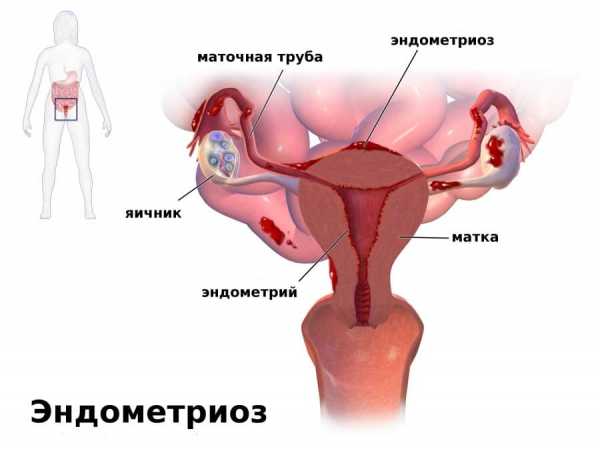
Эндометрий – внутренняя оболочка матки - под влиянием ряда патологических процессов может измениться настолько, что это приводит к невозможности забеременеть (без специального лечения).Причем у женщин репродуктивного возраста встречается хронический эндометрит (ХЭ) – по разным данным – примерно, от трех до семидесяти трех процентов. Следует отличать эндометрит (инфекционный воспалительный процесс эндометрия) от эндометриоза (доброкачественные образования).
В чем причина образования эндометрита?Причин немало, но наиболее частыми причинами являются следующие:
внутриматочные манипуляции и, главным образом, аборты; воспалительные заболевания (включая болезни, передающиеся половым путем); гормональные нарушения в женском организме и др.В результате этих процессов возникают заболевания. И одним из таких заболеваний является хронический эндомeтрит, о котором мы пишем в этой статье.
Эндометрит встречается среди рожавших женщин без родовых осложнений (в послеродовом периоде таких два- семь процентов) и среди рожавших с гнойно-воспалительными послеродовыми осложнениями (примерно, сорок процентов женщин). При этом тяжелая форма эндометрита встречается где-то у 25% рожениц (в послеродовом периоде).Воспаление слизистой оболочки матки (эндометрит) – наиболее частое воспаление после абортов (примерно, каждый десятый аборт заканчивается развитием эндометрита). Если учесть количество абортов, можно себе представить, как часто встречается эндометрит, ведущий к невынашиванию беременности. Эндометрит может возникнуть и после необходимых лечебно – диагностических выскабливаний матки, и в ряде других случаев.
У женщин с хроническим эндометритом в шестидесяти процентах случаев наблюдается бесплодие, а в сорока процентах случаев – неудачные попытки экстракорпорального оплодотворения (ЭКО) и переноса эмбрионов.
В процессе развития эндометрита происходят метаболические нарушения, наблюдаются процессы гипоксии, ишемии и оксидативного стресса.
Сегодня для диагностики патологического процесса внутри матки используют гистероскопию.По каким признакам определяют воспалительный процесс в эндометрии?
Примерно, в трети случаев - это неравномерность толщины эндометрия, еще в трети случаев – полиповидные нарастания и т.д. Типичных макроскопических признаков ХЭ нет, поэтому определить эндометрит по данным гистероскопии удается максимум в трети случаев. Нужна эта процедура обследования, чтобы определить полную картину внутриматочной патологии при подозрении на ХЭ. А для постановки диагноза важно морфологическое исследование эндометрия (диагностическое выскабливание слизистой оболочки матки).Только после тщательного обследования проводят лечение ХЭ, причем применяют комплексное поэтапное лечение, которое базируется на данных обследования (проводят антибактериальное лечение, коррекцию иммунитета). На втором этапе лечения ХЭ проводят метаболическую терапию. Данный этап лечения крайне важен: используют метаболические препараты (не менее месяца). Одним из наиболее ярких представителей этой группы препаратов является Актовегин, терапия которым очень важна в данный период комплексного лечения хронического эндометрита.
Компоненты Актовегина – аминокислоты, олигосахариды, олигопептиды, ферменты, очень важные макро- и микроэлементы и т.д.- обладают огромной биологической активностью. Так, например, очень важен макроэлемент магний для синтеза клеточных пептидов, и микроэлементы (например, медь) очень важны для супероксиддисмутаза - одного из главных ферментов антиоксидантной защиты. Под влиянием Актовегина клетки повышают потребление глюкозы и лучше утилизируют кислород. Активируется клеточный метаболизм, энергетические ресурсы клетки растут (более подробно о препарате Актовегин можно прочесть в статьях Актовегин - уникальный препарат; Фармакологическое действие и свойства Aктовегина).
Актовегин выпускается и в форме раствора для инъекций и инфузий, и в виде таблеток. А это очень удобно. Поэтому те пациентки, которые не могут лечь в стационар или ездить на уколы, принимают Актовегин дома перорально перед едой, запивая небольшим количеством воды.Принимать нужно дважды в день по таблетке в течение месяца.
Лечение Актовегином назначает врач.Если есть возможность внутривенно вводить Актовегин, то это делают по следующей схеме:
инфузии Актовегина- к двумстам- тремстам мл основного раствора (0,9-процентный раствор NaCl или 5-процентный раствор декстрозы) добавляют десять – двадцать мл Актовегина. В/в вливания делают через день (минимум две недели). Скорость введения - около двух мл в минуту.
Актовегин производит выраженный антиоксидантный и противоишемический эффект.
Актовегин хорошо сочетается с другими лекарствами, а это очень важно при комплексном лечении хронического эндометрита.
После проведения полного комплекса лечебных мероприятий по устранению эндометрита - не ранее чем через два месяца- должен быть проведен контроль эффективности лечения заболевания.
Борьба с бесплодием – это не только медицинская, но и социальная проблема. Возможно, вам будут интересны отзывы наших читателей об Актовегине, цена препарата, а также применение Актовегина в терапии патологической беременности (здесь и тут) или вы захотите узнать о методе укрепления иммунитета с помощью иммуномодуляторов.
www.aktovegin.su
На какие противопоказания при миоме надо обратить особое внимание
С каждым годом количество женщин, у которых выявляют миому (фибромиому) становится все больше. По сравнению с показателями 2010 года число заболевших выросло более чем на 30%. На данный момент медицина находится на том уровне, когда можно однозначно утверждать, что заболевание излечимо, и чем раньше оно будет выявлено, тем легче пройдет период санации.
Содержание:
Миома - диагностика, симптомы
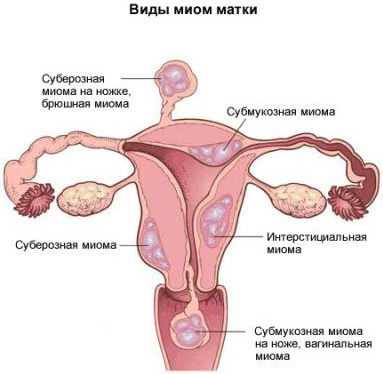
Миома является доброкачественной опухолью, образуется она из соединительных тканей матки и мышечных. Точнее существует два типа миомы, каждый из которых развивается из своей группы мышечных тканей:
- Рабдомиома образование в поперечно-полосатой мышечной ткани матки, его и называют миомой.
- Лейомиома вырастает в гладкой мускулатуре матки, вторым ее названием служит фибромиома.
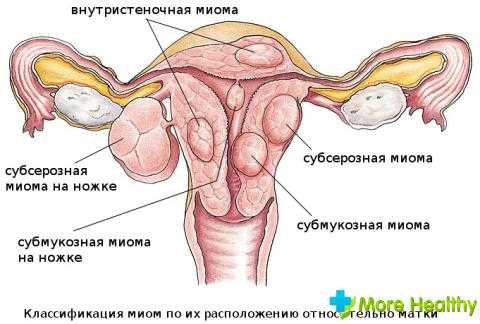
Узлы располагаются непосредственно в теле матки, иногда в шейке органа. Могут быть единичными или образовывать группы. Первопричинами возникновения миоматозных узлов считаются:
- поврежденный миометрий – к этому приводят ношение внутриматочных контрацептивов длительный период или неправильная их установка, выскабливание при аборте;
- различные нарушения гормонального фона – к этому приводят различные проблемы в эндокринной системе.
Вышеперечисленные причины являются основными источниками возникновения миомы. Безусловно, что каждой из них предшествуют различные отклонения или проблемы с общим здоровьем женщины. Но помимо этого существует еще ряд второстепенных факторов, которые также могут спровоцировать возникновение и развитие фибромиомы. К ним можно отнести:
- нестабильное состояние психики вследствие постоянных стрессов, что весьма характерно для образа жизни современных женщин;
- генетическая склонность;
- аборты;
- нерегулярная половая жизнь;
- различные виды нарушения менструального цикла;
- плохие экологические характеристики в регионе проживания женщины;
- снижение иммунитета, проистекающее из других заболеваний.

При этом следует еще раз акцентировать внимание женщин на том факте, что чем раньше будет диагностирована миома, тем быстрее и легче будет терапия. Одной из самых больших проблем врачи считают психологическую боязнь женщины постановки подобного диагноза, подсознательно большинство считают миому одной из форм рака и приходят к врачу уже на поздних стадиях, когда лечение проходит тяжелее, отнимает много времени и сил. Также стоит помнить о целом ряде противопоказаний, которые существуют для женщин, у которых уже диагностирована любая форма миомы.
Ограничения различного характера при наличии миоматозных узлов
Для того чтобы миома у женщин репродуктивного возраста нанесла наименьший ущерб функции деторождения, ее необходимо вовремя диагностировать, лечить и соблюдать определенный режим, не нарушая противопоказаний.
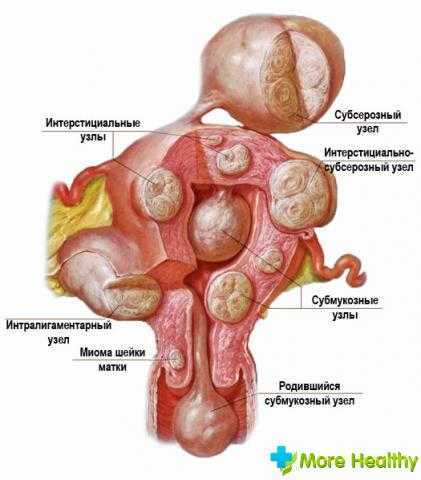
Можно сказать, что существует свод правил, придерживаясь которых, можно не нанести своему подорванному здоровью еще больший ущерб и облегчить процесс лечения:
- Женщина, которой поставлен диагноз миома, просто обязана избегать различных стрессов, которые однозначно влияют на гормональный баланс организма, что неминуемо приводит к осложнению ситуации с ростом опухоли.
- Категорически запрещается носить тяжести, нарушение данного правила приводит к осложнениям и опущению матки.
- Нельзя посещать процедуры в солярии, загорать под открытым солнцем, перегреваться. Также запрещены горячие ванны, посещение любого вида бань и саун, любых процедур, связанных с сильным тепловым воздействием.
- Процедуры массажа области живота, поясничного отдела и бедер также находятся под запретом, так как провоцируют развитие опухолевых образований.
- Различные виды коррекции фигуры также служат условным противопоказанием при миоме. Перед тем как делать ее, обязательно необходимо проконсультироваться с гинекологом. Наименьший риск несут процедуры криолипосакции и ультразвуковой липосакции.
- При миоме необходимо избегать нежелательной беременности и аборта. Оба этих фактора приводят к гормональному всплеску и вызывают активный рост опухоли.
- Различные спринцевания из народной медицины вызывают скептические высказывания у врачей, но при этом на них нет жесткого табу.
Рекомендации в питании при миоме
Отдельно стоит обговорить некоторые пищевые запреты. При миоме не стоит употреблять следующие продукты питания, т.к. их употребление приводит к активному росту опухолевых образований:
- хлеб на дрожжах;
- красное мясо;
- блюда, содержащие много животных жиров;
- большое количество жидкости.
В рацион стоит включить рыбу, орехи, имбирь, отруби и пророщенные злаки - все эти компоненты помогают в процессе продвижения к положительным результатам лечения.
Невозможно утверждать, что данные правила являются окончательными или могут служить панацеей от данного недуга, но то, что их соблюдение приводит к облегчению процесса лечения и не дает развиваться опухоли, подтвердит любой врач. Ни в коем случае не стоит еще больше рисковать своим здоровьем и нарушать несложные запреты. Каждая женщина, которая заботится о своем здоровье, обязана регулярно проходить гинекологическое обследование для своевременного выявления различных женских заболеваний, в том числе и миомы.
morehealthy.ru
Способ лечения миомы матки
Изобретение относится к медицине, в частности к гинекологии, и касается лечения миомы матки. Для этого после селективной катетеризации в обе маточные артерии вводят по 100 мг актовегина в 2,5 мл и после этого тотчас осуществляют введение эмболизата. Способ обеспечивает безболевое течение постэмболизационного периода и уменьшение проявлений постэмболизационного синдрома.
Изобретение относится к медицине, в частности к гинекологии, и касается лечения миомы матки, преимущественно узловых форм, с помощью методики эмболизации маточных артерий (ЭМА).
Миома матки относится к числу наиболее распространенных доброкачественных опухолей женских половых органов, часто выявляемых у женщин репродуктивного возраста. По среднестатистическим данным частота ее после 30 лет достигает 25-50%. Примерно при 1/3 всех обращений в гинекологические клиники диагностируется эта опухоль (Кулаков В.И., Адамян Л.В., 2000). В 53,3-63,5% миома матки диагностируется в возрасте 40-50 лет; чаще встречается среди женщин, занятых умственным трудом - 60,1%, в отличие от женщин, занятых физическим трудом - 9,4% (Гилязутдинова З.Ш., 2004). По данным литературы, в настоящее время увеличивается частота развития миомы матки у женщин юного возраста. Проблема лечения больных миомой матки актуальна в современной гинекологии в виду высокой частоты этой патологии, а также ее отрицательного влияния на репродуктивную систему и общее состояние здоровья женщины.
В настоящее время лечение миомы матки проводится консервативным, хирургическим и комбинированным методом. Консервативная терапия заключается в назначении медикаментозных средств (нейролептиков, иммуномодуляторов, общесоматических и гормональных), физиотерапевтических, бальнеологических методов лечения. Современная гормонотерапия располагает большим арсеналом лекарственных препаратов, применение которых тормозит рост и уменьшает размеры миомы матки, но после прекращения лечения, как правило, наблюдаются рецидивы заболевания. Основным методом лечения миомы матки остается хирургический. Значимость проблемы подчеркивается тем фактом, что гистерэктомия во всем мире остается наиболее частой гинекологической операцией (52-94% больных). Объем хирургического вмешательства может быть радикальным: гистерэктомия, и консервативным: миомэктомия. Однако удаление матки приводит к развитию постгистерэктомического синдрома, а удаление миоматозных узлов в 30% случаев приводит к рецидиву.
Как указывалось ранее, в последние годы наблюдается «омоложение» миомы матки, в связи с чем возникает необходимость сохранения генеративной функции женщины.
Современная диагностика, выбор адекватного метода лечения миомы матки, а также оценка результатов являются актуальными в настоящее время.
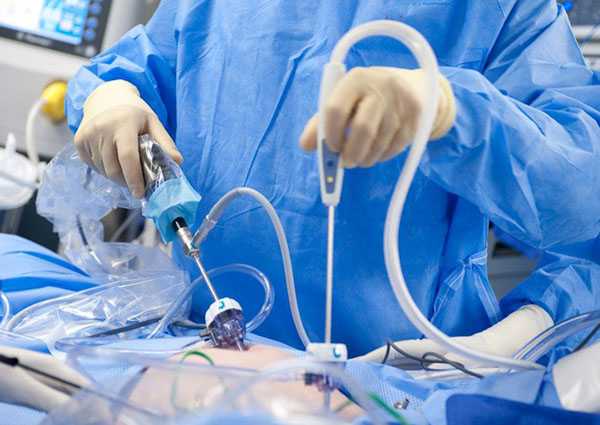
В последние годы с развитием эндоваскулярной хирургии метод эмболизации маточных артерий (ЭМА) нашел широкое применение в лечении миомы матки. ЭМА - малоинвазивная неоперационная органосохраняющая процедура, является достаточной альтернативой хирургическому лечению.
ЭМА применяется с 1979 года с целью остановки тяжелых послеродовых и посттравматических маточных кровотечений. В 1990 году Jacques Ravina, применяя эмболизацию маточных артерий для предоперационной подготовки женщин с миомами матки при наличии гиперваскуляризированных опухолей, отметил, что у некоторых больных в результате проведенной манипуляции купировались основные симптомы и не требовалось хирургического лечения. В сентябре 1995 г.в журнале The Lancet впервые Жак Равина опубликовал статью о лечении миомы матки с использованием ЭМА. В настоящее время метод ЭМА широко применяется в лечебных учреждениях США, Европы, стран Азии и Ближнего Востока. В 1996 г. ЭМА получила разрешение FDA в США, а в 1998 году приказом Минздрава РФ была включена в перечень разрешенных эндоваскулярных вмешательств. В Европе и США проведено более 300000 процедур ЭМА. В настоящее время по всему миру, в том числе и ведущими клиниками нашей страны, ежегодно выполняются более 100000 эмболизаций.
В патогенезе миомы матки, как известно, важную роль играет неоангиогенез, активизирующийся при опухолевом росте. По мере гипертрофии миометрия и роста массы опухоли в капиллярной сети миометрия, прилежащего к миоматозным узлам, полностью исчезает характерная для нормального миометрия архитектоника капиллярной сети - ее петлисто-ячеистый рисунок, капиллярная сеть становится бесформенной, хаотичной, появляется неравномерность заполнения сосудов кровью, в них появляются стазы, капилляры часто приобретают извилистый ход. Ангиоархитектоника капиллярной сети «интактного» миометрия в части случаев сохраняет свой нормальный вид (Савицкий Г.А., Савицкий А.Г., 2003).
Сосуды перифиброидного сплетения - хаотичной сосудистой сети, окружающей миому по периферии, представлены дуговыми и радиальными артериями, огибающими узел и отдающими внутрь опухоли слабовыраженную питающую капиллярную сеть. Сосуды миомы имеют диаметр до 0,5 мм, что в несколько раз больше диаметра артерий нормального миометрия. Во время ЭМА вводимые частички поливинилалкоголя (PVA) определенного размера (300-700 микрон) с током крови мигрируют лишь до периферических разветвлений маточных артерий соответствующего диаметра и накапливаются в них, вызывая сегментарную закупорку сосудов. При этом дистальные отделы сосудистого русла неизмененного миометрия остаются проходимыми и через короткий промежуток времени начинают кровоснабжаться по коллатеральным сосудам, что способствует постепенному устранению ишемии ткани органа. Огромное значение в этом механизме имеют анастомозы между яичниковыми ветвями маточной артерии и собственно яичниковыми артериями, отходящими от аорты. Капиллярные разветвления самих миоматозных узлов не имеют анастомозов на концевых участках, поэтому попадающие в них частички PVA приводят к стойкой закупорке питающих сосудов, что и обусловливает избирательный эффект эндоваскулярного вмешательства и его воздействие только на саму миому (Доброхотова Ю.Э., Капранов С.А., Бобров Б.Ю., Алиева А.А., Гришин И.И.). После введения эмболизационных частиц миома теряет кровоснабжение и происходит ее замещение соединительной тканью - фиброз, что приводит к значительному уменьшению и/или исчезновению миомы и ее проявлений.
Ближайшим аналогом предлагаемого способа является способ лечения миомы матки путем селективной эмболизации маточных артерий, предложенный Жаком Равина (Ravina J.H., Arterial embolization to treat uterine myomata. Lanset 1995; 346: 671-672). Под местной анестезией кожи в верхней трети бедра трансфеморальным доступом под контролем рентгенотелевидения проводится поочередная катетеризация маточных артерий, после чего выполняется ангиограмма с последующим введением в сосуды миомы эмболизирующих частичек поливинилалкоголя (PVA), что приводит к полной окклюзии сосудистого русла и магистральной артерии.
Катетеризация маточных артерий всегда проводится с двух сторон, так как кровоснабжение даже одного узла может осуществляться из разных сосудов, маточно-яичниковых анастомозов разных типов (Б.Ю.Бобров, С.А.Капранов, Ю.Э.Доброхотова, И.А.Краснова, H.А.Шевченко, Д.Д.Алиева, В.Б.Аксенова. Эндоваскулярная хирургия сердца и сосудов, стр.198).
ЭМА вызывает ишемию миомы, в результате чего происходит острая гипоксия и некротические изменения в тканях. Это приводит к появлению болевых ощущений различной интенсивности, кровяных выделений из влагалища, повышению температуры тела, слабости, недомоганию, нарушению функции мочевого пузыря и кишечника, изменению показателей крови, то есть к развитию «постэмболизационного синдрома» (Ю.Э.Доброхотова, С.А.Капранов, Б.Ю.Бобров, А.А.Алиева, И.И.Гришин, Российский вестник акушера-гинеколога, 2, 2005, 44-49). В зависимости от степени выраженности его симптомов проводится обезболивающая, инфузионная, противовоспалительная, антибактериальная терапия.
Цель изобретения: уменьшить указанные осложнения за счет предварительного увеличения паренхиматозного кровотока миоматозно измененной матки до проведения ЭМА, что способствует более качественной эмболизации вследствие проникновения частичек ПВА в спазмированные ранее капилляры миомы и, соответственно, уменьшению ишемических участков в ней и улучшению кровоснабжения в здоровых тканях миометрия, что предотвращает развитие грубых морфологических изменений в матке, приводящих к постэмболизационным осложнениям. Для достижения эффекта увеличения паренхиматозного кровотока нами использовался актовегин в растворе для инъекций по 200 мг/5 мл, который делили на равные доли и вводили по 100 мг/2,5 мл в каждую маточную артерию, при этом рассчитывали на улучшение кровообращения, которое обеспечивает актовегин, а также на его метаболический эффект в миометрии, а именно активирование процессов аэробного окисления, повышение утилизации кислорода тканями, активизацию ферментов системы антиоксидантной защиты, повышение толерантности ткани к гипоксии.
Модифицированная методика ЭМА.
Способ осуществляется следующим образом:
- под местной анестезией в верхней трети правого бедра проводится пункция бедренной артерии;
- катетер с кончиком pig-tail проводится до уровня несколько ниже почечных артерий и выполняется тазовая ангиография с целью уточнения анатомии маточных артерий;
- в контралатеральную маточную артерию устанавливается катетер Робертс (COOK) или «кобра» и проводится селективная катетеризация маточной артерии под контролем радиотелевидения;
- вводится контрастное вещество и последующая ангиография для визуализации сосудов матки;
- вводится 100 мг (2,5 мл) актовегина в маточную артерию;
- вводится эмболизат, например такой, как поливинилалкоголь (PVA 500 фирма COOK: 500-710 микрон) в смеси с контрастным веществом в количестве, необходимом для полного прекращения антеградного кровотока по артерии;
- катетер Робертс устанавливается в ипсилатеральную артерию и вышеуказанная манипуляция проводится на противоположной стороне.
Данная методика: введение актовегина по 2,5 мл/100 мг с каждой стороны - была эффективна независимо от размеров и локализации миомы.
С 2004 г нами проводится эмболизация маточных артерий с целью лечения миомы матки, с 2005 года ЭМА проводится в нашей модификации с использованием актовегина.
Лечение методом ЭМА в модифицированной нами методике с применением актовегина проведено у 11 пациенток, 20 больных составили контрольную группу, которым проводилась стандартная ЭМА. ЭМА проводилась у больных со следующими разновидностями миомы матки:
- общим увеличением от 6 до 15 недель беременной матки;
- наличием одного узла и с множественными узлами;
- в сочетании с аденомиозом;
- межмышечным расположением узлов и узлами с центрипитальным и субсерозным ростом;
- наличием узла с нарушением питания в нем.
Течение постэмболизационного периода после проведения стандартной ЭМА характеризовалось разнообразными постэмболизационными симптомами: боли в животе, гипертермией до 38°С и выше; нарушением деятельности желудочно-кишечного тракта; симптомами острого живота; меноррагией; лейкоцитозом.
При проведении ЭМА по модифицированной методике с актовегином было достигнуто благоприятное течение постэмболизационного периода: боли были незначительные, либо отсутствовали; повышение температуры тела не выше 37,0-37,5°С; нарушения функции ЖКТ не отмечено; выделения из половых путей скудные и отмечены только у 2 больных; количество лейкоцитов до 8,0 до 11,5*10^9/л, пребывание больных в стационаре после ЭМА составило 1-2 суток.
Пациенты, как опытной, так и контрольной группы, находились под динамическим наблюдением: проводился осмотр, УЗИ органов малого таза через 1, 3, 6, 9 месяцев. Уменьшение размеров миомы матки происходило одинаково в обеих группах.
Таким образом при использовании новой модифицированной методики ЭМА с использованием актовегина отмечено практически безболевое течение постэмболизационного периода. Применение вышеуказанной методики обеспечило значительное уменьшение проявлений постэмболизационного синдрома при сохранении эффективности указанной манипуляции в плане уменьшения размеров миомы и ее проявлений.
Клинические примеры.
Больная 3., 47 лет. История болезни № 919. DS: Миома матки, увеличение до 8 недель беременной матки с центрипитальным ростом узла (размер узла до 5,0 см в d).
01.02.05 г.: ЭМА проведена таким образом: трансфеморальным доступом проведена селективная катетеризация маточных артерий с последующим введением под флюороскопическим контролем 2,5 мл/100 мг актовегина и тотчас введение PVA-500 (COOK). В п/о периоде болевой симптом отсутствовал, температура тела держалась на нормальных цифрах, в анализе крови L - 5,3*10^9/л, фибриноген в норме. Контроль УЗИ в день выписки на 3 сутки - уменьшение размеров узла от 5,0 см до 3,2*3,0 см. Наблюдение в течение 9 месяцев: размер узла 2,5*2,2 см, нормализация менструального цикла, улучшение общего самочувствия.
Больная У., 26 лет. История болезни № 11099. DS: Множественная миома матки увеличением до 15 недель беременной матки. Хроническая анемия II ст. При УЗИ исследовании и гинекологическом осмотре выявлено множество узлов, расположенных во всех слоях и по всем поверхностям матки. 20.10.05 г.: ЭМА по модифицированной нами методике с актовегином: трансфеморальным доступом проведена селективная катетеризация маточных артерий с последующим введением под флюороскопическим контролем 2,5 мл/100 мг актовегина и тотчас введение PVA-500 (COOK). П/о период с незначительным болевым синдромом (купирование однократным введением трамадола и но-шпы), t до 37,3°С, в первые сутки - слабость, головокружение на фоне нормального АД, в анализе крови L - 11,5*10^9/л, фибриноген - 2,68. УЗИ через 3 суток: уменьшение размеров матки до 13 недель.
Больная 77., 37 лет. История болезни № 11427. DS: Миома матки 8 недель, нарушение питания узла. Поступила 25.10.05 г. с жалобами на тянущие боли внизу живота. По данным УЗИ и осмотра у пациентки выявлено нарушение питания миоматозного узла (интерстициальный узел 4,3*3,5 см по левому маточному ребру). Пациентке в 1 сутки внутривенно капельно введено 200 мг актовегина в 200,0 физ. раствора; 2,0 2% папаверина; 400,0 5% раствора глюкозы; 100,0 метрогила; 0,1 доксициклина в 200,0 физ. раствора. Через сутки 27.10.05 на фоне исчезновения болей проведена ЭМА по модифицированной методике с актовегином: трансфеморальным доступом проведена селективная катетеризация маточных артерий с последующим введением под флюороскопическим контролем 2,5 мл/100 мг актовегина и тотчас введение PVA-500 (COOK). В п/о периоде продолжена проводимая терапия. Болевой синдром - незначительный, применялись ректально свечи «диклофенак» 1 раз в день, температура тела на нормальных цифрах, в анализе крови L - 7,1*10^9/л, фибриноген - 3,26. УЗИ 29.10.05: узел 3,5*2,8 см, контуры четкие. Выписка 29.10.05 - на 2 сутки после ЭМА.
Заключение.
Впервые предложена, разработана и использована в клинической практике оригинальная модифицикация эмболизации маточных артерий при лечении миомы матки. Способ эмболизации маточных артерий с предварительным введением актовегина позволяет достичь более благоприятное течение постэмболизационного периода: безболевое течение или с незначительными болевыми ощущениями; сокращение послеоперационного койко-дня; уменьшение количества используемых медикаментов без ущерба эффективности проведенной манипуляции и ее ближайших и отдаленных результатов лечения.
Способ лечения миомы матки путем эмболизации маточных артерий, отличающийся тем, что после селективной катетеризации в обе маточные артерии вводят по 100 мг актовегина в 2,5 мл и после этого тотчас осуществляют введение эмболизата.
www.findpatent.ru