Рак и эндометриоз
Эндометриоз и рак яичников
Вопрос о возможности трансформации эндометриоза в рак яичников является очень важным, так как восприятие эндометриоза как заболевания без учета онкологического аспекта было бы неполным.
Впервые морфологическая взаимосвязь между эндометриозом и эндометриоидным раком яичников была выявлена Sampson в 1925 г. В последующем на ассоциацию этого заболевания со злокачественным процессом стали обращать внимание и другие исследователи. Опираясь на большой клинико-морфологический материал, Я. В. Бохман предположил, что последовательность событий при малигнизации эндометриоза отчетливо выступает лишь в ранней стадии развития рака. О повышенной способности к малигнизации эктопического эндометрия сообщают Ogava, Ybshikava. Существует мнение, что в эндометриоидном очаге может развиваться практически любой тип злокачественной опухоли, поскольку особенностью эндометрия являются большой потенциал роста и значительный полиморфизм клеток.
Наиболее частое сочетание эндометриоза и эндометриоидной аденокарциномы наблюдается в яичниках. На фоне овариального эндометриоза у 0,7—5% женщин отмечается процесс возникновения рака яичников. D.H. Barlow в работе «Происхождение эндометриоза — все еще загадка» подчеркнул, что сущность эндометриоза изучена недостаточно. Поэтому необходимо дальнейшее углубленное изучение патогенеза эндометриоза.
Указания на эндометриоз как заболевание отмечены еще около 300 лет назад. В конце XVII в. было описано обнаружение перитонеальных язв на поверхности мочевого пузыря, кишечника, матки. В XVIII столетии похожие на эндометриоз признаки отмечали в виде спаек, тканевых дефектов и тазовых болей. Лишь только с развитием микроскопии в XIX в. удалось идентифицировать эктопическую ткань эндометрия. В 1854 г. Muller, а в 1860 г. Van Rokitansky выявили эктопическую локализацию ткани эндометрия у человека. Гистологическая картина внутреннего эндометриоза в 1896 г. впервые была описана Van Rokitansky и им же применен термин «аденомиома», а термин «эндометриоз» предложил еще в 1892 г. B. Bell.
Известны многочисленные теории, объясняющие генез эндометриоидных гетеротопий, в частности, около 11 концепций, в которых сделана попытка объяснить возникновение этого заболевания с различных позиций.
Различные гипотезы сводятся к 2 основным утверждениям:
1) происхождение эндометриоза из эндометрия (транспорт—перенос);
2) эндометриоз — локальное новообразование (трансформация-превращение).
Первое утверждение включает теории лимфогенной, гематогенной и ятрогенной диссеминаций, а также ретроградной менструации. Отличает эти теории лишь способ переноса клеток эндометрия за пределы его физиологической локализации. Второе утверждение касается эмбриональной и метапластической теорий. Наибольшее признание получила имплантационная теория.
Все известные причины, провоцирующие эндометриоз, включают экзогенные и эндогенные факторы. К последним относят гормональные, иммунологические, биохимические, генетические.
Связь с неблагоприятными экологическими и стрессовыми факторами: в основе реализации эффекта экзогенных «провокаторов» эндометриоза лежит избыточное образование свободных радикалов. Не случайно частота заболевания увеличена в промышленно развитых центрах, где прослеживается определенная зависимость от степени загрязнения окружающей среды. Причем именно в этих неблагоприятных для здоровья экологических условиях особенно часто отмечается злокачественное перерождение эндометриоидной ткани.
По мнению некоторых ученых, усиление роста гетеротопического эндометрия при эндометриозе обусловлено увеличением количества продуктов пероксидации липидов (следствие окислительного стресса). Считается, что повышение объема перитонеальной жидкости при эндометриозе объясняется действием свободных радикалов на липидную оболочку мембран клеток мезотелия, вследствие которого мелкие молекулы свободно проходят в брюшную полость.
Известно, что фермент ароматаза катализирует конверсию андростендиона и тестостерона в эстрон и эстрадиол. Фермент экспрессируется рядом человеческих тканей и клеток, таких как гранулезные клетки яичников, плацентарный синцитиотрофобласт, клетки жировой ткани, и фибробластами кожи, а также мозгом. У женщин репродуктивного возраста яичники — наиболее важное место биосинтеза эстрогенов, который происходит циклически. При повышении связывания фолликулостимулирующего гормона (ФСГ) с его рецептором парного G- протеина на мембранах гранулезных клеток начинается рост внутриклеточного уровня циклического аденозинмонофосфата (цАМФ) и усиливается связывание двух важных транскрипционных факторов — стероидогенного фактора-1 (SF-1) и цАМФ- ответственного элементосвязывающего протеина (CREB) с промоутером гена ароматазы. Тот, в свою очередь, активирует экспрессию ароматазы, и в результате происходит секреция эстрогенов из преовуляторного фолликула.
Другой внегонадный процесс образования эстрогенов у женщин в постменопаузе происходит в жировой ткани, коже. По сравнению с регуляцией экспрессии ароматазы в яичниках цАМФ этот путь контролируется главным образом цитокинами (интерлейкины — ИЛ-6, -11, фактора некроза опухоли-а) и глюкокортикоидами через альтернативное использование промоутера в жировой ткани и коже. Основным субстратом здесь является андростендион надпочечникового происхождения. В постменопаузе у женщин около 2% циркулирующего андростендиона конвертируется в эстрон, далее переходящий в эстрадиол в периферических тканях. Это может значительно повысить уровень эстрадиола, способного привести к гиперплазии или карциноме.
Известно, что эндометрий и миометрий содержат самое высокое количество эстрогеновых рецепторов, являясь, таким образом, главной мишенью для эстрогенов. До недавних пор действие эстрогенов рассматривалось только через эндокринные механизмы: за счет циркуляции эстрадиола, который секретируется яичниками или образуется из жировой ткани, обеспечивая эстрогенный эффект после доставки к тканям-мишеням через кровь. Исследования экспрессии ароматазы в опухолях молочной железы показали, что паракринные механизмы играют важную роль в реализации действий эстрогенов в тканях. Эстроген продуцировался путем активации ароматазы фибробластами жировой ткани молочной железы и способствовал росту ее соседних малигнизированных эпителиальных клеток. Следовательно, показан интракринный эффект эстрогена при лейомиоме матки и эндометриозе, так как эстроген, продуцированный с помощью активации ароматазы в цитоплазме гладкомышечных клеток лейомиомы матки или стромальных эндометриоидных клеток, смог вызвать эти эффекты путем быстрого связывания с их ядерными рецепторами в некоторых клетках. Контрольный эндометрий и миометрий свидетельствовали об отсутствии экспрессии ароматазы.
Среди эстрогензависимых заболеваний экспрессия ароматазы при эндометриозе имеет большое значение, доказанное многими авторами. Во-первых, исключительно высокий уровень ароматазы мРНК был найден на имплантатах внеяичникового эндометриоза. Во-вторых, стромальные клетки эндометриоидного происхождения в культуре инкубированных с цАМФ аналогично показали экстраординарно высокий уровень активности ароматазы по сравнению с синцитиотрофобластом. Эти интересные факты привели к исследованию факторов роста, цитокинов и других субстанций, которые могут индуцировать активность ароматазы через цАМФ-зависимые пути патофизиологии эндометриоза. Было выявлено, что PGЕ2 — наиболее известный индуктор активности ароматазы в стромальных эндометриоидных клетках. Эстрогены повышают образование PGЕ2 путем стимуляции фермента циклооксигеназы-2 в стромальных клетках в культуре. Таким образом, положительная обратная связь непрерывной локальной продукции эстрогена и синтеза простагландинов способствует пролиферативным и воспалительным характеристикам эндометриоза.
С одной стороны, PGЕ2 индуцирует поразительную активность ароматазы путем повышения уровней цАМФ в клетках эктопического эндометрия. С другой — ни аналоги цАМФ, ни PGЕ2 не были способны стимулировать заметную ароматазную активность в клетках эутопического эндометрия. Возникает вопрос: каковы молекулярные различия, которые приводят к экспрессии ароматазы в имплантатах и его подавлению в эутопическом эндометрии? Чтобы ответить на этот вопрос, исследователи решили использовать цАМФ. С этой целью для экспрессии ароматазы in vivo в ткани эндометрия был применен индуцированный промоутер. Затем было выявлено, что фактор стимуляции транскрипции SF-1 и воспалительный фактор, куриный промоутер фактора транскрипции (COUS-TF), являются конкурентными для связывания с областью промоутера ароматазы. COUS-TF экспрессировался как в эктопическом, так и в эутопическом эндометрии, в то время как SF-1 экспрессировался специфически в эндометриозе, но не в эутопическом эндометрии и связывался с промоутером ароматазы более активно, чем COUS-TF.
Таким образом, SF-1 и другие транскрипционные факторы активируют транскрипцию в эндометриозе, в то время как COUS-TF, который блокирует участок ДНК в эутопическом эндометрии, подавляет этот процесс. Можно предположить, что одним из молекулярных повреждений, приводящим к локальной экспрессии ароматазы в эндометриозе в отличие от нормального эутопического эндометрия, является нарушенная продукция SF-1 стромальными клетками эндометриоза, которые преодолевают защитное подавление в норме COUS-TF в эутопическом эндометрии.
Ароматаза была выделена в образцах эутопического эндометрия с серьезными формами эндометриоза при отсутствии в контроле, хотя в намного меньших количествах, чем в имплантатах эндометриоза. Это предполагает наличие генетического дефекта у женщин с эндометриозом, который выявляют в эутопическом эндометрии. Можно полагать, что когда дефективный эндометрий с низкими уровнями нарушенной экспрессии достигает тазовой брюшины путем ретроградной менструации, это приводит к воспалительной реакции. Она, в свою очередь, повышает локальную ароматазную активность, т.е. образование эстрогенов, индуцированных напрямую или ненапрямую простагландинами и цитокинами.
Доказательством важности ароматазной активности в патофизиологии эндометриоза служит успешное подавление уровня эстрадиола с аналогами гонадотропин-рилизинг-гормона (ГРГ) или индуцированной хирургической менопаузой. Купирование боли в области малого таза агонистами ГРГ обычно достигается уже в процессе лечения, в то время как боль, ассоциированная с эндометриозом, рецидивирует более чем в 75% случаев. Существует множество причин для неудачного использования агонистов, например, присутствие значительной продукции эстрадиола, содержащегося в жировой ткани, коже, имплантатах в процесс лечения агонистами. Следовательно, блокада ароматазной активности в экстраовариальных местах с ингибитором ароматазы может приводить к ремиссии в течение продолжительного времени у некоторых пациентов. Положительное влияние на болевой синдром при эндометриозе под действием ингибиторов ароматазы объясняется резким снижением эстрадиола и отсутствием вследствие этого стимуляции локального синтеза простагландинов.
В недавних публикациях показано, что пациентки с эндометриозом в периоде перименопаузы успешно лечатся комбинацией ингибитора ароматазы с гестагеном. При этом ранее у этих женщин радикальная хирургия или медикаментозная терапия были причиной для многократного рецидивирования или персистенции боли в процессе лечения. После 6 месяцев лечения летрозолом и норэтиндрон ацетатом большая часть пациенток отмечала облегчение боли и уменьшение лапароскопически выявляемого эндометриоза. Наблюдается улучшение результатов экстракорпорального оплодотворения при тяжелых формах эндометриоза в случае комбинации с агонистом ГРГ анастрозолом на этапе десенситизации гипофиза.
В различных исследованиях установлено важное значение ароматазы в генезе и других неестественных пролиферативных заболеваний, в том числе и рака яичников. Сообщается о значимой роли ароматазы в генезе рака молочной железы и эндометрия, а также об успешном использовании ингибиторов ароматазы в комплексном их лечении. Локальная гиперэстрогения, создающаяся в условиях патологической экспрессии ароматазы, способствует установлению определенной «автономности» очага, за счет чего поддерживается пролиферация ткани. Это свойство, присущее злокачественным заболеваниям, имеет место и при эндометриозе.
Было бы наивно полагать, что нарушенная экспрессия ароматазы является самым важным молекулярным механизмом в развитии и росте эндометриоза, поскольку существует множество других биомолекулярных механизмов, способствующих его развитию: нарушенная экспрессия энзимов- протеиназ, которые ремоделируют ткани, или их ингибиторов, цитокинов (ИЛ-6, RANTES) и факторов роста (EGF). К тому же, не совсем ясна роль защитных механизмов организма, ответственных за имплантацию и отторжение несвойственных данной локализации эндометриальных клеток. Однако значение исследуемых ароматаз, безусловно, велико в этиологии эндометриоза и, вероятно, эндометриоидного рака яичников.
Полезно:
surgeryzone.net
Онкологические аспекты эндометриоза
Освещение генитального и экстрагенитального эндометриоза было бы неполным без рассмотрения онкологических аспектов заболевания. Если 15—20 лет назад они сводились к возможности малигнизации эндометриоза и сосуществованию его и злокачественных опухолей половых органов, то в последнее время представляются более сложными и глубокими. История вопроса изложена в монографии В. П. Баскакова (1966).
Возможность малигнизации эндометриоза ни у кого не вызывает сомнений. Однако сведения об этом весьма разноречивы. Поданным R. Meyer (1930), R. Hanser (1936), S. Viars (1955), Б. И. Железнова и А. Н. Стрижакова (1985), озлокачествление эндометриоза представляется редким явлением. С другой стороны, G. Smith (1937) в 22% дифференцированных карцином яичника установил связь с эндометриозом. По данным В. Czernobilsky (1970), частота малигнизации эндометриоза и сосуществование его и рака яичников достигают 23,9 %. А. Е. Колосов (1978) наблюдал малигнизацию эндометриоза яичников в 11,4 %.
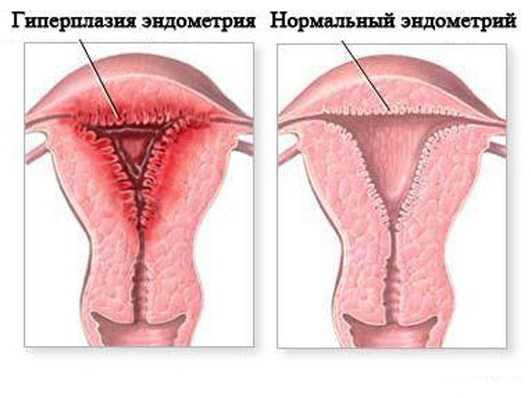
Я. В. Бохман, В. П. Баскаков, А. Е. Колосов (1979), обращая внимание на трудность решения разбираемого вопроса, указывали, что последовательность событий при малигнизации эндометриоза ясно выступает лишь в ранней стадии рака, когда удается проследить всю галерею структур от эндометриоза до инвазивного эндометриоидного рака. При дальнейшем росте опухоль может полностью занять тот участок, на котором она возникла, и «поглотить» ткани, которые ей предшествовали. Кроме того, возможна полная трансформация эндометриоза в раковые структуры. Поэтому Я. В. Бохман (1972, 1978) вполне обоснованно считает, что частота озлокачествления эндометриоза, по всей видимости, значительно превосходит регистрируемую в литературе.
Накопилась информация, свидетельствующая о повышенной склонности больных эндометриозом к опухолевым процессам в молочных железах, эндометрии и яичниках. Поданным В. Л. Винокурова (1987), при пограничных эндометриоидных цистаденомах яичников у каждой 10-й больной (10,3%) имеют место первично-множественные метахронные опухоли (рак эндометрия и молочной железы), что свидетельствует об общности патогенеза этих опухолей и необходимости целенаправленного обследования больных для получения представления о состоянии эндометрия и молочных желез.
А. В. Чиркова (1980) среди 150 больных раком цервикального канала у 28 женщин (19,6%) установила его сочетание с внутренним эндометриозом матки.
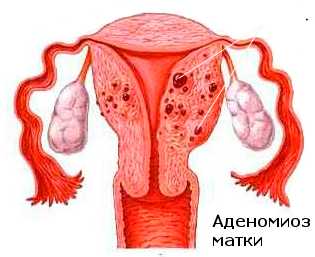
По данным Я. В. Бохмана, В. П, Баскакова, А. Е. Колосова (1979), исследование состояния миометрия и эндометрия у 140 больных раком тела матки позволило выявить гиперпластические процессы эндометрия в свободных от опухоли местах в 72,1 %, фибромиому матки — в 55,7 % и внутренний эндометриоз — в 17,8 % (25 больных). В. П. Баскаков и соавт. (1981) из 84 больных раком тела матки у 14 (16,6%) обнаружили внутренний эндометриоз тела матки.
У больных эндометриозом и раком тела матки и молочных желез имеют место ановуляция, эндокринное бесплодие, дисфункция иммунной системы, нарушение жирового и углеводного обмена, гиперпластические процессы в молочных железах.
Исследованиями А. Е. Колосова (1985) установлена зависимость прогноза от гистологического строения эндометриоза яичников. Так, склонность к пролиферации и малигнизации более выражена при железисто-кистозном варианте. Железистый, кистозный и стромальный варианты отличаются более благоприятным течением. Показана широкая гистогенетическая потенция овариального эндометриоза, который при определенных условиях обладает способностью стать почвой для всех опухолей эндо-метриоидной группы: аденом, аденокарцином, злокачественных аденофибром, стромальных сарком и мезодермальных смешанных опухолей яичников [Колосов А. Е., 1985].
У больных эндометриозом чаще развивается рак толстой кишки и желудка, особенно если эти органы были скомпрометированы (хронический спастический колит, гастродуоденит, язвенная болезнь желудка) и больным длительное время проводилось лечение прогестинами или эстроген-гестагенными препаратами.
www.medical-enc.ru
Эндометриоз
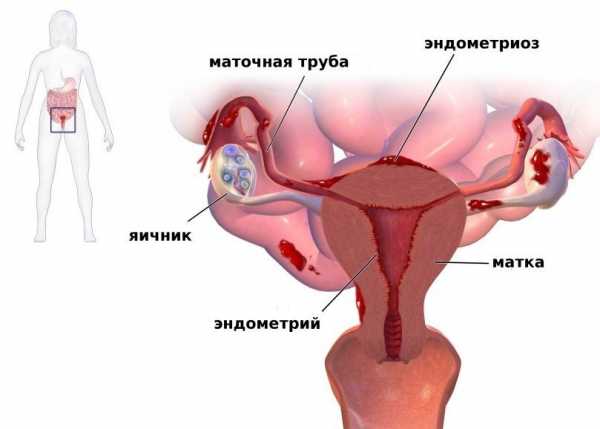
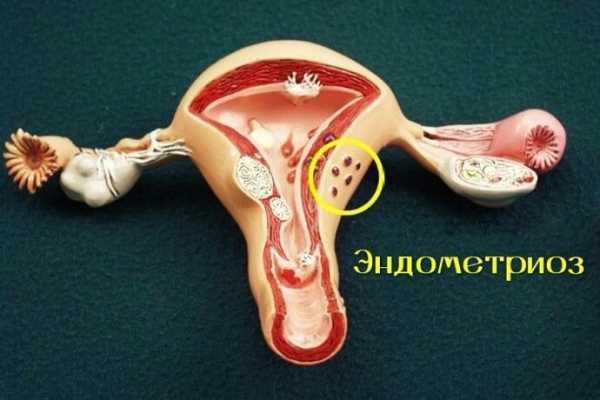
Эндометриоз - дисгормональное разрастание эндометрия на фоне дисфункциииммунной системы, суть которой заключается в разрастании ткани, которая сходна по своему строению с внутренней оболочкой матки, но находится за ее пределами в любом другом месте организма. Растет количество больных с запущенными формами эндометриоза, которые приводят к тяжелым деструктивных изменений соседних органов, что придает этому заболеванию сходство с онкологической патологией. Кроме этого у рака и эндометриоза есть еще несколько похожих черт:
Похожие черты рака и эндометриоза
- Способность эндометриоза к инфильтрирующему росту и распространению в окружающие ткани и органы с разрушением последних.
- Большая резистентность очагов эндометриоза к методам лечения (медикаментозным, диатермическим).
- Способность эндометриоза давать метастазы как контактным путем, так и гематогенным и лимфогенным путями.
- Значительное количество сосудов в очагах опухоли.
Климакс и менопауза, а также хирургическая или медикаментозная кастрация не исключают возможности перерождения в рак очага эндометриоза.Эндометриоз чаще развивается на фоне повышенного уровня женских половых гормонов, снижении функции желтого тела и сниженной функции коры надпочечников. Однако эндометриоз может развиваться и при нормальной и даже пониженной, но длительной стимуляции женскими половыми гормонами. В развитии эндометриоза также играют роль воспалительные процессы, хирургическая травма, наследственные факторы.
Симптомы эндометриоза
Эндометриоз матки - это наиболее частая локализация заболевания. Он может быть врожденным, возникать после хирургических вмешательств, особенно после частых абортов. Характерным симптомом являются болезненные месячные.Выраженность боли зависит от формы эндометриоза, от глубины врастания в ткань матки. Кроме этого у больных обнаруживается анемия, повышенная температура, увеличение видимых опухолей во время менструации.Для диагностики применяются дополнительные методы обследования - гистеро-сальпингография, цистоскопия, кольпоскопия, лапароскопия, УЗИ.При эндометриозе есть особенности протекания беременности - возможны самопроизвольный аборт, преждевременные роды, разрыв матки, слабость родовой деятельности, кровотечение. Среди причин бесплодия эндометриоз занимает третье место, у больных эндометриозом бесплодие обусловлено изменениями матки, нарушением гормонального баланса.Лечение эндометриоза
Тактика лечения (консервативная или хирургическая) определяется степенью тяжести эндометриоза и эффективностью терапии. Консервативная терапия включает использование одного из гормональных препаратов с учетом индивидуальной переносимости, иммуномодуляторов, витамина Е, противовоспалительных средств. Для лечения используют оральные контрацептивы: ановлар, овидон, Ригевидон, нон-овлон. Курс лечения этими препаратами длится 6 - 9 месяцев.Если эндометриоз вызывает бесплодие, то используют оральные гестагенные препараты (норэтистерон, левоноргестрел, микролют). Антиэстрогенные препараты: тамоксифен. Мужские половые гормоны: сустанон 250, тестэнат, андриол.В комплексном лечении используют радоновые ванны, постоянное магнитное поле на участок матки.При проведении хирургического лечения эндометриоза придерживаются трех основных принципов:
- Репродуктивная функция женщины должна быть сохранена.
- Хирургическая травма должна быть минимальной.
- Максимально возможное удаление эндометриоидных участков.
Объем хирургического вмешательства зависит от степени распространенности патологического процесса.
alloncology.com
Онкологические аспекты. Эндометриоз
04 Мая в 12:32 2201
Несмотря на то, что эндометриоз относится к числу довольно частых заболеваний, вопрос о его потенциях к малигнизации остается малоизученным. Последовательность событий при малигнизации эндометриоза ясно выступает лишь в ранней стадии рака, когда удается проследить весь ряд процессов: эндометриоз — инвазивный эндометриоидный рак. При дальнейшем росте опухоль может полностью занять тот участок, на котором она возникла, и «поглотить» ткани, которые ей предшествовали. Другая возможность заключается в полной трансформации эндометриоза в опухоль. Следовательно, истинная частота малигнизации эндометриоза, по всей видимости, значительно превосходит регистрируемую в литературе, которая касается лишь случаев начального рака. Многие вопросы, касающиеся биологической сущности патогенеза эндометриоза, возможностей его малигнизации и дифференциальной диагностики, представляются сложными. Это побудило нас с В. П. Баскаковым и А. Е. Колосовым последовательно рассмотреть эти вопросы, основываясь па 432 клинико-морфологических наблюдениях эндометриоза и 164 — РТМ, РЯ и прямой кишки. Информация о частоте развития рака в эндометриоидных кистах весьма разноречива и варьирует от 2,3 до 2,9%. Применение методов электронной микроскопии позволяет уверенно дифференцировать эндометриоидную цистаденокарциному от серозной и псевдомуцинозной. При этом отмечается значительное морфологическое сходство эндометриоидного и эндометриального рака, вплоть до образования псевдоплоскоклеточных островков. Из 228 наблюдений эндометриоза и эндометриоидных кист яичников в 26 (11,4%) выявлены убедительные картины малигнизации. Чаще озлокачествлялся железисто-кистозный вариант эндометриоза. Кроме того, в 17 наблюдениях, первоначально трактовавшихся как серозная цистаденокарцинома яичников, углубленное морфологическое исследование помогло уточнить гистогенез этих новообразований и интерпретировать их как злокачественные эндометриоидные опухоли. При синхронном раке личинкой и эндометрия клинико-морфологический анализ позволяет констатировать три основные ситуации: 1) рак эндометрия с метастазом в яичник; 2) рак яичника с метастазом в тело матки; 3) первично множественные опухоли яичников и эндометрия. Идентификация последней группы, помимо учета клинических данных и топографии процесса, требует гистогенетического анализа для исключения разного рода метастатических комбинаций. Мы наблюдали 10 больных с синхронно возникшими (вернее, одновременно выявленными), близкими в гистогенетическом отношении сочетаниями эндометриоидной цистаденокарциномы яичников и аденокарциномы эндометрия. У большинства из них отмечен комплекс эндокринно-обменных нарушений, свойственных I патогенетическому варианту РЭ. Прогноз при таких сочетаниях существенно отягощен из-за частой комбинации имплантационного и лимфогенного метастазирования. В связи с этим должна применяться более интенсивная терапия (операция, дистанционное облучение, прогестинотерапия, химиотерапия). Я.В. Бохман-
Гормонозависимые опухоли
И.В. Бохман (1972) отметил, что частота первично множественных опухолей среди 340 больных РЭ составила 12%. В описанных 42 таких наблюдениях преобладали опухоли яичников, молочной железы и толстой кишки. Приводятся детальные описания синхронного и метахронного развития трех, четырех и се...
Онкогинекология -
Механизмы противоопухолевого иммунитета
Иммунная система организма представляет собой совокупность всех лимфоидных органов и клеток, среди которых выделяют четыре основных типа иммунокомпетентных клеток: Т- и В-лимфоциты, NK-клетки (естественные киллеры) и макрофаги. В процессе дифференцировки полипотентные стволовые клетки в кост...
Онкогинекология -
Аспирация кист
Как изолированный способ лечения в настоящее время практически не применяется. Однако возможно при наличии больших (более 10 см) образований яичника. Аспирация поводится пункционной иглой, введенной через дополнительный троакар.
Онкогинекология
medbe.ru