Скрининг молочной железы
Скрининг рака молочной железы
новке, не рвутся бытовые и родственные связи, психотерапевтическую ценность которых трудно переоценить. Сотрудники отделения оказывают квалифицированную паллиативную помощь инкурабельным больным на дому или в стационаре, проводят паллиативные хирургические вмешательства.
Важным разделом деятельности отделения является проведение комплекса мероприятий по реабилитации пролеченных онкобольных — ликвидация последствий агрессивного противоракового лечения. В условиях длительного соматического и психологического дискомфорта и связанного с этим изменения социальной активности, личность больного является наиболее уязвимым звеном в реабилитационном процессе. Поэтому, сотрудники отделения считают своей важной задачей оказание психологической поддержки больным и их родственникам. Совместно с отделением маммологии проводится большая работа по реабилитации больных, перенесших радикальную мастэктомию.
Больные выписываются из стационара на 4-5 день после операции, на дому им проводится антибактериальная терапия, перевязки. При этом экономические затраты на лечение по методу «стационар на дому» в 2 раза ниже. Больные предпочитают получать антибактериальную терапию, перевязки в домашних условиях, а не в больнице.
Мы считаем, что в домашних условиях вполне можно проводить и лечебные курсы химиотерапии, особенно повторные. Данная методика позволила нам:
— увеличить оборот койки в стационаре;
— увеличить оперативную активность ;
— появилась возможность более ранней госпитализации;
— уменьшить в 2 раза денежные затраты при долечивании на дому;
— улучшить психологическое состояние больных, долечивавшихся на дому.
Научные исследования сотрудников кафедры онкологии и хирургии КГМА и КОД МЗ РТ были положены в основу более 10 докторских и около 30 кандидатских диссертаций, нескольких монографий, практических руководств для врачей. Сотрудники кафедры и диспансера получили около 20 патентов на устройства, аппаратуру, методы лечения.
Признанием заслуг Казанской школы онкологов явилось проведение в 2000 году 5-го Съезда онкологов России, на котором достижения наших онкологов получили очень высокую оценку.
Нами проводятся ежегодно Российские и Республиканские научные конференции, посвященные различным разделам онкологии, а конференции, посвященные организационным вопросам онкологии, стали традиционными.
Для координации деятельности онкологических учреждений Приволжского федерального округа была создана Ассоциация онкологических учреждений округа, а центром ее была избрана Казань — это высокая оценка заслуг онкологической школы нашей Республики.
Скрининг рака молочной железы
Г. П. КОРЖЕНКОВА, Российский Онкологический научный центр им. Н. Н. Блохина РАМН, г. Москва
Среди разнообразных заболеваний молочной железы у женщин РМЖ представляет важнейшую проблему из-за высокой заболеваемости и смертности от него. Ежегодно в мире выявляют около 1 млн. случаев рака молочной железы. Прогнозируется рост числа заболеваний к 2010 году до 1,45 млн. Предполагают, что на протяжении жизни одна из 8 женщин в США заболеет раком молочной железы, и одна из 30 заболевших РМЖ умрет. Вероятность заболеть РМЖ в России в предстоящей жизни для новорожденной девочки составляет 3,5%, а умереть от него 1,8%. В 1999 году число заболевших в России РМЖ составило 44,5 тысяч человек. За период с 1980 по 1999 год заболеваемость в России увеличилась на 70%, с 22,6 до 38,3 на 100000 женского населения. Максимальный показатель заболеваемости зарегистрирован в Санкт-Петербурге — 53,3 на 100000 населения.
Вероятность заболеть РМЖ увеличивается с возрастом. В зависимости от возраста вероятность развития рака молочных желез в течение десяти лет — 1 к 72 для женщин 40-49 лет, и 1 к 36 для женщин в 50-64 года, и 1 к 29 для женщин старше 70 лет.
Рак молочной железы является наиболее частой причиной смерти женщин по сравнению с другими формами злокачественных новообразований. В странах Западной Европы и Северной Америки он является главной причиной смерти женщин 35-54 лет (достигает 20%), а после 50 лет второй причиной смерти после сердечно-сосудистых заболеваний.
В РФ смертность от РМЖ продолжает увеличиваться в абсолютных и стандартизованных показателях, составляя 1/2 от заболеваемости, в то время как в большинстве стран ЕЭС и Северной Америки имеется тенденция к снижению смертности от РМЖ, где она составляет уже 1/3 от показателя заболеваемости.
К сожалению, реальных способов предотвратить возникновение рака молочной железы нет — болезнь мультифакторного происхождения.
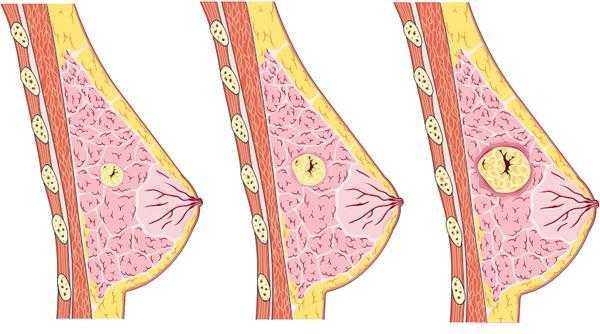
Однако, если он распознан в доклиническом периоде при размерах опухоли до 1 см3, когда вероятность метастазов мала, то можно вылечить большинство больных (хотя у 10-15% больных в этой стадии в последующем будут выявлены метастазы). Поэтому следует ориентировать практических врачей на выявление опухолей размером 1 см3 и менее.
Теоретические предпосылки возможностей ранней диагностики. Согласно известной модели, период «естественной истории роста» РМЖ (Schwartz J., 1961) — это время от появления гипотетической «первой» раковой клетки до смерти больной. Опухоль достигает размеров 1 см3 через 30 удвоений, т. е. за период от 2 до 18 лет в зависимости от времени удвоения (ВУ) опухоли. Темпы роста и метастазирования опухоли определяют «естественную историю» заболевания.
РМЖ является гетерогенным заболеванием, что клинически выражается в высокоагрессивном или относительно доброкачественном течении болезни. Стремительно и быстрорастущие раки с коротким ВУ, как правило, редко обнаруживаются на маммограммах, выполняемых при скрининге с интервалом 1-2 года, и их называют «интервальными». Эти опухоли в основном рано метастазируют. Такие формы РМЖ клинически бывают «ранними», а биологически — «поздними».
Опухоли с большим ВУ, медленно растущие (высокодифференцированные, диплоидные) преимущественно выявляются при маммографическом скрининге. Наша задача — прервать «естественную историю» развития опухоли, и чем раньше, тем больше шансов на успех.
Не создано метода, который обеспечил бы 100% правильную диагностику рака молочной железы — важна комбинация методов.
Массовые обследования населения с целью раннего выявления заболевания относятся к скрининговым исследованиям. Эффективность последних определяется снижением показателей смертности.
В 1963-1994 гг. в разных странах проведено 8 рандомизированных исследований скрининга РМЖ. Результаты исследований раскрывают значение маммографии, клинического обследования (CBE — Clinical Breast Examination) и самообследования (BSE — Breast Self-Examination) молочных желез на частоту смертности от рака молочной железы [3-11].
BSE легок, быстр, недорог, привлекателен. Что давало повод считать его ведущей методикой Скрининга. Однако, несмотря на многочисленные публикации о значении самообследования молочных желез, точность его неизвестна. Чувствительность методики около 26%, что значительно меньше по сравнению с клиническим осмотром и маммографией. Отмечено уменьшение чувствительности с 41% у женщин в возрасте 35-39 лет до 21% среди больных в возрасте 60-74 лет. Обучение самообследованию увеличивает посещаемость врача.
Были проанализированы результаты самообследования в Санкт-Петербурге (1985) 120310 женщин в возрасте 40-64 лет [2]. Обучающую группу составили 60221, контрольную группу 60098 женщин. Обучение BSE производили в маленьких группах по 5-20 женщин медсестрами и врачами.
После 5 лет было диагностировано 493 случая рака молочной железы в группе BSE, и 446 — в контрольной группе, с 157 смертными случаями в группе BSE и 164 — в контрольной группе.
К настоящему времени ни одно исследование не показало уменьшение смертности от рака молочной железы в группе само-обследования.
Клиническое обследование молочной железы (CBE)
По данным различных авторов, чувствительность клинического осмотра молочной железы составляет 40-69%, специфичность 88-95%.
В двух наиболее корректных рандомизированных Канадских исследованиях в 1980-1988 гг. клиническое обследование молочной железы сравнивали с параллельно проводимой маммографией (табл. 1) [10,11].
Таблица 1.
Результаты канадских исследований
Таблица 2.
Сравнительная методика маммографического скрининга
Исследование возраст женщин Число выявленного РМЖ Метод обнаружения
Маммография CBE Маммография + CBE
CNBSS-1 40-49 лет 255 40% 24% 36%
CNBSS-2 50-59 лет 325 53% 12% 35%
Возраст Рекомендации Преимущества
40-49 лет Маммография каждые 2 года с клиническим осмотром молочной железы или без него Может снизить риск смерти от рака молочной железы на 17%
50-74 лет Маммография каждые 1-2 года с клиническим осмотром молочной железы или без него Может снизить риск смерти от рака молочной железы на 30%
Исходя из выше изложенного, сегодня ведущим методом ранней диагностики РМЖ следует считать маммографию.
С введением маммографического скрининга значительно увеличилось число выявленного внутрипротокового рака молочной железы in situ — ductal carcinoma in situ (DCIS). При этой форме РМЖ злокачественные эпителиальные клетки распространяются в млечных протоках без прорастания базальной мембраны (инвазивного роста). В 1974 г. на 100 тысяч женщин старше 50 лет было 8 внутрипротоковых раков in situ, а в 1994 г.
— уже 60 случаев. Возможно, столь значительное увеличение связано с морфологической гипердиагностикой, когда атипичную внутрипротоковую гиперплазию диагностировали как рак in situ.
Каждая женщина в возрасте 40 лет и старше должна пройти базисную маммографию, а в дальнейшем проходить периодические проверочные маммографические обследования в зависимости от возраста (табл. 2).
Непальпируемый РМЖ соответствует 25-30 циклам клеточного удвоения. При размерах 0,5-1,0 см его очень трудно обнаружить клинически, что особенно важно, поскольку в этом случае прогноз наиболее благоприятен.
Рентгенологическая картина клинически неопределяемого РМЖ имеет особенности, обусловленные малыми размерами опухоли, отсутствует грубая тяжистость по краям узла, структура окружающих тканей не перестроена, гиперваскуляризация отсутствует. Наиболее важными признаками доклинической формы РМЖ является лучистость контуров и наличие микро-кальцинатов.
В ряде случаев на рентгенограммах непальпируемый рак имеет вид участка локализованной перестройки структуры молочной железы. Этот вариант наиболее сложен для дифференциальной диагностики и рак нередко распознают лишь при динамическом наблюдении или при операции с предоперационной внутритканевой маркировкой непальпируемого образования.
Нередко единственным рентгенологическим признаком, позволяющим заподозрить рак молочной железы, являются микрокальцинаты. По мнению большинства исследователей, микрообызвествления особенно часто встречаются при злокачественных опухолях. Морфологическим субстратом микрокаль-цинатов считается отложение извести в некротических участках опухоли. Форма, размер, количество и характер распределения микрокальцинатов отличается разнообразием.
Особенно большое значение имеет выявление микрокальци-натов при развитии рака на фоне мастопатии, когда опухолевый узел маскируется обширными участками железисто-фиброзной гиперплазии и кистами. Обнаружение микрокальцинатов даже при отсутствии опухолевого узла весьма подозрительно на рак молочной железы. Однако обызвествления встречаются и при доброкачественных процессах — склерозирующем аденозе, плаз-моцитарном мастите, фиброаденоме. Характер обызвествлений при последних процессах иной. При фиброаденоме, например, кальцинаты немногочисленны, более крупные, бесформенные, глыбчатые, расположены по периферии опухоли.
Микрокальцинаты в молочной железе следует считать признаком подозрительным на рак, но не патогномоничным для него.
Полезен двойной просмотр маммограмм. S. A. Mulligan и со-авт. (1996) показали, что чувствительность маммографической диагностики рака при двойном чтении увеличивается с 87,3 до 92,7% [8].
Лечение больных РМЖ III стадии обходится в 15-30 раз дороже, чем при I стадии. В то же время на диагностику тратится только 5% средств, а 95% — на лечение. Ранняя диагностика РМЖ позволяет снизить затраты на лечение больных за счет следующих факторов:
— уменьшение объема операции от мастэктомии до секторальной резекции сокращает сроки госпитализации;
— при органосохраняющем лечении не происходит инвалиди-зации больных, сокращается время нетрудоспособности;
— нет необходимости в реконструктивных операциях, протезировании;
— при отсутствии поражения лимфоузлов лечение может быть радикальным без применения дорогостоящих химиотерапевтических препаратов (при размере опухоли до 1 см в диаметре [Tj -T1b
N0, McJ). a '
Чувствительность маммографии составляет 77-95%, специфичность 94-97%. Эти показатели снижаются при обследовании женщин с более плотными молочными железами (в молодом воз-
расте, при гормонозаместительной терапия), при низком качестве маммографии и при недостаточной квалификации рентгенолога.
Положительная прогнозирующая ценность скрининговых маммографий, требующих дальнейшего обследования (диагностическая маммография, УЗИ) составляет от 2% до 22%; а диагностических маммографий, требующих биопсии, — от 12% до 78%.
На сегодня ясно, что раннее обнаружение РМЖ маммографией с клиническим обследованием или без него, уменьшает смертность у женщин 50-69 лет до одной трети (30%) [9].
Однако картина остается неясной для женщин 40-49 лет. Во всем мире эксперты продолжают исследовать роль маммографии в этой возрастной группе [6, 7, 8].
При этом не выявлено никакого различия в показателях смертности от рака молочной железы в течение семилетнего наблюдения за женщинами скрининговой и контрольной групп. Более длительные сроки наблюдения выявили снижение смертности в группе 40-49 лет, что, возможно, связано с удвоением вероятности заболевания РМЖ у женщин в этом возрасте.
Некоторые исследователи использовали интервал скрининга в 2 года, который был слишком длительным, чтобы обнаружить быстрорастущий РМЖ. Это сказалось на снижении смертнос-ти. Использованы математические модели с целью выявить, сколько женщин могли бы продлить себе жизнь, начиная обследоваться с 40 лет. Эти модели предполагают, что маммография уменьшает смертность на 30%, что соответствует продлению жизни двум женщинам из 1000.
Потенциальные выгоды от маммографии для женщин 40-49 лет включают более раннюю диагностику и органосохраняющее лечение.
Наиболее часто обсуждаемые неблагоприятные эффекты маммографии — беспокойство, дискомфорт, дополнительные диагностические процедуры, наличие ложноотрицательных и ложноположительных результатов. Последние требуют дополнительных затрат: маммографических снимков или УЗИ, различные виды биопсий.
Elmore J. G., Barton M. В. (1998 год) выявили, что на каждые 100$, потраченные на скрининг, 33$ дополнительно тратятся на оценку ложноположительного результата [3]. После каждой из 8 биопсий, выполненных у женщин 40-49 лет, диагностируют 1 инвазивный РМЖ и 1 рак in situ (табл. 3).
Таблица 3.
Дополнительные диагностические процедуры
Возраст Число женщин Число маммографий (снимков) Количество биопсий Число выявленного РМЖ
40-49 лет 640 1280 150 30
50-59 лет 680 1360 188 60
Следующий неблагоприятный эффект связан с ложноотрицательным результатом. Чувствительность маммографии составляет 73-95% и зависит от возраста женщины, плотности молочной железы, качества маммологического исследования и его интерпретации. Чувствительность клинического осмотра еще ниже. Таким образом, значительное количество женщин как при маммографии, так и при клиническом обследовании, получает ложноотрицательные ответы, что приводит к задержке диагностики и в результате — более позднее лечение. Некоторые из женщин отказываются от дальнейших обследований и наблюдения. До 25% случаев инвазивных РМЖ не выявляют маммографией в 40-49 лет, по сравнению с 10% — в 50-59 лет. В этой возрастной группе необходимо подключать дополнительные методы, возможно, самообследование и УЗИ.
Не менее важной проблемой маммографического скрининга остается лучевое воздействие при проведении маммографии и возможность появления индуцированного РМЖ.
Что касается лучевых нагрузок, то современная техника обеспечивает защиту женщины при съемке применением тубусов-компрессоров, эффективно усиливающих экранов и высокочувствительной радиографической пленки. В результате средняя поглощенная доза при одной маммографии снижает-
ся. Все соображения об отношении «польза/риск» базируются, с одной стороны, на признании гипотетической возможности развития рака молочной железы под действием излучения, а с другой — на экспериментальных моделях канцерогенеза.
У жительниц Японии в возрасте 30 лет и более, облученных в результате бомбардировки в дозе ниже 99 рад, повышения частоты рака молочной железы не установлено. Среди 16 тысяч женщин, подвергнутых маммографическим обследованиям по проекту HIP (при дозах в 40 раз больше, чем при современной маммографии), в течение более 20 лет не наблюдалось увеличения частоты возникновения рака этого органа [1].
В 1997 году S. A. Fieg и R. E. Hendrick оценили, что ежегодная маммография 100 тысяч сорокалетних женщин в течение 10 лет может вызвать не более 8 смертных случаев от гипотетического радиогенного рака, что весьма незначительно по сравнению с эффективностью скрининга.
Существует мнение, что в субпопуляции женщин с наследственной восприимчивостью к лучевому воздействию, возможен более высокий риск радиогенного рака, но доказательных исследований этого нет.
На сегодняшний день остаются дискуссионными следующие вопросы:
— Какой оптимальный интервал при скрининге для женщин различных возрастов?
— Зависит ли сокращение смертности от возраста, с которого начинается маммографический скрининг?
— Есть ли различие в результатах скрининга в зависимости от расовой и этнической принадлежности?
— Есть ли зависимость между известными факторами риска рака молочной железы и эффективностью маммографии?
— Влияет ли гормонозаместительная терапия на чувствительность маммографии?
— Влияет ли маммографический скрининг на увеличение риска РМЖ у женщин с повышенной восприимчивостью к радиации?
— Как снизить частоту ложноположительных результатов исследования и уменьшить число дополнительных диагностических процедур?
До настоящего времени в России отсутствует стройная система профилактического обследования женщин с целью раннего выявления РМЖ и его адекватного лечения. Без современной аппаратуры невозможно осуществление ранней диагностики РМЖ. В настоящее время в 80% случаев РМЖ выявляется больной самостоятельно, в 10% — при врачебном осмотре и только в 10% — при маммографии.
Начиная с 1990 года, в России показатели качества онкологической помощи больным раком молочной железы, включая выявление ранних стадий, практически не менялись. Выявляемость заболевания в целом по стране остается низкой, не превышая 18%, а показатель запущенности (III и IV стадии болезни), который является ведущим критерием качества диагностики, напротив, высоким — около 40%. Отсюда высокие показатели смертности от РМЖ: летальность на первом году с момента установления диагноза равна почти 13%.
Проведенный анализ технической оснащенности регионов РФ показал, что необходимо переоснащать парк маммографов в стране. В РФ имеется 1294 маммографа (3,7 на 1 млн. населения), из них 741 подлежит замене. Необходимы 12 маммографов на 1 млн. населения, т.е. еще 1175 аппаратов. 70% регионов имеют слабую оснащенность, а такие регионы, как Камчатка, Чукотка, Курган, Белгород и др., вообще не имеют современных маммографов. О каком вообще маммографическом скрининге может идти речь в масштабах страны? Можно только сегментировать страну на регионы и там проводить скрининг.
Создание выездных комплексных маммологических групп является одной из форм реализации ранней диагностики РМЖ в условиях РФ путем приближения специализированной онко-маммологической помощи женскому населению районов, удаленных от профильных медицинских учреждений.
Для эффективного решения проблемы ранней диагностики РМЖ необходим новый подход к подготовке кадров, способных овладеть сложнейшей диагностической техникой.
В стране плохо поставлена санитарно-просветительская работа. Большинство женщин с проблемами молочной железы просто не знают куда идти, к кому обращаться, да и к тому же боятся онкологических учреждений, калечащих операций. Одной из важнейших функций маммологических и онкологических учреждений должно стать усиление санитарно-просветительской работы среди населения и медицинской общественности, убеждающей в целесообразности регулярного обследования молочных желез.
Немаловажная задача медицины — дискредитировать в глазах общественности агрессивных малограмотных «народных целителей».
Эффективную пропаганду медицинских знаний нужно считать одной из организационных форм ранней диагностики для снижения смертности от РМЖ. Естественно, ключевым моментом в реализации программы ранней диагностики РМЖ является адекватное финансирование, которое должно реализовываться за счет:
— регионального и федерального бюджетов;
— территориального и федерального фондов ОМС;
— средств добровольного медицинского страхования;
— совместных протоколов скрининга международных медицинских ассоциаций;
— средств отечественных и зарубежных инвесторов;
— благотворительных фондов
ЛИТЕРАТУРА
1. Линденбратен Л. Д., Бурдина Л. фия. — Учебный атлас. — 1998.
М., Пинхосевич Е. Г. Маммогра-
2. Семиглазов В. Ф., Моисеенко В. М. и др. Программа Россия (Санкт-Петербург) / ВОЗ по оценке эффективности самообследования молочной железы. — Материалы I съезда онкологов СНГ. — 1996, ч. 2. — С. 41.
3. Elmore J. G., Barton M. B., Moceri V. M., Polk S., Arena P. J., Fletcher S. W. Ten-year risk of false positive screening mammograms and clinical breast examinations. N Engl J Med. — 1998; 338(16): 1089-1096.
4. Fieg S. A. et al. Hypothetical breast cancer risk from mammography. Recent Results Cancer Res. — 1984; 90: 1-10
5. Frisell J., Lidbrink E. The Stockholm Mammographic Screening Trial: Risks and benefits in age group 40-49 years. J Natl Cancer Inst Monogr. — 1997; 22:49-51.
6. Miller A. B, To T., Baines C. J., Wall C. The Canadian National Breast Cancer Screening Study-2: 13-year results of a randomized trial in women aged 50-59 years. J Natl Cancer Inst. — 2000; 92(18): 1490-1499.
7. Miller A. B., To T., Baines C. J., Wall C. The Canadian National Breast Screening Study: update on breast cancer mortality. J Natl Cancer Inst Mono-gr. — 1997; 22:37.
8. Ringash J., Canadian Task Force on Preventive Health Care. Preventive health care, 2001 update: screening mammography among women aged 4049 years at average risk of breast cancer. Can Med Assoc J. — 2001; 164(4): 469-476.
9.Rajkumar S. V., Hartmann L. C. Screening mammography in women aged 40-49 years. Medicine. — 1999; 78(6): 410-416.
10. Shapiro S. Periodic screening for breast cancer: the HIP Randomized Controlled Trial. Health Insurance Plan. J Natl Cancer Inst Monogr. — 1997; 22: 27-30.
11. Tabar L., Chen H. H., Fagerberg G., Duffy S. W., Smith T. C. Recent results from the Swedish Two-County Trial: the effects of age, histologic type, and mode of detection on the efficacy of breast cancer screening. J Natl Cancer Inst Monogr. — 1997; 22: 43-47.
Онко-экологический скрининг в Саратове
О. М. КОНОПАЦКОВА, Ю. Я. ДМИТРИЕВ. Медицинский университет, Саратов
Злокачественные новообразования представляют серьезную проблему не только для онкологов, но и для врачей других специальностей. По имеющимся данным, рост числа заболевших злокачественными новообразованиями с учетом демографической ситуации в России является истинным, так как наблюдается на фоне убыли населения. Как показывают исследования, повышение выявляемости лиц со злокачественными опухолями зависит не только от совершенствования учета, но и от расширения диагностических методик и улучшения онкологической грамотности врачей первого контакта.
В настоящее время при анализе факторов, способствующих развитию злокачественных новообразований, нельзя не учитывать их комплексного воздействия. Хотя загрязнение окружающей среды не является определяющим фактором, но оно играет существенную роль в качестве коканцерогена или модифицирующего компонента. Многочисленными исследованиями во многих странах мира доказано, что низкое качество природной среды отрицательно действует на защитные силы организма и способствует росту заболеваемости.
На сегодняшний день считается, что наиболее распространенные формы рака, имея полиэтиологическую природу, возникают как результат комбинации вредных факторов окружающей среды и социобиологических особенностей организма.
Онкологам хорошо известно, что выявление этиологических факторов рака является существенной предпосылкой для его профилактики. Для организации первичной профилактики рака необходимо создание территориальных программ, в которых учитываются заболевания, занимающие ведущие места в регионе.
В России основными локализациями рака являются бронхи, легкое, желудок, кожа, молочная железа. Согласно статистическим данным Саратовского областного онкологического диспансера, за 10 лет (с 1996 г.) стандартизованные показатели общей онкологической заболеваемости в области несколько снизились (с 359,0 до 325,0). Максимальное число онкологических больных наблюдается в Саратове.
В 2006 г. общая онкологическая заболеваемость составила 355 на сто тысяч жителей. Ведущими нозологическими единицами, как у женщин, так и у мужчин, являются злокачественные новообразования кожи (61,1%с), легкого (32,9%с), желудка (22,8%с), молочной железы (77,6% на 100000 женского населения).
Основная часть городского населения имеет контакт с канцерогенными веществами, как в процессе профессиональной деятельности, так и в повседневной жизни, при этом, на организм одновременно воздействуют несколько факторов.
cyberleninka.ru
Скрининг рака молочной железы
Рак молочной железы прочно удерживает первое место по частоте встречаемости среди всех онкологических заболеваний у женщин. Согласно статистике Всемирной организации здравоохранения на нашей планете ежегодно регистрируется около 1 млн. новых случаев злокачественных опухолей груди. Такая обширная распространенность, а также высокая опасность патологии для жизни пациентки является причиной того, что на борьбу с раком груди направлены существенные усилия медиков. Во многих развитых странах созданы и запущены государственные программы, которые направлены на раннее выявление и лечение рака груди. Наиболее успешной среди таких программ оказалась скрининговая диагностика рака молочной железы, охватывающая максимально большую часть женского населения.
Показания для прохождения скринингового обследования
Женщинам, не входящим в группу риска (т.е. не имеющие генетической или наследственной предрасположенности к развитию опухолей груди) в возрасте 40-50 лет рекомендуется консультация маммолога с осмотром и пальпацией раз в год, а прохождение маммографии - один раз в год или в два года (в зависимости от плотности молочных желез). УЗИ в этом случае назначается, если врач видит в этом необходимость.
Женщинам из группы повышенного риска развития рака груди (т.е., с наследственной предрасположенностью или с мутациями BRCA1 или BRCA2) показано прохождение маммографии и МРТ поочередно один раз в 6 месяцев. К этой группе также относятся женщины с установленной атипичной протоковой гиперплазией (ADH), протоковой карциномой грудной железы in situ (DCIS) или женщины, совершившие более 10 попыток ЭКО.
Если УЗИ, мамограмма или пальпация указывают на наличие уплотнения в молочной железе (узел или массу), проводится полная визуализация органа, после чего назначается пункционная биопсия под контролем УЗИ. Если такая процедура не позволяет получить нужный материал для постановки диагноза, то после биопсии молочной железы делается дополнительная пункционная биопсия под контролем стереотоксической маммографии или МРТ. В результате врачи получают фрагменты тканей, а не отдельные клетки (как в случае с тонкоигольной биопсией). Анализ биоптата позволяет установить точный диагноз, а значит, подобрать максимально эффективное лечение и составить прогноз течения заболевания.
Успешность любых лечебных мероприятий при раке молочной железы напрямую зависит от того, насколько быстро была выявлена данная патология. Но зачастую женщины обращаются к специалистам уже на поздних стадиях ее развития, когда опухолевый очаг имеет большие размеры и начинает давать метастазы. Обусловлено это тем, что злокачественные опухоли груди во многих случаях не имеют выраженных и специфических симптомов в начальном этапе своего образования. А ведь именно в это время пациентка имеет максимальные шансы на быстрое, относительно несложное и успешное излечение.
Скрининг позволяет определить наличие у женщины подозрительного уплотнения в толще ткани железы практически сразу после того, как оно появилось. После этого пациентка немедленно направляется на более глубокие профессиональные обследования, которые однозначно дают ответ на вопрос о природе такого новообразования. И если она оказывается злокачественной, то лечение рака груди в Израиле начинается сразу же, без ожидания манифестации клинической симптоматики.Это наиболее простой, но весьма эффективный метод. Разумеется, женщина самостоятельно не может поставить диагноз по тем изменениям, которые происходят с ее молочной железой. Но, зафиксировав их, она должна встревожиться и немедленно обратиться к врачу. В большинстве случаев причиной обращения в итоге оказывается не злокачественная опухоль, но если все-таки у пациентки диагностируют рак груди, то такая онкологическая настороженность способна спасти ей жизнь.
Самостоятельное обследование молочных желез необходимо проводить каждой женщине старше 30-35 лет не реже, чем 1 раз в месяц. Процедура эта довольно проста и занимает всего 5-10 минут. Она включает осмотр груди на предмет изменений ее формы и размеров, а также тщательное прощупывание ее внутренней структуры для выявления нехарактерных уплотнений. О технике такого самообследования вы можете прочесть на нашем сайте или обратиться за консультацией к врачам Onco Breast Unit – они расскажут вам обо всех его подробностях.
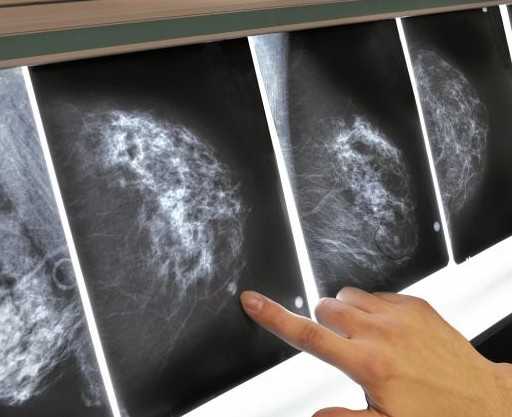
- Рентгеновская маммография
Данное обследование принято в качестве скринингового метода во многих странах мира. Оно проводится при помощи аппарата-маммографа и включает выполнение нескольких рентгеновских снимков молочной железы. Выбор этого способа обусловлен тем, что маммография проводится очень быстро и является весьма недорогой по сравнению с другими методиками. Но при этом обеспечивает достаточную точность результатов и позволяет уверенно выявлять новообразования в ткани груди, требующие дальнейшего, более пристального изучения.
Клиника лечения рака молочной железы Onco Breast Unit рекомендует каждой женщине в возрасте более 35 лет проходить профилактическую маммографию как минимум 1 раз в 2 года, а по достижении 45-летнего возраста увеличить количество таких обследований до ежегодного.
- УЗИ молочных желез и подмышек
Ультразвуковое обследование – это еще один из способов проведения скрининговых обследований населения для выявления злокачественных опухолей молочной железы. В плане периодичности прохождения, быстроты и легкости проведения, а также по точности получаемых результатов он почти ничем не отличается от рентгеновской маммографии. Можно отметить только, что УЗИ является несколько более дорогостоящей методикой, но при этом не оказывает лучевой нагрузки на организм пациентки. Кроме того, такие проверки позволяют выявить опухоли малых размеров, которые в большинстве случаев лучше реагируют на лечение.
onco-breast-unit.ru
Скрининг в целях выявления рака молочной железы
Изучение вопроса своевременной диагностики злокачественных новообразований показало настоятельную необходимость разработки программ скрининга. Вторичная профилактика рака, или скрининг, включает проведение обследований и тестов с целью более раннего выявления данного заболевания, т.е. до появления симптомов и признаков, по поводу которых больные сами обратились за медицинской помощью. Ценность раннего выявления заболевания заключается в том, что представляется возможным обнаружить рак на стадии, когда он носит локальный характер и может быть излечен.
В теории,
массовый скрининг в целях выявления РМЖ главным образом должен вовлекать здоровых женщин без каких-либо признаков заболевания или симптомов. Скрининг способствует не только выявлению скрытых форм рака, поддающихся лечению, но и обладает психологической ценностью для женщин. В результате скрининга женщины убеждаются, что у них нет рака молочной железы, а это и является наиболее важным потенциальным успехом такого рода программ. При рассмотрении любой скрининговой программы тщательному обсуждению подлежат три положения: снижение смертности, возможные неблагоприятные последствия и вопросы стоимости. Маммографический скрининг РМЖ наиболее пристальное внимание уделяет снижению смертности от рака. Впервые маммограмма молочной железы была получена доктором Salomon в 1913 г., а клиническая маммография была описана доктором Warren в 1929 г. До середины 50-х годов не было сделано сколько-нибудь серьезных попыток провести скрининг по поводу РМЖ среди здоровых женщин, так как не существовало концепции массового рентгенологического скрининга здоровых женщин с целью обнаружения ранних форм РМЖ. Впервые такая концепция была предложена в 1956 г. доктором Cohen и соавт., а в 1958 г. были опубликованы предварительные результаты исследования, полученных благодаря участию 2 тыс. женщин-добровольцев. Маммография в настоящее время считется надежным методом в обнаружении РМЖ до момента, когда опухоль становится пальпируемой. Только 8% составляют те опухоли, которые пальпируются до того, как становятся видимыми на маммограммах . История скрининга. Скрининговые программыПервым рандомизированным контролируемым исследованием по изучению эффективности маммографии принято считать проект HIP (Health Insurance Plan), организованный в 1963 г. в Большом Нью-Йорке. Одной из основных задач проекта было изучение влияния маммографии на снижение смертности от РМЖ. Были включены в исследование 64 тыс. женщин от 40 до 64 лет. Посредством рандомизации 31 тыс. женщин вошла в контрольную группу, столько же женщин составили группу скрининга. Схема скрининга включала клинический осмотр молочных желез и с интервалом в 1 год – четыре 2-проекционных маммографических исследования. Женщинам в группе контроля предлагалось придерживаться обычной практики получения медицинской помощи. К концу 5-го года с момента вступления в скрининговую программу число выявленных случаев рака молочной железы было практически одинаковым в обеих группах: 307 гистологически подтвержденных случаев РМЖ в группе скрининга и 301 случай в группе контроля. К концу 7-го года прослеживания был выявлен 431 случай РМЖ в группе исследования и 448 – в группе контроля. Из 307 выявленных случаев РМЖ в группе скрининга в течение 5 лет умерло 39 женщин, а в группе контроля из 301 случая РМЖ – 63 женщины. Таким образом, разница была 38,1%. Через 10 лет прослеживания снижение смертности составило 29,3%, а к концу 18-го года развития программы – приблизительно 25%.
При рассмотрении любой скрининговой программы тщательному обсуждению подлежат три положения: снижение смертности, возможные неблагоприятные последствия и вопросы стоимости. Маммографический скрининг РМЖ наиболее пристальное внимание уделяет снижению смертности от рака. Впервые маммограмма молочной железы была получена доктором Salomon в 1913 г., а клиническая маммография была описана доктором Warren в 1929 г. До середины 50-х годов не было сделано сколько-нибудь серьезных попыток провести скрининг по поводу РМЖ среди здоровых женщин, так как не существовало концепции массового рентгенологического скрининга здоровых женщин с целью обнаружения ранних форм РМЖ. Впервые такая концепция была предложена в 1956 г. доктором Cohen и соавт., а в 1958 г. были опубликованы предварительные результаты исследования, полученных благодаря участию 2 тыс. женщин-добровольцев. Маммография в настоящее время считется надежным методом в обнаружении РМЖ до момента, когда опухоль становится пальпируемой. Только 8% составляют те опухоли, которые пальпируются до того, как становятся видимыми на маммограммах . История скрининга. Скрининговые программыПервым рандомизированным контролируемым исследованием по изучению эффективности маммографии принято считать проект HIP (Health Insurance Plan), организованный в 1963 г. в Большом Нью-Йорке. Одной из основных задач проекта было изучение влияния маммографии на снижение смертности от РМЖ. Были включены в исследование 64 тыс. женщин от 40 до 64 лет. Посредством рандомизации 31 тыс. женщин вошла в контрольную группу, столько же женщин составили группу скрининга. Схема скрининга включала клинический осмотр молочных желез и с интервалом в 1 год – четыре 2-проекционных маммографических исследования. Женщинам в группе контроля предлагалось придерживаться обычной практики получения медицинской помощи. К концу 5-го года с момента вступления в скрининговую программу число выявленных случаев рака молочной железы было практически одинаковым в обеих группах: 307 гистологически подтвержденных случаев РМЖ в группе скрининга и 301 случай в группе контроля. К концу 7-го года прослеживания был выявлен 431 случай РМЖ в группе исследования и 448 – в группе контроля. Из 307 выявленных случаев РМЖ в группе скрининга в течение 5 лет умерло 39 женщин, а в группе контроля из 301 случая РМЖ – 63 женщины. Таким образом, разница была 38,1%. Через 10 лет прослеживания снижение смертности составило 29,3%, а к концу 18-го года развития программы – приблизительно 25%.
Авторы исследования полагают, что этому в значительной мере способствовало выявление опухолей в рамках скрининга на более ранних стадиях развития во всех возрастных группах женщин.
 Анализ полученных данных показал также отличия по результатам скрининга в зависимости от возрастных групп женщин. Так, и при клиническом осмотре молочных желез у женщин от 40 до 49 лет на 100 гистологически подтвержденных случаев РМЖ 25 случаев было выявлено с помощью только маммографии, 57 случаев – при клинической пальпации и 18 случаев – при сочетании двух методов. Для сравнения, в группе женщин 50–59 лет маммографически было выявлено 39 случаев, пальпаторно – 40 случаев, а при сочетании двух методов – 21 случай. Авторы отмечали, что значительный эффект скрининга появляется намного позднее в группе женщин от 40 до 49 лет по сравнению с женщинами старшей возрастной группы.
Анализ полученных данных показал также отличия по результатам скрининга в зависимости от возрастных групп женщин. Так, и при клиническом осмотре молочных желез у женщин от 40 до 49 лет на 100 гистологически подтвержденных случаев РМЖ 25 случаев было выявлено с помощью только маммографии, 57 случаев – при клинической пальпации и 18 случаев – при сочетании двух методов. Для сравнения, в группе женщин 50–59 лет маммографически было выявлено 39 случаев, пальпаторно – 40 случаев, а при сочетании двух методов – 21 случай. Авторы отмечали, что значительный эффект скрининга появляется намного позднее в группе женщин от 40 до 49 лет по сравнению с женщинами старшей возрастной группы.
Так, через 10 лет после начала скрининга различия в снижении смертности от РМЖ между группой исследования и группой контроля были меньше у молодых женщин (23,5%) по сравнению с возрастной группой 50–59 лет – 31,1%. Через 18 лет прослеживания результатов скрининга отличий не наблюдали (24,6% против 23,0%).
 Специфичность и чувствительность скрининговых тестов, таких как клинический (физикальный) осмотр молочной железы и маммографический, варьируют в зависимости от возраста и гормонального статуса. Таким образом, стратегия скрининга имеет возрастно-специфические особенности. Программа в Стокгольме началась в 1981 г., и было проведено два раунда с интервалами в 28 и 24 мес. В группу скрининга вошло 40 318 женщин, которым предлагалось пройти 1-проекционное маммографическое исследование. Группа контроля составила 20 тыс. женщин. В 1986 г. группу контроля также пригласили принять участие 1 раз в скрининге, и программа была завершена. Прослеживание участниц скрининга в среднем составило 11 лет 4 мес. В данном исследовании не удалось получить снижения смертности от РМЖ в возрастной группе 40–49 лет, но было отмечено значительное снижение в группе женщин старше 50 лет.
Специфичность и чувствительность скрининговых тестов, таких как клинический (физикальный) осмотр молочной железы и маммографический, варьируют в зависимости от возраста и гормонального статуса. Таким образом, стратегия скрининга имеет возрастно-специфические особенности. Программа в Стокгольме началась в 1981 г., и было проведено два раунда с интервалами в 28 и 24 мес. В группу скрининга вошло 40 318 женщин, которым предлагалось пройти 1-проекционное маммографическое исследование. Группа контроля составила 20 тыс. женщин. В 1986 г. группу контроля также пригласили принять участие 1 раз в скрининге, и программа была завершена. Прослеживание участниц скрининга в среднем составило 11 лет 4 мес. В данном исследовании не удалось получить снижения смертности от РМЖ в возрастной группе 40–49 лет, но было отмечено значительное снижение в группе женщин старше 50 лет.
В этом исследовании были подвергнуты анализу данные о ложноположительных результатах и стоимости проводимых мероприятий. Так, частота повторных вызовов, взятия биопсий, дополнительных рентгеновских обследований составила 0,8%. Число ложноположительных ответов было больше в группе женщин от 40 до 49 лет, а количество выявленных случаев РМЖ было меньше по сравнению с группой женщин старше 50 лет. Получение ложноположительных заключений оказывает тяжелую психологическую травму, а также делает программу более дорогостоящей. В среднем 11% всех скрининговых маммограмм при просматривании получают заключение – не норма, и, как правило, возникает необходимость как минимум двух дополнительных диагностических исследований (ультразвук, диагностическая маммография, биопсия). На восемь произведенных биопсий в возрастной группе женщин 40–49 лет удается выявить один инвазивный рак и один рак in situ молочной железы.
 Все сказанное выше относится к понятию побочных эффектов скрининга, что и является одной из сложнейших сторон такого рода программ и требует дальнейшего изучения. Организаторы скрининговой программы в двух графствах Швеции ставили своей задачей изучить влияние возраста и гистологического типа опухоли, включая степень злокачественности с точки зрения эффекта скрининга в снижении смертности. По результатам скрининга в двух графствах отмечено снижение смертности в пределах 30% во всех возрастных группах женщин. Но у женщин 40–49 лет снижение было 12%, а у женщин 50–74 лет – 33%. У женщин 40–49 лет более 50% опухолей размером 15 мм или больше относились к гистопатологической градации G3, а у женщин 50 лет и старше это было характерно при размере опухоли 20 мм и больше.
Все сказанное выше относится к понятию побочных эффектов скрининга, что и является одной из сложнейших сторон такого рода программ и требует дальнейшего изучения. Организаторы скрининговой программы в двух графствах Швеции ставили своей задачей изучить влияние возраста и гистологического типа опухоли, включая степень злокачественности с точки зрения эффекта скрининга в снижении смертности. По результатам скрининга в двух графствах отмечено снижение смертности в пределах 30% во всех возрастных группах женщин. Но у женщин 40–49 лет снижение было 12%, а у женщин 50–74 лет – 33%. У женщин 40–49 лет более 50% опухолей размером 15 мм или больше относились к гистопатологической градации G3, а у женщин 50 лет и старше это было характерно при размере опухоли 20 мм и больше.
Исследование в Гетеборге было также направлено на изучение эффекта скрининга у более молодых женщин – 39–59 лет. Всего было проведено 5 раундов скрининга. Маммографию проводили в двух проекциях с интервалом в 18 мес., в группу скрининга вошло 21 650 женщин, а в контрольную – 21 961 женщина. Прослеживание обеих групп продолжалось на протяжении 12 лет. В группе исследования у женщин 39–49 лет (11 724 женщины) было обнаружено 148 случаев РМЖ, в этой группе умерли 18 женщин. В группе контроля (14 217 женщин) было выявлено 196 случаев РМЖ и умерли 39 женщин. Авторы исследования считают, что снижение смертности в данной возрастной группе было 44%. Полученные результаты произвели ошеломляющее впечатление, так как скрининг в такой возрастной группе связывают с определенными трудностями. Необходимо заметить, что происходило не только снижение смертности, но и снижение числа запущенных форм рака. У женщин моложе 50 лет в группе скрининга было выявлено 39 случаев РМЖ с пораженными лимфоузлами, а в контрольной группе – 74 случая.

Почему
результаты скрининга РМЖ имеют отличия по возрастным группам женщин? Частично это можно объяснить меньшей точностью скрининговых методов у более молодых женщин . Также темп роста опухолевой массы может отличаться у женщин разных возрастных групп. Tabar и соавт. обнаружили, что продолжительность преклинической фазы опухоли составила 1,25 года для женщин 40–49 лет и 3 года для женщин 50–59 лет. Как оказывают воздействие уровень эстрогенов и менопауза вне зависимости от возраста на эффективность скрининга РМЖ, остается неясным и требует дальнейшего изучения.Маммографически
скрининг женщин 50 лет и старше способствует выявлению значительного большинства опухолей молочных желез и обнаруживает их на стадии, когда они поддаются излечению. Чувствительность скрининговой маммографии при выявлении инвазивного РМЖ ниже у женщин 40–49 лет и составляет 75% по сравнению с 93% у женщин 50 лет и старше. Такую низкую чувствительность можно объяснить большей долей быстро растущих, агрессивных опухолей молочных желез, что приводит к появлению интервальных раков между регулярными скрининговыми осмотрами. У женщин 40–49 лет доля медленно растущих опухолей, выявляемых маммографически, невелика, что, может быть, и является объяснением замедленного эффекта скрининга в данной возрастной группе.Широкое распространение маммографического скрининга способствовало значительному росту выявленных случаев внутрипротоковой карциномы in situ (DCIS).
Скрининговая маммография привела к изменению стадийности выявляемых опухолей молочной железы и выявлению образований меньших размеров. Приблизительно 30% образований составляет внутрипротоковая карцинома in situ (DCIS) и более 50% случаев инвазивного рака менее 1 см в размере. Внутрипротоковая карцинома in situ относится к преинвазивному или неинвазивному раку, так как она ограничена млечными протоками молочной железы и не распространяется на окружающие ткани. До внедрения маммографии в большинстве случаев обнаружение данной патологии было случайной находкой при взятии биопсии из доброкачественных образований. По своим морфологическим характеристикам внутрипротоковая карцинома in situ возникает из эпителиального слоя протоков, а рентгенологические характеристики представляют в большинстве случаев скопление микрокальцинатов (75%) или небольшие участки уплотнений с деформированной структурой (25%).В США в 1991 г. в результате маммографического скрининга около 12% всех выявленных случаев РМЖ составил
внутрипротоковый преинвазивный рак. В разных возрастных группах данное заболевание встречается с неодинаковой частотой. В возрастной группе женщин до 40 лет внутрипротоковый преинвазивный рак диагностировался в 5% случаев РМЖ. В группе женщин от 40 до 49 лет эта патология встречалась в 25% случаев, а у женщин 50–59 лет – в 43% случаев. Основываясь на данных SEER, в США за период с 1973 по 1993 г. заболеваемость внутрипротоковым преинвазивным РМЖ возросла на 54, 9%. Для сравнения, за тот же период времени рост заболеваемости РМЖ составил 31,9%. Наиболее значительный рост показателей заболеваемости внутрипротоковой карциномой in situ за период 1983–1993 гг. отмечен у женщин 40 лет и старше. Для женщин моложе 40 лет показатели заболеваемости DCIS были невысокие, что объясняется сравнительно редким участием молодых женщин в маммографическом скрининге. Стремительный рост выявленных при скрининге случаев внутрипротоковой карциномы in situ поставил новые задачи и перед врачами и перед женщинами. Вероятнее всего, что только определенная часть DCIS трансформируется в инвазивный РМЖ. Однако знания, которыми мы располагаем в настоящее время, не позволяют нам идентифицировать тех женщин, у которых DCIS прогрессирует в инвазивный рак, и тех, с кем это не случится. Но в любом случае все они будут подвергнуты хирургическому лечению. Это вызывает неуверенность, так как выявленные изменения могут не представлять угрозы для жизни и никак не проявлять себя клинически. В таком случае женщина будет подвергнута чрезмерному лечению. Эта ситуация очень напоминает проблему скрининга рака предстательной железы с использованием PSA. Иными словами, выявление таких ранних изменений молочной железы, как внутрипротоковый преинвазивный рак, может привести к гипердиагностике РМЖ.
Стремительный рост выявленных при скрининге случаев внутрипротоковой карциномы in situ поставил новые задачи и перед врачами и перед женщинами. Вероятнее всего, что только определенная часть DCIS трансформируется в инвазивный РМЖ. Однако знания, которыми мы располагаем в настоящее время, не позволяют нам идентифицировать тех женщин, у которых DCIS прогрессирует в инвазивный рак, и тех, с кем это не случится. Но в любом случае все они будут подвергнуты хирургическому лечению. Это вызывает неуверенность, так как выявленные изменения могут не представлять угрозы для жизни и никак не проявлять себя клинически. В таком случае женщина будет подвергнута чрезмерному лечению. Эта ситуация очень напоминает проблему скрининга рака предстательной железы с использованием PSA. Иными словами, выявление таких ранних изменений молочной железы, как внутрипротоковый преинвазивный рак, может привести к гипердиагностике РМЖ.
Таким образом,
маммографический скрининг не только способствовал росту выявляемости внутрипротоковой карциномы in situ во всех возрастных группах женщин, но и дал толчок к развитию исследований по изучению природы происхождения данного заболевания.Заключая, необходимо подчеркнуть значимость результатов многих рандомизированных клинических исследований, отчетливо показавших, что раннее обнаружение рака молочной железы с помощью маммографии вместе или без физикального обследования желез на регулярной основе снижает смертность от данной формы рака у женщины в возрасте от 50 до 69 лет приблизительно на 30%. Что касается женщин 40–49 лет, картина еще не совсем ясная, но эксперты всего мира продолжают анализ полученных результатов скрининга в данной возрастной группе.
Возраст и рак молочной железы
С возрастом риск возникновения рака молочной железы увеличивается.
Факторы риска рака молочной железы
- личная история, которая является предысторией возникновения рака молочной железы
- специфические генетические изменения и повышенный риск заболеваемости раком молочной железы (BRCA - / BRCA - 2 мутации)
- мать, сестра, дочка или двоюродные сестры с историей рака молочной железы (особенно если болезнь обнаружили в молодом возрасте);
- диагностика состояния молочных желез (например, атипичная гиперплазия), которое может быть предраковым или запись цикла биопсий начала болезни
- женщины 45 лет и старше, которые имеют около 75% уплотнений ткани на маммограмме
- незначительное повышение риска заболеть раком молочной железы у женщин, которые родили первого ребенка в 30 лет и старше
- женщины, которые получали рентгенотерапию при болезни Ходжкина (лимфогранулематоз) в возрасте 30 лет и меньше, рискуют больше других заболеть раком молочной железы.
Если вышеуказанные факторы вас не касаются, то это еще не значит, что вы в безопасности. Большинство женщин, которые болеют раком молочной железы, не имеют истории наследственности этой болезни и не подпадают ни под одну группу риска.
Маммография и рак молочной железы
- Если вам 40-50 лет, делайте маммографию 1 раз в 2 года. Если вам больше 50, делайте маммографию 1 раз в 1 год.
- Проконсультируйтесь с врачом насчет планирования частоты рентгеновских снимков молочной железы и обследования молочных желез.
- Соберите максимум информации про наследственные заболевания в вашей семье.
Зачем нужна маммография?
- Маммография выявит опухоль намного раньше того, как ее можно будет почувствовать.
- Маммография – наилучший доступный сегодня способ, чтобы определить рак молочной железы на ранней стадии, что помогает бороться с опухолью.
Недостатки маммографии
- Маммография может и не определить опухоль на ранней стадии.
- Маммография может определить изменения молочной железы, которые бывают не всегда злокачественными.
Источники:
http://www.mammology.info/skrining.htm
http://mshealthy.com.ua/disease-art-mamograph.htm
Опубликовано 10.12.2013 в 17:11
polonsil.ru
Скрининг рака молочной железы
Российская Академия Медицинских Наук Российский Онкологический научный центр им. Н.Н. Блохина г. Москва Отдел лучевой диагностики
Российский Государственный Медицинский Университет
Реферат. В клинической лекции представлен обзор литературных данных по скринингу рака молочной железы. Обсуждаются положительные и отрицательные эффекты скрининговых программ. Ключевые слова: скрининг — рак молочной железы — диагностика.
Среди разнообразных заболеваний молочной железы у женщин рак (РМЖ) представляет важнейшую проблему из-за высокой заболеваемости и смертности от него. Ежегодно в мире выявляют около 1 млн. случаев РМЖ. Прогнозируется рост числа заболеваний к 2010 году до 1,45 млн.
Рак молочной железы является наиболее частой причиной смерти женщин по сравнению с другими формами злокачественных новообразований. На сегодняшний день ясно, что реальных способов предотвратить рак молочной железы нет — болезнь мультифакторного происхождения.
Однако рак этой локализации излечим, если он распознан в доклиническом периоде, когда вероятность метастазов мала. При раннем РМЖ до 1 см3 можно вылечить большинство больных. Анализируя распределение выявленных злокачественных новообразований молочной железы по стадиям в 2007 году — 37,8% составили опухоли в третьей и четвертой стадиях. Реальные успехи в лечении и снижении смертности от РМЖ определяет доля первой стадии заболевания. Поэтому основные усилия должны быть направлены на разработку и оптимизацию форм и методов ранней диагностики РМЖ. Маммографический скрининг РМЖ в настоящее время является основным методом доклинической диагностики опухолей молочной железы.
Скрининг — массовые проверочные обследования здорового контингента населения с целью выявления столь ранней стадии заболевания, которое приводит к снижению смертности!!!
Скрининг, в конечном счете, должен привести к снижению смертности от той формы рака, для преклинического выявления которой он проводится. Косвенными признаками эффективности метода являются снижение частоты выявления распространенных форм, увеличения частоты ранних форм рака и улучшение выживаемости.
Для планирования скрининговых программ необходимо учитывать следующие критерии целесообразности его проведения. Планируемая для скрининга форма рака должна являться важной проблемой здравоохранения для страны или региона, в которой проводится скрининг, т.е. заболеваемость и смертность от нее должна быть высокой. Скрининг редких опухолей проводить не рекомендуется. Например, для России, по этому критерию, целесообразно проводить скрининг рака легкого, рака молочной железы, рака шейки матки. В то же время целесообразность проведения скрининга рака простаты в нашей стране сомнительна, так как, заболеваемость и смертность от рака этого органа еще относительно низка.
Скрининг должен быть направлен на выявление образований, которые в отсутствие скрининга прогрессируют и дают метастазы и соответственно, могут привести к смерти. Нецелесообразно проводить скрининг тех форм рака, которые, несмотря на активное выявление на преклинических стадиях и соответствующее лечение, прогрессируют, метастазируют и приводят к смерти больного. Скрининг, направленный на выявление злокачественных нобразований, которые в отсутствие подобных программ никогда себя не проявляют и соответственно, не могут быть причиной смерти, являются лишней тратой времени и ресурсов, и, что самое главное, зачастую наносит вред психологическому здоровью человека.
За период 1963 — 1994 гг. проведено восемь рандомизированных исследований скрининга РМЖ. Результаты этих исследований обеспечивают информацию о влиянии маммографии, клинического обследования (CBE — Clinical Breast Examination) и самообследования (BSE — Breast Self-Examination) молочных желез на смертность от рака молочной железы [3,4,5,6,7,8,9.10,11].
Сегодня ведущим методом скрининга РМЖ является маммография, которая позволила снизить смертность от рака молочной железы до 30%.
Ключевым фактором достижения главного результата скрининга РМЖ является высокое качество всего процесса скрининговой программы. Радиолог играет главную роль, беря на себя полную ответственность за качество маммографического исследования и его диагностическую интерпретацию. Полное знание и понимание риска\пользы маммографического скрининга РМЖ требует организации инфраструктуры, формирование команды включающую клинических и не клинических специалистов вовлеченных в данный процесс (эпидемиолог, физик, хирург-онколог, патоморфолог, рентгенолог, рентгентехник).
Критический анализ опыта стран Европейского сообщества демонстрирует наличие некого баланса между желательными и нежелательными эффектами даже в организованных высококачественных программах. Чувствительность и специфичность маммографического исследования и его интерпретации должны быть оптимальны. Это может быть достигнуто только при действующей всесторонней системе проверки качества всех звеньев вовлеченных в программу скрининга РМЖ (необходим всесторонний физико-технический контроль качества маммографического исследования; надлежащее обучение и тренинг медицинского персонала; и т.д.). Использование не оптимального оборудования неподготовленных специалистов — значительно уменьшит основные преимущества скрининга РМЖ и приведет к значительному удорожанию программы.
В России государственная программа по скринингу РМЖ — отсутствует. В настоящее время в 80% случаев РМЖ выявляется больной самостоятельно в 10% — при врачебном осмотре и только в 10% — при маммографии. Выявляемость заболевания в целом по стране остается низкой, не превышая 18%, а показатель запущенности (больные III и IV стадиями), который является ведущим критерием качества диагностики, напротив, высоким — около 40%. Отсюда высокие показатели смертности от РМЖ: летальность на первом году с момента установления диагноза равна 11,9%.
За последние 15 лет смертность от РМЖ остается на прежнем уровне. Это свидетельствует, что все принимаемые меры по уменьшению показателей смертности от РМЖ не имеют достаточной эффективности. Это связано с недостаточной оснащенностью современным маммографическим оборудованием, с низкой профессиональной подготовкой специалистов, отсутствие стандартизации самого маммографического обследования.
В РФ имеется 1294 маммографа (3,7 на 1 млн. населения), из них 741 подлежит замене. Необходимы 12 маммографов на 1 млн. населения, т е. еще 1175 аппаратов. 70% регионов имеют слабую оснащенность, а такие регионы, как Камчатка, Чукотка, Курган, Белгород и др., вообще не имеют современных маммографов.
Чтобы обеспечить высокое качество программы необходимо специальное обучение медицинских работников перед включением в процесс скрининга РМЖ. Это должно производится в специализированном учебном центре. Программа может состоять из двух частей: академический компонент и клинический компонент. Теоретический курс призван дать знания и понимания всех аспектов раннего выявления РМЖ, и может состоять из лекций, обучающих программ, демонстраций и практических занятий. Содержание должно включать анатомию и физиологию молочной железы, патологическую анатомию, рентгенопатоморфологические корреляции, техническую проверку качества исследования, коммуникацию и социальные навыки, эпидемиологические аспекты, диагностика РМЖ и выбор лечения, организация программы маммографического скрининга РМЖ. Врач-рентгенолог должен полностью осознавать ценность мультидисциплинарного подхода к диагнозу РМЖ.
В конце клинического обучения рентгенолог получит достаточные знания маммографического аппарата, процесса получения изображения и проявки пленки, будет в состоянии сделать качественное маммографическое исследование, решать технические проблемы качества, выполнять ежедневные и\или еженедельные технические процедуры проверки качества исследования, иметь социальные навыки общения с пациентами, принимать определенные административные решения. Кроме того рентгенолог будет знаком с дополнительными методами диагностики РМЖ (УЗИ, МРТ, различные виды биопсий). Желательно, чтобы теоретические, практические, социальные навыки лучевого диагноста в процессе обучения были протестированы. При удовлетворительном результате рентгенолог должен получить свидетельство установленного образца.
Формирование штатов сотрудников обеспечивающих проведение программы обследования должны соответствовать рабочей нагрузке. При этом неуместно избыточное давление на рентгенолога увеличением объема работы, что может неблагоприятно сказаться на качестве. Каждая бригада в течение 6-часового рабочего дня в состоянии качественно выполнить обследование 22 пациентов с условием анализа изображений сразу после выполнения исследования. При отсроченном анализе маммограмм пропускная способность может быть увеличена приблизительно в 1,5 раза.
Для проведения массовых маммографических обследований женщин был разработан и внедрен в практику передвижной маммографический кабинет. ЗАО «Рентгенпром» в 2003 г. создал надежный передвижной маммографический кабинет на базе КамАЗ-53215.
С 2003 по 2005 год в 34 городах России с помощью мобильных комплексов было обследовано 19 468 женщин. Каждый год в период с мая по сентябрь ежедневно бригады маммологов-рентгенологов РОНЦ, Московского онкологического института им. Герцена, поликлиники управления делами Президента России, онкологических диспансеров Москвы, Тулы и Калуги, проводили бесплатные обследования женщин старше 40 лет.
Данные показывают, что процент выявленной злокачественной патологии молочной железы остается высоким (более 1%). Связано это в первую очередь с отсутствием во многих регионах даже самой возможности проведения обследования на предмет раннего выявления РМЖ. Так, при прохождении мобильных маммографических комплексов по крупным городам до 20% обследованных женщин проживали в пригороде и небольших поселках, где отсутствует возможность проведения специализированных обследований. В связи с этим, создание выездных комплексных маммологических групп является одной из форм реализации ранней диагностики РМЖ в условиях России путем приближения специализированной онкомаммологической помощи женскому населению тех районов, которые удалены от профильных медицинских учреждений.
Какую экономическую эффективность можно планировать при принятии государственной программы по скринингу РМЖ?
1. Снижение смертности до 17% (у женщин 40 — 49 лет) и до 30% (у женщин старше 50 лет).
2. Уменьшение общих затрат на лечение за счет:
- лечение больных третьей, четвертой стадий обходится в 15-30 раз дороже, чем при первой стадии
- уменьшения объема операции от мастэктомии до секторальной резекции приводит к сокращению сроков госпитализации, отсутствию инвалидизации больных (оптимизация расходов на лечение, в том числе дорогостоящее стационарное, на выплату единовременных пособий по временной нетрудоспособности, пенсий по инвалидности);
- отсутствия необходимости в реконструктивных операциях и протезировании;
- уменьшения использования дорогостоящего химиотерапевтического лечения (оптимизация компенсаций по социальным льготам, по оплате лекарственных средств).
Для достижения указанных целей необходимо обеспечить решение следующих основных задач:
- создание постоянно действующей информационно-пропагандистской системы для населения; проведение мероприятий по информированности женщин о заболевании раком молочной железы, разъяснение необходимости прохождения регулярного маммографического обследования;
- реализация проекта путем массового обследования женщин возраста 40-69 лет с определенным интервалом для разных возрастных групп;
- обеспечение профильных учреждений современным диагностическим оборудованием для проведения маммографического скрининга рака молочной железы; использование мобильных маммографических комплексов;
- повышение квалификации медицинских работников, участвующих в программе скрининга рака молочной железы;
- обеспечение функционирования на региональном уровне системы учета больных с заболеванием РМЖ;
- создание обобщающей базы данных по стране, определение регионов РФ с наибольшей заболеваемостью РМЖ;
Реализация подобной программы позволит улучшить демографическую ситуацию в России, сохранить трудовой потенциал страны, повысить эффективность оказания специализированной медицинской помощи и квалификацию кадрового состава здравоохранения.
Работа была выполнена при частичной поддержке грантом Федерального агентства по науке и инновациям 02.512.11.2339.
Таблица 1
Исследования скрининга РМЖ
| Название исследования и методика скрининга | страна | годы | возраст | количество | |
| скрининг | контроль | ||||
| HIP Маммография + CBE | США | 1963-1979 | 40-64 | 30239 | 30256 |
| CNBSS-1 Маммография + CBE + BSE | Канада | 1980-1993 | 40-49 | 25214 | 25216 |
| CNBSS-2 Маммография + CBE + BSE | Канада | 1980-1993 | 50-59 | 19711 | 19694 |
| Edinburgh Маммография + CBE | Великобритания | 1978-1992 | 45-64 | 28628 | 26015 |
| Gothenburg маммография | Швеция | 1982-1994 | 39-59 | 20724 | 28809 |
| Stockholm маммография | Швеция | 1981-1992 | 40-64 | 40318 | 19943 |
| Malmo маммография | Швеция | 1976-1991 | 45-70 | 21088 | 21195 |
| Swedish Two County маммография | Швеция | 1977-1977 | 40-74 | 77080 | 55985 |
Таблица 2
Результаты Канадских исследований
| Исследования возраст женщин | Число выявленных РМЖ | Метод обнаружения в процентах (%) | ||
| Маммография + CBE | Маммография | CBE | ||
| CNBSS-1 40-49 лет | 255 | 36% | 40% | 24% |
| CNBSS-2 50-59 лет | 325 | 35% | 53% | 12% |
Таблица 3
Методика маммографического скрининга
| Возраст | Рекомендации | Преимущества |
| 40 — 49 лет | Маммография каждые 2 года, с клиническим осмотром молочной железы или без него. | Может уменьшить риск смерти от рака молочных желез на 17 процентов |
| 50 — 74 лет | Маммография каждые 1-2 года, с клиническим осмотром молочной железы или без него. | Может уменьшить риск смерти от рака молочных желез на 30 процентов |
Таблица 4
Дополнительные диагностические процедуры
| Возраст | Количество женщин | Количество маммографий (снимков) | Количество биопсий | Количество выявленных РМЖ |
| 40-49 лет | 640 | 1280 | 150 | 30 |
| 50-59 лет | 680 | 1360 | 188 | 60 |
Г.П. Корженкова, врач-онколог, лучевой диагност, к.м.н., старший научный сотрудник Российского онкологического научного центра им. Н. Н. Блохина РАМН, медицинский эксперт Благотворительной программы Avon «Вместе против рака груди»
Литература:
1. Линденбратен Л.Д., БурдинаЛ.М., Пинхосевич Е.Г. Маммография — учебный атлас 1998.
2. Семиглазов В.Ф., Моисеенко В.М. и др. Программа Россия (Санкт-Петербург) / ВОЗ по оценке эффективности самообследования молочной железы. Материалы I съезда онкологов СНГ. 1996, ч.2. — с.41.
3. Elmore JG, Barton MB, Moceri VM, Polk S, Arena PJ, Fletcher SW. Ten-year risk of false positive screening mammograms and clinical breast examinations. N Engl J Med. 1998;338(16):1089-1096
4. Fieg S.A., et al, Hypothetical breast cancer risk from mammography. Recent Results Cancer Res 1984; 90:1-10
5. Frisell J, Lidbrink E. The Stockholm Mammographic Screening Trial: Risks and benefits in age group 40-49 years. J Natl Cancer Inst Monogr. 1997;22:49-51.
6. Ringash J, Canadian Task Force on Preventive Health Care. Preventive health care, 2001 update: screening mammography among women aged 40-49 years at average risk of breast cancer. Can Med Assoc J. 2001;164(4):469-476.
7. Rajkumar SV, Hartmann LC. Screening mammography in women aged 40-49 years. Medicine. 1999;78(6):410-416.
8. Shapiro S. Periodic screening for breast cancer: the HIP Randomized Controlled Trial. Health Insurance Plan. J Natl Cancer Inst Monogr. 1997;22:27-30
9. Tabar L, Chen HH, Fagerberg G, Duffy SW, Smith TC. Recent results from the Swedish Two-County Trial: the effects of age, histologic type, and mode of detection on the efficacy of breast cancer screening. J Natl Cancer Inst Monogr. 1997; 22:43-47.
10. Miller AB, To T, Baines CJ, Wall C. The Canadian National Breast Cancer Screening Study-2: 13-year results of a randomized trial in women aged 50-59 years. J Natl Cancer Inst. 2000; 92(18):1490-1499.
11. Miller AB, To T, Baines CJ, Wall C. The Canadian National Breast Screening Study: update on breast cancer mortality. J Natl Cancer Inst Monogr. 1997; 22:37-41.
mfvt.ru