Миома с центрипетальным ростом
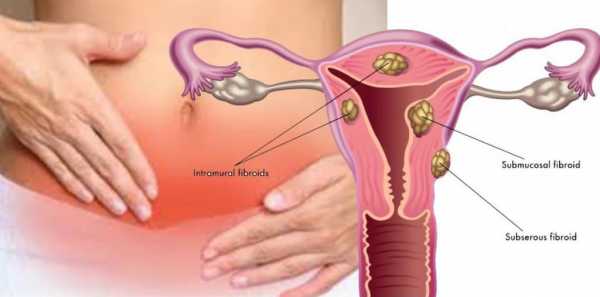
Миома матки
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю ЯМиома матки - доброкачественная гормонозависимая опухоль у женщин репродуктивного возраста (в основном 30-45 лет). Миома матки составляет до 30% гинекологических заболеваний.
Современное представление о развитии миомы матки основано на гормональной теории. Нарушения экскреции и метаболического превращения эстрогенов, а также соотношения фракций эстрогенов (преобладание эстрона и эстрадиола в фолликулиновую, а эстриола - в лютеиновую фазу) приводят к морфологическим изменениям в миометрий. Масса миометрия может увеличиваться в результате как гиперплазии гладкомышечных клеток, которая инициируется эстрогенами, так и гипертрофии этих клеток. Наряду с эстрогенами рост миомы стимулирует прогестерон. Гипертрофия гладкомышечных клеток при миоме матки аналогична их гипертрофии во время беременности и может возникать только при сочетанном воздействии сравнительно высоких концентраций эстрадиола и прогестерона. В лютеиновую фазу прогестерон повышает митотическую активность миомы, кроме того, прогестерон воздействует на рост миомы путем индуцирования факторов роста. В ткани миомы рецепторов эстрадиола и прогестерона больше, чем в неизмененном миометрий. Нарушение обмена половых стероидов в миоматозных узлах вызывает аутокринную стимуляцию клеток при участии так называемых факторов роста. Медиаторами действия эстрогенов в ткани миомы матки являются инсулиноподобные факторы роста I и II.
Наряду с гормональными аспектами патогенеза миомы матки немаловажную роль играют изменения иммунной реактивности организма, особенно при хронических очагах инфекции; выраженные изменения гемодинамики малого таза, а также наследственная предрасположенность. Зоны роста миомы формируются вокруг воспалительных инфильтратов и эндометриоидных очагов в миометрии. В увеличении миомы значительную роль играют фенотипическая трансформация гладких мышечных клеток и дегенеративные изменения в условиях нарушенной микроциркуляции. Зачатки миоматозных узлов могут образовываться на эмбриональном этапе. Рост клеток-предшественников продолжается много лет на фоне выраженной активности яичников под действием эстрогенов и прогестерона.
Миомы неоднородны по структуре. По тканевому составу узлы подразделяют на миомы, фибромы, ангиомиомы и аденомиомы.
По морфогенетическим признакам выделяют 3 основные формы:
- • простые миомы, развивающиеся по типу доброкачественных мышечных гиперплазии;
- • пролиферирующие миомы с морфогенетическими критериями истинной доброкачественной опухоли. У каждой 4-й больной миома матки пролиферирующая с быстрым ростом миоматоз-ных узлов. Патологические митозы в пролиферирующих миомах не превышают 25%;
- • предсаркомы - этап на пути истинной малигнизации.
Предсаркома включает в себя множественные очаги пролиферации миогенных элементов с явлениями атипии, неоднородностью ядер клеток; количество патологических митозов достигает 75%. Однако истинная малигнизация миомы происходит менее чем в 1% клинических наблюдений.
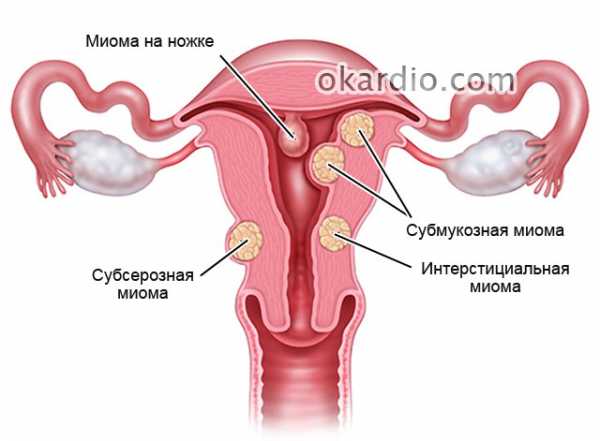
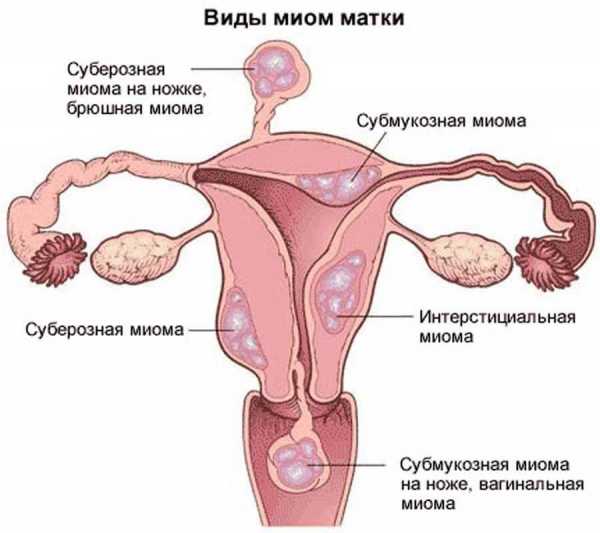
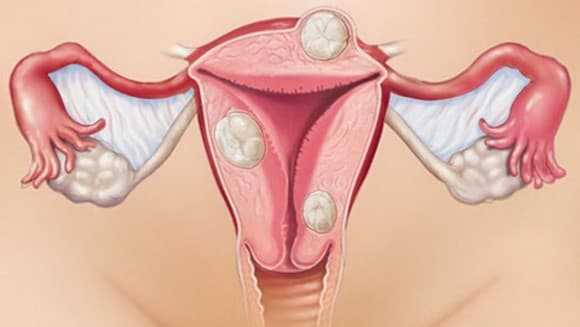
В зависимости от локализации и роста миоматозных узлов выделяют субмукозные (подслизистые) миоматозные узлы, растущие в полость матки и деформирующие ее (см. раздел «Внутриматочная патология»), и субсерозные (подбрюшинные) узлы. Миоматозные узлы растут в сторону брюшной полости. Если по мере роста миоматозный узел расслаивает листки широкой маточной связки. Его называют интралигаментарным миоматозным узлом. Интерстициальные (межмышечные) миоматозные узлы растут из среднего слоя миометрия и располагаются в толще миометрия.
Клиническая картина субсерозных миоматозных узлов в значительной степени зависит от их топографического расположения и размера. Существует классификация субсерозных узлов, основанная на соотношении интерстициального и субсерозного компонентов:
- 0 тип - субсерозный миоматозный узел на тонком основании;
- 1 -й тип - менее 50% объема миоматозного узла располагается интерстициально;
- 2-й тип - более 50% объема миоматозного узла располагается интерстициально;
- 3-й тип - интралигаментарные субсерозные миоматозные узлы.
Отдельные субсерозные миоматозные узлы (0 тип) малых размеров могут долго клинически себя никак не проявлять, но по мере увеличения их размера появляются признаки нарушения питания опухоли, увеличивается вероятность перекрута ножки миоматозного узла. Пациентки могут предъявлять жалобы на дискомфорт внизу живота, периодически возникающие тянущие или острые боли. Боли могут иррадиировать в поясничную область, ногу, промежность. При совершившемся перекруте ножки миоматозного узла или возникновении обширной зоны некроза боли становятся интенсивными, появляются симптомы раздражения брюшины и общеклинические признаки перитонита.
Интерстициально-субсерозные миоматозные узлы 1-го и 2-го типов менее подвержены деструктивным процессам вследствие нарушения питания, клинически себя долго не проявляют и могут достигать в диаметре 10-25 см и более. Больных беспокоят чувство тяжести и дискомфорта внизу живота, увеличение живота. Болевой синдром связан с растяжением висцеральной брюшины матки, давлением миоматозных узлов на нервные сплетения малого таза. При нарушении кровообращения в больших миоматозных узлах боли острые. В зависимости от локализации субсерозных узлов возможно нарушение функции соседних органов. Рост миоматозного узла кпереди способствует развитию дизурических явлений: больные предъявляют жалобы на учащенное мочеиспускание, неполное опорожнение мочевого пузыря, императивные позывы к мочеиспусканию, острую задержку мочи. Перешеечное расположение миоматозного узла на задней стенке матки приводит к давлению на прямую кишку и нарушает дефекацию. Субсерозные узлы, располагающиеся на боковой стенке матки в нижней и средней трети, при достижении больших размеров изменяют топографию мочеточника, могут приводить к нарушению пассажа мочи с пораженной стороны, возникновению гидроуретера и формированию гидронефроза. Субсерозные миоматозные узлы редко вызывают нарушение менструальной функции. Однако при множественных субсерозных миоматозных узлах 1-2-го типов возможно нарушение сократительной способности миометрия с менометроррагиями.
Интерстициальные миоматозные узлы приводят к увеличению матки и могут заметно влиять на сократительную способность миометрия. Пациентки предъявляют жалобы на обильные длительные менструации, реже на межменструальные кровяные выделения из половых путей. Однако прямой зависимости между размерами матки и появлением маточных кровотечений нет. Анемия у больных миомой матки может быть следствием хронических кровопотерь и острых маточных кровотечений. Без нарушений менструального цикла анемия может быть обусловлена депонированием крови в увеличенной миоматозными узлами матке. У пациенток с большой миомой матки (более 20 нед беременности) может быть синдром нижней полой вены - сердцебиение и одышка в положении лежа. Пациентки могут предъявлять жалобы на боли, увеличение живота, возможны острая задержка мочи, гидронефроз.
При сочетании интерстициальных, субмукозных и субсерозных узлов клиническая картина многообразнее, чем при изолированных миоматозных узлах.
При гинекологическом осмотре отдельные субсерозные миоматозные узлы (0 тип) пальпируются отдельно от матки как округлые плотные, подвижные образования. Субсерозные узлы 1-2-го типов приводят к увеличению матки и изменению ее формы. Матка может достигать значительных размеров, ее поверхность становится бугристой, миоматозные узлы плотные, и при нарушении кровообращения их пальпация болезненна. Субсерозные узлы 3-го типа (интралигаментарные) определяются сбоку от матки, выполняя параметрий. Нижний полюс узла достижим при пальпации через боковой свод влагалища, узел плотной консистенции, ограниченно подвижный при попытке смещения. У больных с интерстициальной миомой пальпируется увеличенная матка плотной консистенции с гладкой или бугристой поверхностью, как правило, безболезненная.
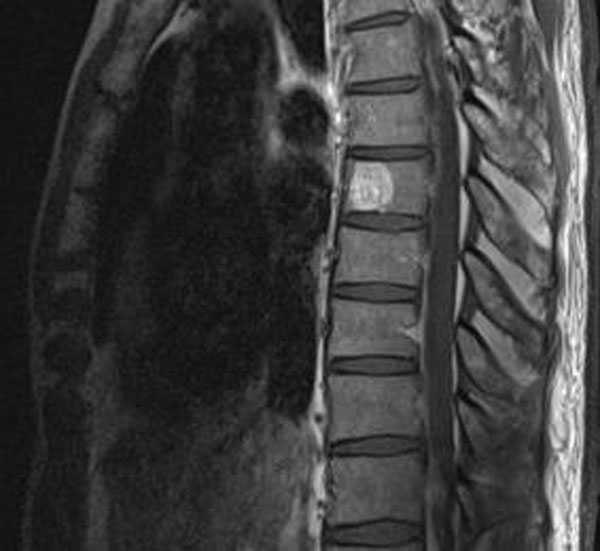
При УЗИ субсерозные миоматозные узлы визуализируются в виде округлых или овальных образований, выходящих за наружный контур матки. Миоматозные узлы зачастую имеют слоистую структуру и так называемую псевдокапсулу, которая образуется в результате уплотнения и гипертрофии миометрия, прилежащего к миоматозному узлу. Эхогенность и звуковая проводимость зависят от гистологического строения миоматозного узла. В однородных гиперэхогенных миоматозных узлах преобладает фиброзная ткань. Появление интранодулярных гипоэхогенных включений указывает на некроз или кистозные полости. Гиперэхогенные включения с акустическим эффектом поглощения бывают при кальцинированных дегенеративных изменениях. Ультразвуковое сканирование позволяет обнаружить интерстициальные миоматозные узлы диаметром не более 8-10 мм. По данным УЗИ в зависимости от направления роста интерстициальных миоматозных узлов можно прогнозировать появление субмукозных и субсерозных миоматозных узлов. Центрипетальное расположение миомы указывает на рост интерстициального миоматозного узла в полость матки, при увеличении такого узла более 10 мм появляется отчетливая деформация полости матки. Центрифугальный рост узлов происходит по направлению к брюшной полости. Центральный рост бывает при истинной межмышечной локализации миоматозных узлов и приводит к диффузному увеличению матки. Ультразвуковое сканирование дополняется исследованием пери- и интранодулярного кровотока для уточнения морфотипа опухоли. Рост миоматозных узлов зависит от увеличения кровотока в сосудистой сети матки. Плотность расположения сосудов связана с морфологическим строением и локализацией миоматозного узла. Большое количество артерий находится на периферии миоматозного узла. УЗИ, дополненное допплерографией, позволяет оценить особенности кровообращения в миоматоз-ных узлах. При простой миоме регистрируется единичный периферический кровоток, при пролиферирующей миоме - интенсивный центральный и периферический внутриопухолевый кровоток.
Для уточнения топографического расположения субсерозных миоматозных узлов можно использовать ультразвуковые томографы, дающие трехмерное ультразвуковое изображение.
Для дифференциальной диагностики субсерозных узлов и опухолей забрюшинного пространства, увеличенных лимфатических узлов, опухолей малого таза и брюшной полости наряду с УЗИ применяют компьютерную и магнитно-резонансную томографию.
Диагностическая лапароскопия показана при невозможности дифференциальной диагностики между субсерозной миомой матки и опухолями брюшной полости и забрюшинного пространства неинвазивными методами.
Гистероскопия показана при появлении нарушений менструального цикла у пациенток с маткой, увеличенной не более чем на 12-13 нед беременности. При большем увеличении матки информативность гистероскопии снижается. Для исключения патологии эндометрия и слизистой оболочки цервикального канала у пациенток с метроррагиями и контактными кровяными выделениями независимо от величины миомы матки проводится раздельное диагностическое выскабливание слизистой оболочки матки.
Вопрос о целесообразности лечения при небольшой миоме матки без клинических проявлений окончательно не решен. Тем не менее таким пациенткам показано динамическое наблюдение у гинеколога с обязательным ультразвуковым контролем 1 раз в год. Больным дают рекомендации, направленные на профилактику дальнейшего роста миомы и регуляцию гипоталамо-гипофизарно-яичниковых взаимоотношений. Из рациона исключают избыток углеводов и жиров, ограничивают острые и соленые блюда. Пациенткам рекомендуют избегать тепловых процедур, им нельзя загорать на солнце и в искусственном солярии. Миома может увеличиться вследствие массажа и физиотерапии по поводу соматических заболеваний. С целью регуляции менструальной функции рекомендуется витаминотерапия по фазам менструального цикла (фолиевая кислота и витамины группы В в первую фазу и витамины С, Е и А - во вторую фазу) или использование гормональных контрацептивов. Предпочтительны монофазные эстраген-гестаген-ные препараты и низкодозированные гестагены.
Консервативная терапия миомы матки проводится с целью торможения роста или обратного развития опухоли, лечения менометроррагий и анемии. С этой целью назначают производные 19-норстероидов (норколут, примолют-нор, норэтистерон, оргаметрил, гестринон, неместран). Под действием этих препаратов миома и, соответственно, матка уменьшаются в среднем на 1 - 2 нед беременности; уменьшается кровопотеря при менструации и нормализуется уровень гемоглобина. В репродуктивном возрасте гестагены назначают циклически с 16-го по 25-й день менструального цикла или с 5-го по 25-й день в течение 6-24 мес. Как правило, клинический эффект удается получить при миоме, не превышающей 8 нед беременности. У пациенток перименопаузального возраста целесообразно использовать гестагены в непрерывном режиме 6 мес, тем самым способствуя медикаментозной атрофии эндометрия и наступлению менопаузы.
Антигонадотропины, имеющие стероидную структуру (даназол, гестринон), и агонисты гонадолиберинов (золадекс, диферелин, бусерелин и др.) влияют на рост миоматозных узлов. Под действием агонистов ГнЛГ возможно уменьшение объема миоматозных узлов до 55%. Однако после прекращения приема препарата и восстановления менструальной функции у 67% больных начинается экспансивный рост миомы с признаками нарушения питания. Использование агонистов ГнЛГ целесообразно у пациенток перименопаузального периода, поскольку обусловливает стойкую редукцию стероидогенеза и наступление менопаузы. Для создания медикаментозной менопаузы применяют также антигонадот-ропины (немистран, гестринон).
Агонисты ГнЛГ используют для предоперационной подготовки к консервативной миомэктомии. Под воздействием агонистов ГнЛГ структура миоматозного узла становится более плотной, снижается интранодулярный и перинодулярный кровоток. Снижение внут-риопухолевого кровотока, а также уменьшение миомы и плотности миометрия вокруг миоматозных узлов максимально выражены после 2-3 инъекций препарата. При более длительном курсе гормональной подготовки ввиду прогрессирующей редукции артериального кровотока возможны деструктивные и некробиотические процессы в миоматозных узлах, затрудняющие консервативную миомэктомию.
Агонисты ГнЛГ могут изменить топографию интерстициально-субмукозных узлов в сторону полости матки, а интерстициально-субсерозных узлов - в сторону брюшной полости.
Использование агонистов ГнЛГ позволяет облегчить проведение лапароскопической консервативной миомэктомии и гистерэктомии у 76% больных из-за уменьшения матки и миоматозных узлов. При всех консервативных миомэктомиях после гормональной подготовки кровопотеря уменьшается на 35-40%.
С целью предотвращения менометроррагий и роста миомы применяют внутриматочную гормональную систему «Мирена», содержащую капсулу с левоноргестрелом (гестаген). «Мирену» вводят сроком на 5 лет, она обеспечивает регулярное поступление левоноргестрела в полость матки и местное действие на эндометрий и миометрий с минимальными системными эффектами. Менструации становятся скудными, в ряде случаев наступает медикаментозная аменорея. Противопоказания для применения «Мирены»: субмукозные миоматозные узлы, большая полость матки, а также абсолютные показания к оперативному лечению.
Хирургическое лечение миомы матки остается ведущим, несмотря на достаточно результативные консервативные методы. Частота радикальных операций составляет 80%. Оперативные вмешательства по поводу миомы матки составляют 45% абдоминальных вмешательств в гинекологии.
Показания к хирургическому лечению больных миомой матки:
- • большие размеры миомы (13-14 недель беременности);
- • быстрый рост миомы (более 4 нед за год);
- • субмукозное расположение узла;
- • субсерозный узел 0 типа;
- • нарушение питания, некроз миоматозного узла;
- • шеечная миома;
- • миома матки и менометроррагии, анемизирующие больную;
- • рост миомы в постменопаузе;
- • нарушение функции соседних органов;
- • бесплодие и привычное невынашивание беременности.
Хирургическое лечение миомы матки может быть радикальным или функциональным (органосохраняющим). В настоящее время имеется тенденция к снижению числа радикальных оперативных вмешательств при миоме матки и расширению показаний к орга-носохраняющим операциям. Функциональная хирургия матки, помимо сохранения менструальной и репродуктивной функций, позволяет предотвратить нарушение деятельности тазовых органов и способствует профилактике их опущения.
Объем оперативного вмешательства зависит от различных факторов. Хирургическое лечение миомы матки считается радикальным при выполнении гистерэктомии и включает в себя экстирпацию матки или надвлагалищную ампутацию матки без придатков. Шейка матки играет важную роль в формировании тазового дна и кровоснабжении мочеполовой системы, поэтому объем оперативного вмешательства расширяется до экстирпации матки у женщин репродуктивного возраста при рецидивирующих фоновых процессах шейки матки, лейкоплакии с дисплазией многослойного плоского эпителия, а также при шеечном и перешеечном расположении миоматозного узла. У пациенток с впервые выявленным фоновым заболеванием шейки матки следует на первом этапе проводить консервативное лечение этой патологии, а на втором - выполнять надвлагалищную ампутацию матки.
Гистерэктомию можно провести абдоминальным, лапароскопическим и вагинальным доступами. Выбор хирургического доступа зависит от величины матки, размеров и локализации миоматозных узлов, а также от опыта и квалификации хирурга.
Функциональная хирургия миомы. Существуют методы оперативного вмешательства, позволяющие сохранить адекватное кровоснабжение яичников путем выделения восходящих ветвей маточных артерий и сохранить менструальную функцию при высокой надвлагалищной ампутации, а также дефундации матки.
Менструальную и репродуктивную функции при миоме матки может сохранить консервативная миомэктомия. Миомэктомия заключается в удалении миоматозных узлов и сохранении тела матки и может осуществляться лапаротомическим, лапароскопическим и гистероскопическим доступом.
Выбор хирургического доступа зависит от:
- • величины матки;
- • локализации миоматозных узлов;
- • числа и величины миоматозных узлов;
- • предоперационной гормональной подготовки;
- • оснащенности эндоскопическим оборудованием;
- • опыта хирурга в выполнении эндоскопических операций.
Лапаротомический доступ предпочтителен при множественных интерстициальных миоматозных узлах более 7-10 см, при низкой шеечно-перешечной локализации узлов, особенно по задней и боковой стенкам матки. Лапаротомический доступ позволяет адекватно сопоставить края ложа удаленного большого узла с наложением двурядных викриловых швов. От полноценности рубца на матке зависят течение планируемой беременности и ведение родов.
Лапароскопический доступ показан при субсерозных миоматозных узлах 0-3-го типов, а также при интерстициальных миоматозных узлах диаметром не более 4-5 см.
Отдельные субсерозные миоматозные узлы (0 тип) не представляют трудностей для эндоскопического удаления. Узел после фиксации зубчатыми щипцами отделяют от матки, коагулируя ножку, после чего пересекают ее ножницами или коагулятором. Современные марцеляторы позволяют извлекать из брюшной полости узлы различных размеров и массы, мелкие миоматозные узлы можно извлекать через мини-лапаротомное и кольпотомное отверстия.
Интерстициально-субсерозные миоматозные узлы удаляют путем декапсуляции и энуклеации с поэтапной коагуляцией кровоточащих сосудов ложа. При значительном размере остающегося после консервативной миомэктомии ложа наряду с электрохирургической коагуляцией накладывают эндоскопические двурядные швы. Ушивание ложа узла позволяет осуществить дополнительный гемостаз, способствует профилактике спаечного процесса в малом тазу и формирует полноценный рубец.
Интралигаментарные узлы удаляют после рассечения в поперечном или косом направлении переднего листка широкой маточной связки и энуклеации.
Особую сложность представляет удаление небольших интерстициальных миоматозных узлов. Располагаясь в толще миометрия, миоматозные узлы не деформируют наружных контуров матки, что затрудняет визуальную диагностику во время операции. Показанием для удаления миоматозных узлов в этих случаях является подготовка к беременности или к стимуляции функции яичников у женщин с бесплодием. Для точной топической диагностики проводят интраоперационное УЗИ с помощью вагинального, ректального и трансабдоминального датчиков. Это позволяет точно локализовать и удалять интерстициальные узлы диаметром от I до 3 см с минимальной травмой. После ультразвуковой локализации над местом расположения узла делают небольшой глубокий разрез, миоматозный узел захватывают зубчатыми щипцами или штопором. Питающие сосуды коагулируют после энуклеации узла.
Единого мнения о числе удаляемых миоматозных узлов не существует. Тактика врача зависит от цели - сохранения репродуктивной или менструальной функции. Важно, чтобы после консервативной миомэктомии можно было пролонгировать беременность.
Эндоскопическая миомэктомия позволяет сохранить менструальную функцию у всех оперированных больных и восстановить детородную функцию у каждой 3-й пациентки. Беременность можно планировать через 6 мес после операции. После удаления больших интерстициально-субсерозных миоматозных узлов, а также после удаления интерстициальных узлов предпочтительно родо-разрешение путем кесарева сечения.
При субмукозных миоматозных узлах возможна консервативная гистероскопическая миомэктомия механическим, электрохирургическим методом и при помощи лазера.
К консервативным хирургическим методам лечения миомы матки относят лапароскопический миолиз (вапоризация миоматозного узла при помощи лазера) и эмболизацию маточной артерии.
Эмболизация маточной артерии (ЭМА) проводится под рентгенологическим контролем путем катетеризации бедренной артерии и проведения эмболов к маточной артерии. Таким образом нарушается кровоснабжение и возникают дистрофические процессы в миоматозных узлах. Миоматозные узлы уменьшаются, предотвращается их дальнейший рост.
Прогноз. Миома матки относится к доброкачественным опухолям с редкой малигнизацией, поэтому прогноз для жизни благоприятный. Однако рост миомы может потребовать хирургического лечения с исключением менструальной и репродуктивной функций у молодых женщин. Даже небольшие миоматозные узлы могут обусловить первичное и вторичное бесплодие.
Профилактика миомы матки заключается в своевременном выявлении заболевания на ранних стадиях.
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Миомы матки, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Eurolab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Eurolab открыта для Вас круглосуточно.
Как обратиться в клинику: Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Eurolab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Если Вас интересуют еще какие-нибудь виды болезней и группы заболеваний человека или у Вас есть какие-либо другие вопросы и предложения – напишите нам, мы обязательно постараемся Вам помочь.www.eurolab.ua
Миома матки
Что такое миома матки?Миома матки — доброкачественная опухоль.По статистике 20% женщин старше 30 лет и более 40% женщин старше 40 лет имеют эту серьезную проблему. До недавнего времени эта опухоль встречалась у женщин в возрасте 30 — 40 лет. Но в последнее время миомы встречаются и у молодых (20 лет и моложе).Из 100% показаний к проведению хирургической операции в гинекологии 80% принадлежит миоме и ее осложнениям. Миома (лейомиома, фибромиома) образуется из мышечной и соединительной ткани матки. Единого мнения о причинах развития миомы матки в настоящее время нет. Причин несколько:гормональные нарушения,хронические инфекции,инфекции, передающиеся половым путемвнутриматочные контрацептивы,аборты,воспаления,нарушения иммунологической защиты,нарушение кровообращения органов малого таза,нарушения водно-солевого обмена.Так же известно о генетической предрасположенности к возникновению миомы. При несвоевременном лечении миома может переродиться в злокачественную опухоль.КлассификацияОбщепринята классификация миомы;1. По локализации:95% опухолей располагается в теле матки, 5% — в шейке матки.2. По отношению расположения миоматозного узла к мышечному слою матки:межмышечное (опухоль располагается в толще стенки матки),подслизистое (рост миомы происходит по направлению к полости матки),подбрюшинное (рост миомы происходит по направлению к брюшной полости),центрипетальный рост ( подслизистая опухоль располагается преимущественно в мышечном слое более чем на1/3 объема узла).Среди подслизистых узлов миомы различают «рождающие» опухоли, рост которых в полость матки происходит по направлению к внутреннему зеву. Длительное развитие рождающихся миоматозных узлов приводит расширению краев маточного зева и сопровождается выходом опухоли за пределы наружного отверстия матки.Как заподозрить миому?Клиническая картина при миоме матки разнообразна и зависит от возраста пациентки, длительности заболевания, локализации и величины опухоли и наличия сопутствующих патологических процессов. Достаточно часто миома матки протекает «бессимптомно» — т.е. отсутствуют жалобы и нарушения менструальной функции. Основными симптомами миомы матки являются:боль,кровотечение,нарушение функции соседних органов,рост опухоли.Боль, как правило, локализуется в нижних отделах живота и пояснице.Выраженные длительные боли связаны с быстрым ростом опухоли. Острые боли возникают, главным образом, при нарушениях кровоснабжения в опухоли, прогрессирование которых может привести к развитию клинической картины острого живота.Схваткообразные боли во время менструации могут свидетельствовать о подслизистом расположении узла. Обильные и длительные менструации, как правило, наблюдаются при подслизистой миоме, но могут быть и при другой локализации узлов, особенно в сочетании с эндометриозом тела матки. Возможно появление также и межменструальных кровотечений.
Насколько опасна миома?Осложнения:
кровотечение самое частое из осложнений миомы,нарушение функции соседних органов — возникает при больших размерах опухоли, а также при подбрюшинном,шеечном и межсвязочном расположении узлов,некроз миоматозного узла. При этом возникает боль, высокая температура, вплоть до развития клиники острого живота,перекрут узла, расположенного на ножке, анемия.Рост миомы, как правило, медленный. При быстром росте миомы размер матки увеличивается до размера, соответствующего 5-ти недельной беременности за год или меньший промежуток времени.Диагностика миомы матки.На ранних стадиях миома клинически не проявляется.Не нужно ждать появления клинических симптомов заболевания. Достаточно регулярно посещать гинеколога и проходитьдиспансерное обследование.Диагностический объем обследования:консультация и осмотр гинеколога, — УЗИ,эндоскопическое исследование,лабораторная диагностика,онкоцитологическое исследование.Ультразвуковое сканирование необходимо проводить женщинам моложе 30 лет из группы риска и всемженщинам старше 30 лет один раз в год с целью раннего выявления «молодых» миом — как более перспективныхдля консервативного лечения.При постановке диагноза и оценке эффективности лечения важно учитывать дни менструального цикла,осмотры и УЗ-сканирование проводить в динамике, в одни и те же дни цикла.По данным УЗИ можно достаточно точно установить локализацию, размеры миоматозных узлов, чтобыопределить тактику ведения больных и объем оперативного лечения женщин репродуктивного возраста.Лечение миомы маткиПоказания к хирургическому лечению миомы матки:
кровотечения, приводящие к анемии;быстрый рост опухоли,большие размеры миомы (более 15 нед. беременности) и симптомы нарушения функции смежных органов,подбрюшинный узел на ножке,подслизистая миома матки,шеечная миома матки,центрипетальный рост миоматозного узла,сочетание миомы матки с опухолью яичников, эндометриозом,бесплодие, обусловленное атипичным расположением узлов,некроз миоматозного узла,подозрение на малигнизацию (озлокачествление) миомы,сочетание миомы матки с предраковым состоянием шейки матки. Общепринятых показаний два: патологическая кровопотеря и быстрый рост опухоли. Хирургическое лечение:лапароскопическая миомэктомия,гистероскопическая миомэктомия,лапаротомия с миомэктомией,гистерэктомия (лапароскопическая и лапаротомическая).В настоящее время 90% всех гинекологических операций может выполняется лапароскопическим методомЛапароскопическая миомэктомия (удаление узлов при сохранении матки)Показания: субсерозно и интрамурально расположенные узлы диаметром свыше 2 см, узлы на ножке, отсутствие эффектаот консервативной терапии.Противопоказания: любые заболевания, при которых противопоказано повышение давления в брюшной полости, большетрех миоматозных узлов диаметром более 5 см.; размер матки более 16 недель беременности; миоматозный узел диаметромболее 15 см.Гистероскопическая миомэктомияПоказания: субмукозное (подслизистое) расположение узла.
Противопоказания: глубина полости матки более 12 см; подозрение на гиперплазию или аденокарциному эндометрия;инфекция верхних и нижних отделов гениталий; тяжелые заболевания печени, почек и сердца (риск гиперволемии);подозрение на лейомиосаркому (злокачественную опухоль).Лапаротомия с миомэктомией применяется как альтернатива лапароскопической методике, при отсутствии данногооборудования в клинике или соответствующих размерах и количестве миоматозных узлов. После консервативногооперативного вмешательства возможно возникновение новых миоматозных узлов.Гистерэктомия (удаление матки)Данная операция показана в случае если все выше перечисленные методы противопоказаны или оказались не эффективны. Удаление матки традиционно выполняется через большой разрез передней брюшной стенки. В последние годы получили распространение щадящий операции:• лапароскопическая гистерэктомия,• гистерэктомия влагалищным доступом.Консервативное лечение миомы матки заключается в торможении роста опухоли и назначении симптоматических препаратов для лечения осложнений.В профилактике миомы матки важную роль могут сыграть меры предупреждения повреждений миометрия в результате абортов и диагностических выскабливаний. Получены хорошие результаты предупреждения инфекционных заболеваний после выскабливаний матки путем назначения в пред- и послеоперационном периодах антибактериальных препаратов. Основным и наиболее важным является регулярное обращение к гинекологу для профилактики и своевременного обнаружения миомы матки.Что нужно знать женщине?Дорогие дамы!Не откладывайте визит к гинекологу.Своевременный осмотр позволит избежать серьезных осложнений.На базе 7 городской клинической больницы накоплен огромный опыт в лечении данной патологии.Врачи владеют всеми видами оперативных вмешательств.Преимущественно выполняются малотравматичные, высокотехнологические операции.Круглосуточно работает бригада эндоскопических хирургов.Возможны как плановые так и экстренные госпитализации.Московская прописка и полис ОМС не обязательны.Более подробную информацию Вы можете получить по телефону 118 — 51 — 83.Звоните.Не откладывайте свою проблему на завтра.Завтра может быть поздно!
Главная / Полезное / О беременности Клиники и роддома
- Родильный дом при ГКБ №29
- Роддом №3
- Перинатальный центр ГКБ №24
- Роддом №15
- Роддом №17
- Роддом г. Видное
www.polyclinic.moscow
Удаление миомы матки с сохранением матки
Во второй части статьи рассматриваются аспекты современного лечения миомы матки. Предложена новая, клиническая классификация этого заболевания, облегчающая выбор метода лечения. Изложен алгоритм комплексного консервативного лечения больных миомой матки, в котором обозначено место эмболизации маточных артерий. В статье описаны принципы профилактики миомы матки.
Можно ли вылечить миому матки?
С самого начала хотелось бы задаться вполне логичным вопросом – можно ли вообще вылечить миому матки. Очевидно, что однозначного ответа на этот вопрос нет. Можно излечить организм женщины от миомы матки, удалив матку – то есть решить вопрос радикально: нет органа – нет проблемы. Практически вся история этого вопроса состоит из разработки различных методов такого решения проблемы. При этом, парадоксально то, что история радикализма в лечении миомы матки до сих пор не окончена.
Удаление матки при миоме
Приверженцев удаления матки по поводу и без повода еще достаточно, и что самое страшное, это направление продолжает взращивать своих учеников, передавая им свои заблуждения, все сливки своего невежества и косности мировоззрения.
Основная причина столь длительного господства лечебного радикализма в лечении миомы матки в том, что уж слишком долго миома матки представлялась хоть и доброкачественным, но опухолевым процессом в гениталиях, а опухоль, как гласят каноны хирургии, должна быть удалена. Все-таки в сознании большинства практикующих врачей, со временем растерявших нюансы фундаментальных наук, доброкачественная характеристика образования воспринимается лишь как временное явление, как вовремя застигнутый этап, как удачный уход от злокачественного процесса наконец. Эйфория от удачного своевременного диагностирования доброкачественной опухоли вызывает стремление “закрепить” достигнутый результат, который выливается в “агрессивный” по отношению к опухоли и нерациональный по сути подход – удаление органа в котором эта опухоль выросла. Тут встает следующий вопрос – почему удаление матки длительное время, да и в настоящий момент, рассматривается как допустимый с точки зрения дальнейшей жизни женщины акт.
Очень тяжело сказать с какой точки зрения, существует перечень органов, без которых в целом может существовать человек. Так вот, в этом перечне матка стоит чуть ли не на первом месте. Почему-то считается, что, реализовав свою репродуктивную функцию, женщина совершенно безболезненно может расставаться с маткой, то есть к этому органу выработано своеобразное монофункциональное отношение. В то же время совершенно очевидно, что в организме нет лишних органов, и матка, помимо репродуктивной функции также несет и другие, большая часть которых нам до сих пор не известна. Будучи интегрированной в целостный организм, матка поддерживает естественное физиологическое равновесие, удаление же матки влечет за собой развитие так называемого постгистерэктомического синдрома, как отражение дезинтергации в организме. Человек может существовать без одной почки, легкого, части кишечника, но всем хорошо понятно, что это существование уже неполноценного человека, так почему женщина без матки в сознание ряда врачей воспринимается с позиции здорового организма.
Довольно часто в нашей практике нам приходится сталкиваться с желанием женщины во что бы то не стало сохранить матку. Желание это трудно объяснимо, и на прямые вопросы не все женщины способны дать четкий однозначный ответ. В целом все они сходятся на том, что наличие матки является подсознательным элементом их женственности, их причастности к женскому полу. Наличие матки дает женщине постоянную внутреннюю уверенность в том, что она может родить ребенка, и даже если она точно не желает больше иметь детей, безвозвратное лишение этой функции может быть для нее недопустимым.
Еще одной причиной, по которой женщина не хочет лишаться матки является боязнь в последствии столкнуться с проблемами в интимной жизни. Хорошо известно, что у части женщин в процессе оргазма происходит сокращение матки, что усиливает остроту переживаемых ощущений. Очевидно, что удаление матки, может изменить спектр сексуальных ощущений, что также очень пугает женщину.
В целом можно до бесконечности продолжать приводить доводы в пользу сохранения женщине матки, но хотелось бы высказать главную мысль – врач не в праве решать за пациентку какие органы ей нужны, а без каких она в принципе может обойтись, руководствуясь при этом лишь соображением собственной выгоды. Отсутствие у врача знаний обо всех имеющихся в настоящий момент методах лечения заболевания является его большим недостатком, от которого страдают его пациенты, сокрытие же или заведомо ложное информирование пациентки об альтернативных методах лечения скорее всего должно рассматриваться не иначе как преступление.
Таким образом, мы постарались максимально доступно донести главную мысль лечения больных миомой матки – лечение должно быть органосохраняющим. В настоящий момент в подавляющем числе случаев лечение миомы матки возможно осуществлять без полной потери органа.
Чем же должен определяться выбор метода лечения миомы матки? Ниже мы приведем несколько основных пунктов и далее рассмотрим их по отдельности:
1. Размеры узлов 2. Локализация 3. Возраст 4. Наличие симптомов 5. Репродуктивные планы 6. Наличие сопутствующих заболеваний 7. Благосостояние пациентки
8. Предпочтение того или иного вида лечения.
Как же лечить миому матки?
В лечении больных миомой матки должна существовать главная заповедь, которой необходимо строго придерживаться: каков бы не был размер обнаруженной миомы матки – необходимо принять меры, – нет выжидательной тактике! Из этого в частности следует, что даже крошечные миоматозные узлы, случайно выявленные во время ультразвукового исследования, должны рассматриваться в качестве терапевтической мишени. Предвидим сразу же возникший вопрос: “Зачем надо лечить маленькие миоматозные узлы, может быть они вообще никогда не вырастут, ну а если же вырастут, тогда и будем лечить” Мы согласны, не все миоматозные имеют тенденцию к росту. Часть узлов и в правду могут на протяжении всего репродуктивного периода сохранять изначально маленькие размеры, но часть узлов, длительное время пребывая в стабилизированном состоянии, под воздействием каких-то причин могут быстро увеличиться в размере. Приходится признать, что в настоящий момент мы не в силах предсказать, какой из узлов будет расти, а какой сохранит свои размеры, поэтому мы считаем неправомочным устраивать своего рода лотерею и гадать вырастет или не вырастет. Лечить заболевание на его ранней стадии гораздо легче, чем в запущенных случаях, поэтому мы рекомендуем с большим внимаем относиться к маленьким миоматозным узлам и в целом, рассматривать их обнаружение как диагностическую удачу, а не как ничего не значащую находку. Учитывая это, начнем рассматривать вопрос лечения миомы матки с маленьких узлов.
Крошечные, маленькие, средние, большие, огромные, гигантские… (вариант классификации миомы матки)
Не пытаясь ни в чем опровергать общепринятую классификацию миомы матки, с целью облегчения клинической практики мы предлагаем новую “примитивную-прикладную классификацию миомы матки”, с помощью которой достаточно легко определиться в выборе метода лечения этого заболевания. Как уже отмечалось выше даже самые маленькие миоматозные узлы не должны оставаться без внимания. В целом хорошо известно, что за исключением миоматозных узлов подслизистой локализации миоматозные узлы размером до 2-2,5 как правило не имеют никаких клинических проявлений, не нарушают репродуктивную функцию и поэтому в целом не имеют клинического значения. Здесь хотелось бы сразу же подчеркнуть, что мы рассматриваем в настоящий момент ситуации, при которой у женщины имеется только миома матки. Почему это важно? Достаточно часто, миома матки сочетается с таким заболеванием как аденомиоз. Нередко можно выявить мелкие миоматозные узлы на фоне аденомиоза 2-3 степени. В этом случае следует рассматривать аденомиоз как основное заболевание и в целом не придавать существенного значения мелким миоматозным узлам, поскольку клиническая картина в данном случае будет обусловлена аденомиозом.
Итак, вернемся к маленьким миоматозным узлам, которые изолированно обнаруживаются в миометрии. Беря во внимание отсутствие клинической значимости у миоматозных узлов, размер которых меньше 2 см, можно условно принять параметр за точку отсчета, то есть считать, что любой миоматозный узел, имеющий больший размер, должен быть либо уменьшен до этого размера, либо ликвидирован вовсе. Второй момент – любой миоматозный узел, размер которого меньше 2 см должен быть стабилизирован в своем размере.
Таким образом, у нас выделились первые две задачи: стабилизация “крошечных миоматозных узлов” (так мы обозначим узлы меньше 2 см) и уменьшение у размере “маленьких миоматозных узлов (критерии размеров этой категории узлов мы рассмотрим ниже).
Стабилизация “крошечных миоматозных узлов”
Такие миоматозные узлы чаще всего можно обнаружить у молодых женщин при проведении им ультразвукового исследования. Но что интересно, если бы начиная с периода окончания пубертатного периода большинство женщин принимало бы оральные контрацептивы, то к тридцати годам число женщин, страдающих миомой матки снизило бы как минимум на 31%. Эти данные основаны на большом исследовании, включавшем большую группу женщин. В частности в нем было показано, что длительный прием оральных контрацептивов снижает риск развития миомы матки. Так, при пятилетней продолжительности приема ОК риск развития миома матки снижается на 17%, а при десятилетней – на 31%. Более дифференцированное статистическое исследование, включавшее 843 женщины с миомой матки и 1557 женщин контрольной группы, выявило, что с увеличением продолжительности непрерывного приема ОК снижается риск развития миомы матки. Авторами было выдвинуто предположение, что механизм, посредством которого ОК препятствуют развитию миомы матки, вероятнее всего, связан с гестагенным компонентом.
Вид и количество гестагенного компонента ОК также имеет значение в комплексном влиянии контрацептива на риск развития миомы матки. Иммуногистохимические исследования одного из представителей третьего поколения гестагенов – дезогестрела выявили его способность оказывать блокирующее действие на рецепторы прогестерона, что вероятно и объясняет механизм, посредством которого ОК оказывают профилактический эффект, поскольку, как отмечалось выше, прогестерон является основным гормоном, стимулирующим рост миомы матки.
Прием оральных контрацептивов оказывает не только профилактическое действие. При наличии у женщины миомы матки, ОК способны стабилизировать размеры миоматозных узлов. Однако не во всех случаях рост миоматозных узлов эффективно стабилизуется приемом ОК. Как удалось выявить в результате наших исследований, стабилизирующий эффект ОК распространяется на миоматозные узлы размерами до 2 см в диаметре, назначение ОК при больших размерах узлов дает неоднозначный эффект – в ряде случаев размер узла стабилизируется, а в ряде случаев – наблюдается рост миомы. Судя по всему, это связано с тем, что в небольших миоматозных узлах еще не сформированы до конца основные автономные механизмы (локальная продукция эстрогенов, фиброз), в связи с чем рост такого узла управляем экзогенным воздействием гестагена ОК, более “слабого” по сравнению с другими препаратами, использующимися при медикаментозном лечении миомы матки.
В чем же все-таки принципиальный механизм терапевтического эффекта оральных контрацептивов на миому матки и возможности профилактики этого заболевания. В первой главе, касаясь этиологических теорий миомы матки мы говорили о том, что во второй фазе овуляторного менструального цикла под воздействием прогестерона, вырабатываемого желтым телом происходит активизация пролиферативных процессов в миометрии.
Регулярное воздействие на ткань миометрия сильного митогена в виде прогестерона является с одной стороны важным звеном в процессе формирования зачатка роста миоматозного узла, с другой стороны важным компонентом дальнейшего роста миомы, в особенности на ее начальных этапах (то есть до формирования “автономных механизмов”).
Как известно, во время приема оральных контрацептивов происходит подавление овуляторной функции яичников, то есть в частности выключается механизм образования желтого тела. Желтое тело является единственной железой, способной секретировать в большом количестве прогестерон. Таким образом, на весь срок отсутствия желтого тела в организме женщины не наблюдается высоких концентраций прогестерона, а присутствуют только незначительное количество этого гормона, синтезирующегося надпочечниками. Так как существование эндометрия крайне опасно без достаточного влияния прогестерона, в состав оральных контрацептивов включается компонент, который по своим рецепторным характеристикам схож с прогестероном, но не выполняет все его функции. Такие вещества называются прогестагенами. Так, в частности прогестагены третьего поколения не вызывают выраженных пролиферативных процессов в миометрии.
Что же получается? У женщины, принимающей оральные контрацептивы не происходит овуляции, значит не образуется желтое тело, секретирующее прогестерон, значит в конечном итоге прекращается ежемесячной запуск пролиферативных процессов в миометрии, блокирующийся отсутствием беременности и началом менструального периода. В том случае, если в матке женщины до начала приема оральных контрацептивов отсутствовали миоматозные узлы, то в процессе использования этих препаратов будет существенно ингибирован один из важнейших стимулов образования миомы матки. Кроме этого, при правильном использовании оральных контрацептивов женщина гарантировано не будет сталкиваться с такими явлением как аборт. Значит снимается еще один патогенетический фактор. Однако прием оральных контрацептивов не в 100% случаев позволяет избежать развития миомы матки. Это можно объяснить тем, что женщины, использующие оральные контрацептивы, решая проблему нежелательной беременности подчас забывают, что следствием полового акта может быть и заражение инфекциями, передающимися половым путем. Таким образом, прием оральных контрацептивов снимая два существенных патогенетичеких фактора развития миомы матки, не решает проблему до конца, поскольку не может нивелировать эффекты, обусловленные воспалительными заболеваниями женских половых органов. Нам часто приходилось наблюдать, как длительное время стабилизированные приемом оральных контрацептивов или использованием внутриматочной гормональной системы “Мирена” (о ней речь пойдет ниже) миоматозные узлы, начинали расти на фоне развития у женщины воспалительных заболеваний половых органов. И что интересно, после антибактериальной терапии размеры узлов возвращались к исходным и в дальнейшем тенденции к росту не отмечалось.
Однако не только выключение циклических процессов обусловливает представленные эффекты оральных контрацептивов. Немаловажное значение имеет также вид прогестина, входящего в состав применяющихся препаратов. Известно, что все прогестины способны в той или иной степени связываться с рецепторами прогестерона, но в то же время между ними существует целый ряд различий, одним из которых является аффинитет к рецепторам прогестерона. Эффективность механизма конкурентного ингибирования рецепторов во многом зависит от аффинитета конкурирующего вещества к рецептору, за который осуществляется конкуренция.
Следовательно, чем выше у конкурирующего вещества аффинитет, тем более выражены будут его конкурентные способности. Безусловно, не последнее значение в этом процессе играет и концентрация конкурирующих веществ.
Учитывая выше сказанное в своей практике мы используем оральные контрацептивы, содержащие дезогестрел. Этот прогестин третьего поколения имеет выраженный аффинитет к рецепторам прогестерона и способен конкурентно ингибировать рецепторы прогестерона в матке. То есть, связываясь с рецепторами прогестерона, он не дает эндогенному прогестерону реализовать свои эффекты на ткань. Сам же дезогестрел, связавшись с рецептором, не вызывает в полной мере весь спектр эффектов прогестерона.
Таким образом, оральные контрацептивы, содержащие в частности дезогестрел, способны оказывать угнетающее воздействие на два вероятных звена патогенеза миомы матки и тем самым стабилизировать размеры миоматозных узлов, чей размер не превышает 2 см. При этом хотелось бы отметить, что говоря о стабилизации размеров миоматозных узлов мы также имеем в виду и зачатки роста миомы, которые на фоне приема оральных контрацептивов не развиваются в определяемые даже на при помощи ультразвукового исследования образования.
Помимо оральных контрацептивов стабилизирующим эффектом на маленькие миоматозные узлы также обладает внутриматочная гормональная релизинг-система “Мирена”. Мирена может быть альтернативой оральным контрацептивам особенно в тех случаях, когда женщин не настроена в течение длительного времени принимать таблетки. Как показали наши исследования, Мирена эффективно стабилизирует размер маленьких миоматозных узлов до 2-2,5см в течение 4 лет. У нас нет данных, свидетельствующих о способности Мирены оказывать профилактическое воздействие на развитие миомы матки, собственно в этом есть одно из отличий Мирены от оральных контрацептивов. В то же время отсутствие таких данных вполне объяснимо, поскольку оральные контрацептивы можно начинать принимать с раннего репродуктивного возраста и нерожавшим женщинам, а внутриматочные спирали все-таки больше показаны женщинам, перенесшим хотя бы одну лучше завершившуюся родами беременность.
Таким образом, единственным средством, способным в настоящий момент обеспечить профилактику развития миомы матки являются оральные контрацептивы. В случае же образования маленьких миоматозных узлов, до 2 см, стабилизировать их рост возможно используя как оральные контрацептивы, так и внутриматочную релизинг-систему “Мирена”.
Подведем промежуточный итог: миоматозные узлы до 2 см в диаметре не должны оставаться без внимания, ждать пока они вырастут и дадут клиническую картину – преступно. Основная задача – стабилизировать размер этих узлов на максимально длительный срок. С этой целью могут быть использованы оральные контрацептивы и внутриматочная гормональная релизинг-система “Мирена”. В целом выбор того или иного средства определяется предпочтением женщины, однако, внутриматочную систему желательно устанавливать рожавшим женщинам.
Средние миоматозные узлы
К этой категории мы относим миоматозные узлы от 2,5 до 4 см. Чем же обусловлены такие критерии? Миоматозные узлы из этой группы уже могут проявляться клиническими симптомами чаще всего в виде менометроррагий. Для лечения таких узлов используются медикаментозные препараты, которые способны уменьшить размеры миом и нивелировать симптомы (если они есть). Учитывая именно эффективность медикаментозного лечения в отношении миоматозных узлов различного размера нами был установлен критерий включения миом в данную группу.
Как показывают результаты большинства исследований медикаментозные препараты, а речь идет об наиболее эффективной и часто используемой в аспекте данной проблемы группе – агонистах ГнРГ, способны уменьшить размеры миоматозных узлов в среднем на 50-60%. Мы договорились, что клинически незначимым размером для миомы матки является 2 см это значит, что миоматозные узлы размером 4 см и меньше возможно уменьшить до клинически незначимого уровня. Узлы большего размера при своем максимальном уменьшении не смогут достигнуть клинически незначимого уровня, что делает назначение агонистов ГнРГ не оправданным.
Совершенно очевидно, что приведенные размеры имеют приблизительное значение. Многое определяется расположением узлов, их количеством и наличием клинической симптоматики. Так субсерозное расположение узла допускает использование медикаментозного лечения при больших размерах, как и интрамурально-субсерозное. Для узлов с центрипетальным ростом, наоборот, четырехсантиметровый предел в ряде случаев может быть опущен до 3-3,5 см. Наличие выраженной менометроррагии также потребует опустить порог, при котором возможно назначение медикаментозной терапии.
Отдельно надо рассматривать миоматозные узлы подслизистой локализации. В отношении их, как правило, прибегают к хирургическому лечению или эмболизации маточных артерий. В связи с этим, мы не будем рассматривать их в рамках этого повествования, а вернемся к ним позже, когда речь пойдет об указанных выше методах лечения. В том случае, если данная категория миоматозных узлов выявляется у женщины, которая собирается беременеть, то здесь необходим индивидуальный подход.
Большое значение играет локализация узла или узлов. Итак, основной целью медикаментозной терапии, которая, подчеркнем, должна использоваться в изолированном виде (а не в качестве предоперационной подготовки) только для этой категории миоматозных узлов, является максимальное уменьшение размеров миомы до клинически незначимых. Для чего это делается? Нет, возразим Вашему скоропалительному ответу, не для того чтобы произвести хирургическую операцию, а для того чтобы в последующим удержать эти узлы в тех, клинически незначимых размерах, до которых они уменьшатся в процессе медикаментозного лечения. Для стабилизации достигнутых результатов существует так называемый второй этап комплексного консервативного лечения миомы матки.
К препаратам, уменьшающим размеры миоматозных узлов и, следовательно, использующимися на первом этапе комплексного лечения относятся: агонисты ГнРГ, антагонисты рецепторов прогестерона, антагонисты ГнРГ, блокаторы ароматазы, интерфероны, антифибротики. Большая часть из представленных препаратов находится на стадии клинических испытаний. Наиболее широко в клинической практике используются агонисты ГнРГ.
К другим препаратам, с помощью которых возможно уменьшить размеры миоматозных узлов, относятся: – даназол – мифепристон – интерферон альфа и бета – селективные блокаторы ароматазы
– пирфенидон
Смысл второго этапа комплексного консервативного лечения больных миомой матки заключается в удержании результатов достигнутых первым этапом лечения. Другими словами достигается стабилизация размеров миоматозных узлов и предотвращение рецидивирования симптоматики.
После отмены препаратов, использующихся на первом этапе лечения, с большой вероятностью рано или поздно происходит рецидив роста миоматозных узлов. Предотвратить такое развитие событий можно.
Рассматривая вопрос о лечении “крошечных” миоматозных узлов мы описывали как низкодозированные оральные контрацептивы и внутриматочная релизинг-система Мирена оказывают стабилизирующий эффект. Таким же образом эти препараты оказывают стабилизирующее воздействие на миоматозные узлы после терапии индукторами регрессии.
Таким образом, первый этап необходим для того, чтобы размеры миом соответствовали тем размерам, которые стабилизируются низкодозированными комбинированными оральными контрацептивами или Миреной.
Препараты, использующиеся на втором этапе лечения, назначаются после первой менструации, прошедшей с момента окончания первого этапа лечения. Оральные контрацептивы принимаются с 5-го дня цикла, а Мирена вводится с 3-го по 7-й день.
Лечение больших миоматозных узлов
Как уже отмечалось выше, большими миоматозными узлами мы называем те узлы, размер которых превышает 4 см. Сразу же стоит оговориться, что речь здесь пойдет об узлах, расположенных интрамурально, интрамуральносубсерозных и интремуральных узлах с центрипетальным ростом. Узлы “на ножке” и субмукозные узлы мы рассмотрим ниже.
Очевидно, что в подавляющем большинстве случаев миоматозных узлов в матке бывает больше одного, тогда возникает логичный вопрос – как относиться к больной, у которой один узел размером 2 см, а другой 5 см – это больная с большим миоматозным узлом или с маленьким. Существует такое понятие – “доминантный узел” – им обычно называют самый большой миоматозный узел в матке, и именно он определяет отношение к лечению больной.
Большие миоматозные узлы, как правило, увеличивают матку до существенных размеров, что позволяет определять их даже при бимануальном исследовании. В связи с тем, что до появления УЗИ в рутинной практике миома матки определялась преимущественно на этой стадии своего развития, требовавшем, как тогда считалось, исключительно хирургического подхода в виде удаления матки, эта операция является одной из самых “отработанных” оперативных вмешательств в гинекологии.
Не секрет, что гистерэктомию называют “студенческой операцией”, вкладывая в это название две мысли: эта одна из самых простых операций и ее должны уметь делать все гинекологии. Спорить с этим трудно, техническое исполнение ампутации матки не требует выдающихся хирургических навыков, да и необходимость в рутинном обучении гинеколога обусловлена тем, что гистерэктомия при наличии профузного маточного кровотечения является единственным вариантом спасения больной. Существует также негласный лозунг – “лучше жить без матки, чем умереть с маткой”.
Итак, гистерэктомия – легкий путь к решению многих гинекологических проблем – напомним еще раз – “нет органа нет проблемы”. С использованием такого подхода можно очень эффективно и окончательно вылечить больную миомой матки на любой стадии развития заболевания.
Можно ли полностью обойтись без гистерэктомии в лечении больных миомой матки? В настоящий момент нет. Удалять матку в ряде случаев все равно необходимо. Ниже мы рассмотрим именно те ситуации, при которых, несмотря не на что, все-таки приходится расставаться с органом.
Ситуация 1: у больной помимо миомы матки есть сопутствующие заболевания половых органов.
Аденоматоз эндометрия или аденоматозные полипы, при этом надо оговориться, что речь идет об аденоматозе тяжелой степени, в более легких проявлениях аденоматоза возможно проведение курса лечения, скажем, депо-провера (6 инъекций с промежутком в 3 недели) и после получения положительного результата провести органосохраняющее лечение.
Рак эндометрия – в этой ситуации искать альтернативы не приходится, миома матки в целом может вообще не рассматриваться как патология, произведение гистерэктомии здесь производится по витальным показаниям.
Злокачественные опухоли яичников (первичные и вторичные) – тут стоит оговориться, что при наличии доброкачественных опухолей нет абсолютных показаний к ампутации матки, тут целесообразнее всего произвести комбинированное хирургическое лечение – удалить опухоль и заодно выполнить консервативную миомэктомию. В связи с этим не стоит пренебрегать обязательным интраоперационным цитологическим исследованием материала – выявленная доброкачественность процесса позволит сохранить женщине матку.
Злокачественное поражение шейки матки или предраковый процесс в ней – как и в предыдущем случае необходимо признать, что в данной ситуации лечение шейки потребует экстирпации матки.
Миома матки гигантских размеров – сразу же возникает вопрос – что считать критерием “гигантскости”? Однозначно ответить сложно, эта оценка все-таки слишком субъективная. Мы попробуем описать наши субъективные критерии. Миома матки гигантских размеров – такая миома должна быть обязательно множественной, то есть узлов в матке столько, что даже невозможно найти островки здорового миометрия, узлы различного размера и локализации, эндометрий не визуализируется и полость деформирована. Такая матка обычно бывает эквивалентна размеру матки после 25 недели беременности, хотя чаще размер может быть и больше. На ощупь узлы “каменные”, при допплеровском исследовании кровоток в них не определяется или незначителен. Вот такие миомы матки мы называем “гигантскими”. Обозначив критерии гигантских миом, нам хотелось бы сразу обозначить какие миомы не стоит называть гигантскими, хотя на первый взгляд они могут показаться таковыми. Бывают случаи, когда в матке есть несколько очень больших миоматозных узлов, скажем 13 см, 8 см и 7 см и кроме них еще несколько небольших, большие узлы, как правило располагаются субсерозно или интрамурально-субсерозно. При этом в матке хорошо визуализируется ткань здорового миометрия.
Бимануальное исследование оценит эту матку эквивалентной 25 неделям беременности, но эта миома уже не должна расцениваться как гигантская. В данном случае произведенная консервативная миомэктомия с успехом сохранит женщине матку и речи о проведении гистерэктомии вести даже не стоит. Используя приведенные выше абсолютные показания к проведению гистерэктомии, вы обнаружите, что женщин, подходящих по данным критериям крайне мало, можно сказать единицы. В нашем отделении, профилированном как центр диагностики и лечения миомы матки, ампутация матки выполняется не чаще трех-четырех раз в год, во всех же остальных случаях нам удается избегать радикальных операций.
Как же обходиться без гистерэктомии в лечении больных миомой матки?
Консервативная миомэктомия
В качестве эпиграфа нам бы хотелось предложить высказывание С.Б. Голубчина: “Сохранить орган, или часть его, – благородная задача хирурга. Полное удаление органов, имеющих функциональное значение и играющих определенную роль в балансе организма, – калечащая, уродующая операция “
Немного этимологии, слово “консервативная” происходит от латинского глагола concervо, означающего “сохранять”. Собственно в этом слове и заключен весь смысл методики.
Можно сказать, что в настоящий момент консервативная миомэктомия преимущественно выполняется молодым, нерожавшим женщинам, но тоже не всем. Ниже мы приведем основные показания к проведению консервативной миомэктомии:
1. молодые нерожавшие женщины (или планирующие беременность) с одним или несколькими большими (или одним большим) миоматозными узлами межмышечной или межмышечно-подбрюшинной локализации.
Комментарии:
а) наличие множества средних узлов указанной локализации могут заставить делать выбор между проведением консервативной миомэктомии и эмболизации маточных артерий. б) наличие “неудачно” расположенных миоматозных узлов, в значительной степени повышающих шанс интраоперационного расширения объема хирургического вмешательства до радикальной операции, заставляет склоняться к проведению эмболизации маточных артерий
2. женщины любого возраста с наличием подбрюшинного миоматозного узла на тонком основании
3. наличие противопоказаний к проведению эмболизации маточных артерий
Известно, что виртуозные гинекологи выполняют консервативную миомэктомию практически при любом количестве и локализации миоматозных узлов, создавая при этом полноценную матку в анатомическом и функциональном смысле. Однако появление методикиэмболизации маточных артерий, о которой речь пойдет ниже, позволило существенным образом сократить показания к данной операции, до тех, что перечислены выше, которые в целом вполне очевидны.
Хорошие результаты консервативной миомэктомии безусловно в наибольшей степени зависят от квалификации хирурга, однако не меньшее значение имеет и правильное ведение больных в послеоперационном периоде.
Раньше частота осложнений после консервативной миомэктомии была достаточно высокой. Чаще всего развивались гнойно-септические состояния и последствия большой интраоперационной кровопотери или кровотечения в раннем послеоперационном периоде.
Большой объем кровопотери во время проведения консервативной миомэктомии нередко встречается и в настоящее время. Это осложнение очень трудно преодолеть в особенности если в матке находится множество узлов, часть из которых имеет хорошее кровоснабжение. Несмотря на то, что существуют давно известные рекомендации, касающиеся нюансов проведения разрезов для вылущивания узлов, не во всех случаях удается предотвратить кровопотерю. Объективно говоря, кровопотеря, в том случае если ее объем оценен достаточно точно, не представляет существенной угрозы для жизни пациентки. Своевременно проведенная гемотрансфузия обычно нивелирует это осложнение.
Профилактикой кровотечения в раннем послеоперационном периоде является тщательное наложение швов на матку. Важно помнить, что избыточное затягивание лигатур может повлечь за собой развитие некроза миометрия, однако их недостаточное затягивание чревато кровотечением или формированием межмышечных гематом.
Более грозным осложнением после консервативной миомэктомии является гнойно-септические состояния. С целью профилактики этого осложнения очень важно использовать в послеоперационном периоде качественные антибактериальные препараты широкого спектра действия. В нашей практике мы используем внутримышечное введение цефтриаксона (Роцефин) в дозе 500 мг в течение 5 дней. Использование такого подхода позволило свести процент гнойно-септических осложнений к минимуму.
Одним из наиболее дискутабельных вопросов в отношении консервативной миомэктомии является вопрос о выборе доступа. Как известно, консервативная миомэктомия выполняется как лапоротомическим так и лапороскопическим доступом.
Разработка методики лапароскопической миомэктомии вызвала большой интерес со стороны гинекологов всего мира и сразу же сформировала целую армию апологетов этого метода. К известным преимуществам лапороскопического доступа в брюшную полость относятся: отсутствие разреза передней брюшной стенки, меньший объем кровопотери, более низкая частота развития спаечного процесса и короткий период реабилитации. Все эти преимущества бесспорны, особенно когда речь идет о вмешательствах на придатках матки и при удалении миоматозных узлов, расположенных подбрюшинно. Пусть наше мнение на первый взгляд окажется несколько консервативным, мы настаиваем на том, что миомэктомия должна выполняться исключительно лапаротомическим доступом, и ниже мы постараемся это обосновать.
Консервативная миомэктомия относится к категории пластических операций. Не секрет, что до сих пор все пластические операции выполняются исключительно руками хирурга, то есть без посредников в виде лапароскопического инструментария. Сам смысл пластической операции – ручная работа. То, как может сшить матку руками квалифицированный хирург, никогда не сравнится с “суррогатными” приемами инструментального метода. Лапароскопист не может чувствовать ткань и орган в целом. Манипулятором не возможно “промять” матку и обнаружить мельчайшие миоматозные узлы, без удаления которых операция будет неполноценной. Хорошо известно, что в исходе консервативной миомэктомии необходимо сформировать анатомически правильную матку, способную выполнять все свои функции, включаю детородную, – качественнее всего это можно выполнить только руками.
Не менее интересны и данные статистики. Оказывается, что частота рецидивов после лапароскопической миомэктомии выше, чем после операций, выполненных лапаротомным доступом. Это очень легко объяснимо – при лапароскопическом доступе не удается удалить все миоматозные узлы, так как пальпация матки затруднительна, а самая качественная УЗ-диагностика не позволяет выявить все миомы в матке, так что удаляются лишь те узлы, которые удалось обнаружить. Именно это и приводит к более частым рецидивам после лапороскопической миомэктомии.
Настаивая на преимущественном проведении лапороскопических миомэктомии, многие авторы апеллируют к тому, что использование такого подхода позволяет уменьшить выраженность спаечного процесса, который, как известно, может стать причиной трубного бесплодия. Однако согласно статистическим данным, выраженность спаечного процесса после проведения лапоротомической миомэктомии не намного выше, чем при использовании лапороскопического доступа. Так же хотелось бы подчеркнуть, что развитие спаечного процесса и его выраженность зависят не только и не столько от доступа, но и от, так называемой “спаечной готовности” организма, а так же квалифицированности или “аккуратности” хирурга.
Важно осознавать, что консервативная миомэктомия не является самодостаточным методом. Ограничившись только хирургическим вмешательством можно с уверенностью перечеркнуть все достигнутые результаты, поскольку хорошо известно, что в течение последующих 5 лет часто происходит рецидивирование процесса. С патоморфологической точки зрения это вполне объяснимо. Как мы описывали в первой главе, одним из наиболее сильных триггеров развития миомы матки является повреждение ткани миометрия, особенно если оно сочетается с воспалительным процессом и эндометриозом. Во время проведения консервативной миомэктомии имеет место все три перечисленных фактора. Таким образом, удаляя все определяемые миоматозные узлы из матки, мы параллельно “растревоживаем” зачатки роста новых миоматозных узлов. Одним из отражений этого процесса является очень характерная картина матки, в которой произошел рецидив роста миоматозных узлов после консервативной миомэктомии. Такая матка обычно нафарширована множеством мелких узелков, расположенных преимущественно по периферии передней и задней стенок. Такую матку практически невозможно спутать с неоперированной, на столько характерен ее вид при УЗ-исследовании. Повторное проведение консервативной миомэктомии в данном случае будет совершенно неоправданно, поскольку будет технически затруднительным, да и в целом мало эффективным. Что интересно, хотя миоматозные узелки в данном случае могут иметь небольшой размер, но их множественность обусловливает низкую эффективность двухэтапной схемы лечения средних миоматозных узлов, которая была описана выше.
Как же предотвратить рецидивирование роста миоматозных узлов после проведенной консервативной миомэктомии? После удаления всех видимых невооруженным глазом миоматозных узлов, в матке все равно остаются зачатки роста или крошечные узелки, увеличение в размерах которых может активизироваться вследствие операционной травмы. Учитывая тот факт, что эффективность агонистов ГнРГ тем выше, чем меньше размер миом, с целью подавления оставшихся зачатков роста и предотвращения развития новых миоматозных узлов мы назначали пациенткам, перенесшим консервативную миомэктомию 6 месячный курс терапии агонистами ГнРГ. По окончании курса лечения агонистами, тем женщинам, которые не планировали в ближайшее время беременность мы рекомендовали прием монофазных микродозированных оральных контацептивов либо до беременности, либо до периода менопаузы. Тем же, которые планировали беременность, после окончания курса лечения агонистами мы обычно проверяли проходимость маточных труб и в случае отсутствия патологии рекомендовали реализовывать репродуктивные планы.
Назначение монофазных комбинированных микродозированных оральных контрацептивов после курса терапии агонистами подробно аргументировалось выше, когда мы рассматривали лечение средних миоматозных узлов.
Использование такой схемы ведение больных после консервативной миомэктомии позволило свести процент рецидивов после данной операции до 1%, при сроке наблюдения 6 лет.
Подавляющее большинство отечественных и зарубежных авторов рекомендуют использовать агонисты ГнРГ перед проведением консервативной миомэктомии, апеллируют к тому, что это позволяет снизить объем интраоперационной кровопотерии и, что странно, облегчить вылущивание узлов из матки. В нашей практике мы многократно убеждались в том, что миомы, подвергшиеся воздействию агонистов “вмуровываются” в миометрий, что наоборот, существенным образом затрудняет их вылущивание. С нашей точки зрения, назначение агонистов ГнРГ до операции совершенно напрасно, нецелесообразно и даже вредно. Назначение агонистов обосновано и целесообразно после проведенного хирургического лечения, но не до.
Нам удалось найти данные одного рандомизированного исследования, в котором убедительно было показано, что использование агонистов ГнРГ до консервативной миомэктомии повышает риск развития рецидивов. Это объясняется тем, что за время терапии агонитсами размер маленьких миоматозных узлов становится еще меньше, и во время операции их уже просто невозможно обнаружить и соответственно удалить.
Эмболизация миомы матки
Эмболизация сосудов различных органов и образований используется в медицине уже 20 лет. Основным показанием для проведения эмболизации является сильное кровотечение, которое не удается остановить консервативными средствами, при этом альтернативой им выступает хирургическое вмешательство. Эмболизация также широко применяется в лечении гиперваскуляризированных опухолей, где ее роль заключается в уменьшении объема и кровенаполнения опухоли перед операцией. Также с использованием метода эмболизации эффективно поддаются лечению артериовенозные мальформации и фистулы.
Эмболизация маточных артерий производится с 1979 года. Она использовалась в качестве средства остановки обильных послеродовых кровотечений, кровотечений, развившихся после хирургических операций, при артериовенозных мальформациях и внематочной беременности, а также при кровотечениях, обусловленных злокачественными поражениями гениталий.
В 1990г Jacques Ravina, во Франции применяя эмболизацию маточных артерий у больныхмиомой матки в качестве подготовительного этапа перед гистерэктомией, отметил, что у некоторых пациенток после эмболизации проходили беспокоившие их симптомы, и исчезала необходимость в самой операции. Позже он предложил использовать эмболизацию маточных артерий в качестве самостоятельного метода лечения.
В сентябре 1995 году в журнале The Lancet размещается первая публикация Jacques Ravina о лечении больных миомой матки с использованием эмболизации маточных артерий. Именно с этого момента берет начало история этого метода, и именно Jacques Ravina признается его основателем.
Показания и противопоказания для проведения эмболизации маточных артерий
По сути, эмболизацию маточных артерий можно производить при любых размерах миоматозных узлов, однако, в процессе ее использования постепенно выделились основные показания и противопоказания к проведению этой процедуры.
Абсолютным противопоказанием для проведения эмболизации маточных артерийявляется наличие злокачественных или предраковых состояний гениталий. К другим противопоказаниям к проведению эмболизации маточных артерий относят тяжелую почечную недостаточность, воспалительный процесс в органах малого таза, венозно-артериальную мальформацию, васкулиты, аллергию на контрастное вещество и неуправляемые коагулопатии.
За исключением описанных выше противопоказаний эмболизацию маточных артерийможно производить при любом размере узлов. С такого утверждения собственно и начиналась история этого метода. Однако сейчас уже можно задаться несколько другим вопросом: в какой ситуации эмболизация маточных артерий будет наиболее оптимальной.
Жак Равина, являющийся основателем описываемой методики в последнее время пришел к выводу, что эмболизация маточных артерий проявляет свою максимальную эффективность в том случае, если размер наибольшего из миоматозных узлов не превышает 6 см. Здесь надо оговориться, что речь идет о межмышечных и межмышечно-подбрюшинных узлах, поскольку в отношении подслизистых узлов этот предел не действителен, – Жак Анри Равина его не исследовал.
Говоря о предельном в отношении эффективности размере миоматозного узла, Равина исходил из данных, свидетельствующих о том, что максимальная редукция узла после эмболизации, составляющая 75%, наблюдается только при первоначальном размере узла, не превышающем 6 см. Большие по размеру узлы уменьшаются не так значительно. Так, к примеру, 10-ти сантиметровый узел сможет уменьшиться только до 5 см. В то же время в ряде случаев и такого эффекта бывает достаточно, особенно если женщина находится в пременопаузе.
Хотя в мировой литературе описаны случаи проведения эмболизации маточных артерийпри размере маток, соответствующих 36 неделям беременности, в нашей практике наибольшей размер матки соответствовал 27 неделям беременности. Эмболизация прошла успешно, и результатом пациентка осталось довольна.
Объективно говоря, решаться на проведение эмболизации маточных артерий при гигантских размерах мимы матки стоит только при очень сильном желании пациентки. Уговаривать в таких ситуациях никого не стоит.
Эмболизацию маточных артерий можно производить и при наличии средних миоматозных узлов, то есть размер которых меньше 4-х см. Эффект от эмболизации в данном случае будет очень хорошим, возможно даже полное исчезновения миоматозных узлов.
Предложить провести эмболизацию маточных артерий пациенткам со средними размера узлов можно в качестве альтернативы двухэтапному лечению с использованием агонистов ГнРГ и последующим длительным приемом контрацептивов или Мирены. Некоторые женщины, желающие фактически за один день “расправиться” со своим заболеванием могут отдать предпочтение эмболизации. Для них может быть неприемлемым столь длительный и от части неудобный путь, связанный с приемом таблеток, уколами и постоянными контролями за состоянием их узлов.
Еще одним вопросом, касающимся возможности проведения эмболизации маточных артерий, является аденомиоз – состояние очень часто сопутствующее миоме матки.
В целом ряде публикаций, посвященных эмболизации маточных артерий, указывается на то, что аденомиоз является тем фактором, вследствие которого данная методика может оказаться неэффективной. В тоже время существуют и другие публикации, в которых описывается высокая эффективность эмболизации маточных артерий в отношенииаденомиоза. В нашей практике нам приходилось проводить эмболизацию 5 женщинам с диффузной формой аденомиоза и во всех случаях эффект был удовлетворительным – матка уменьшалась в размере, исчезала неоднородность эхоструктуры миометрия, нормализовывалась менструальная функция и исчезали боли.
С патоморфологической точки зрения при аденомиозе в отличие от миомы матки имеется другая ангиоархитектоника сосудов и происходит диффузное поражение мышцы матки. Можно даже сказать, что, производя эмболизацию при аденомиозе, мы ишемизируем железистую ткань, а не узлы с порочно сформированным кровоснабжением. Подтверждением тому ангиоргафическая картинка, которую мы видели на экране у больных с аденомиозом. При этом в матке нет длинных извитых сосудов, идущих по периферии узлов, от которых отходят россыпью веточки в толщу миом. При аденомиозе визуализируется только диффузная капиллярная сеть. В тоже время после введения эмболизата вся эта сосудистая сеть исчезает, и матка выглядит обескровленной. Надо отметить, что для эмболизации аденомиоза предпочтительнее использовать малые фракции эмболизата (355-500 микрон).
Хотя данные об эффективности эмболизации маточных артерий в отношении аденомиоза еще очень ограничены, мы используем, и будем продолжать использовать эту методику у данной категории больных, поскольку альтернативой в лечении диффузной формы аденомиоза III стадии является гистерэктомия, которую всегда можно успеть выполнить.
Таким образом, преимуществами эмболизации маточных артерий перед другими методами лечения миомы матки являются:
• Органосохраняющее вмешательство; • Воздействие на все узлы при множественном поражении; • Малая травматичность; • Отсутствие кровопотери; • Эффективно в отношении симптомов миомы в 85-96% случаев; • Отсутствие роста и рецидивов в отдаленном периоде; • Хороший косметический эффект; • Короткие сроки реабилитации;
• Отсутствие общего наркоза
В целом эмболизация маточных артерий является миниинвазивным методом безрецидивного лечения миомы матки. Отсутствие необходимости в пред- и постпроцедурном дополнительном лечении характеризует этот метод как самодостаточный.Эмболизация маточных артерий, по сути, в подавляющем большинстве случаев решает проблему миомы матки за один день при минимальном дискомфорте для пациентки. Кроме этого, уже сейчас можно «осторожно» говорить, что проведение эмболизации маточных артерий не лишает женщину фертильной функции.
Подслизистые и шеечные миоматозные узлы
До недавнего времени наличие подслизистого миоматозного узла являлось абсолютным показанием к проведению ампутации матки. В последние годы, лечение субмукозных миомстало возможным с применением гистерорезектоскопии. Этот метод достаточно эффективен, но и у него есть целый ряд ограничений. К примеру, использовать этот метод возможно только в тех случаях, когда размер миоматозного узла не превышает 5,5 см. Помимо этого, гистерорезектоскопия является “полноценным” хирургическим вмешательством, выполняющимся под общим наркозом и имеющим достаточное количество осложнений.
Эмболизация маточных артерий является одним из альтернативных методов лечения подслизистых миоматозных узлов.
После проведения процедуры возможно два варианта развития событий, которые мы условно назвали “мокрый” и “сухой”. При “мокром” сценарий через 10-15 дней после процедуры миоматозный узел начинает отделяться от стенок матки и “вытекать” в виде серо-желтых выделений слизистой консистенции с неприятным зловонным запахом. Параллельно с этим у больной отмечается повышение температуры вплоть до 40 градусов и боли в нижних отделах живота. Через некоторое время (в зависимости от размера узла и скорости его “вытекания”) у больной появляются схаткообразные боли и узел может родиться. В том случае если он не может родиться самостоятельно, больной необходимо произвести его удаление в условия малой операционной.
При развитии событий по “сухому” варианту, миоматозный узел прогрессивно уменьшается в полости матки и в последствии экпульсируется наружу. Экпульсия узла может произойти во время менструации, в душе или во время полового акта (описаны и такие анекдотические случаи).
Предсказать по какому пути пойдет процесс – по “мокрому” или “сухому” невозможно. Мы предполагаем, что развитие “мокрого” варианта связано с первоначальной инфицированностью узла, то есть после эмболизации он подвергается каликвационному некрозу, а не коагуляционному, как в случае “сухого” варианта. Ниже мы приведем один из наиболее демонстративных случаев эмболизации маточных артерий у пациентки с большим подслизистым миоматозным узлом.
Как показывает наш опыт, при наличии небольших подслизистых миоматозных узлов их рождение после проведения эмболизации маточных артерий проходит для женщин подчас незаметно. Однако в данном случае большой объем узла обусловил развитие синдрома интоксикации, что привело к необходимости госпитализировать больную и проводить соответствующую терапию. В целом, судя по отзыву самой больной, постэмболизационный синдром она перенесла удовлетворительно, наибольшее неудобство ей доставило длительное его течение, а не выраженность симптомов. В то же время больная осталась крайне удовлетворена результатом лечения. Кроме этого, больная планирует беременность.
В описанном выше клиническом случае симптомы интоксикации были крайне выражены, в большинстве же случаев состояние больных намного лучше, и они не нуждаются в столь длительной госпитализации.
Для более эффективного и безопасного ведения этой категории больных мы можем предложить несколько рекомендаций:
1. Начинайте проведение антибактериальной терапии препаратами широкого спектра действия с момента начала “вытекания” узла до его полной экспульсии, а также в течение нескольких дней после. 2. Не форсируйте процесс! Не пытайтесь удалять узел из матки пока он полностью не отделился от стенок и не уменьшился до 3-4 см. В тоже время, если процесс затянулся, узел нужно убрать. Вопрос: когда же его надо извлекать? Ответ: полагайтесь на собственную интуицию.
3. Не пугайтесь состояния больной и данных лабораторных исследований (может быть повышено СОЭ, сдвиг лейкоцитарной формулы, другие отклонения). Постарайтесь внушить пациентке, что происходящее не угрожает ее здоровью. Все симптомы имеют реактивный характер. Однако, не стоит полностью расслабляться, хоть и редко, но случаи сепсиса в мировой литературе описаны. Вновь совет – полагайтесь на свою интуицию и клинический опыт.
Как оказалось шеечные миоматозные узлы, в том случае, если они расположены “интермурально”, после эмболизации ведут себя также, как и подслизистые – они рождаются.
Мы проводили эмболизацию маточных артерий больной с гигантским шеечным узлом, размер которого составлял 12 см., при этом тело матки было не изменено. Узел растянул всю верхнюю губу и сильно давил на мочевой пузырь. Если бы не существовало методаэмболизации маточных артерий, такой больно было бы показано проведение экстирпации матки, причем с большими техническими сложностями. Данная история не была бы столь примечательной, если бы не возраст больной, которой на момент поступления в клинику было 35 лет, и она была нерожавшей.
Эмболизация прошла без особенностей и на следующие сутки больная выписалась из клиники. Постэмболический синдром также не протекал без осложнений и закончился к 10 дню. Однако уже через 3 дня у больной вновь поднялась температура, появились боли в нижних отделах живота и выделения с неприятным запахом. В связи с тем, что больная находилась за пределами России мы по телефону назначили антибактериальную терапию и попросили следить за своим состоянием. На фоне антибактериальной терапии температура снизилась, но выделения продолжались. Через неделю больная сообщила нам, что во время акта дефекации у нее из влагалища появился полюс округлого образования, которое она “заправила” обратно и не знает, что с ним делать. Мы попросили больную приехать к нам, что она и сделала на следующий день.
При осмотре во влагалище был обнаружен практически полностью родившийся миоматозный узел с элементами распада. В условиях малой операционной, под обычным внутривенным наркозом, мы извлекли узел из влагалища, произвели ревизию шейки матки на предмет разрывов, коих там не оказалось, выскаблили ложе узла и на этом закончили процедуру, которая заняла 20 минут. На следующий день, после контрольного осмотра, больная была вписана. Что в итоге, благодаря проведенной эмболизации маточных артерий у больной удалось сохранить матку и избавить ее от гигантского миоматозного узла фактически за две с половиной недели. Теперь больная планирует беременность, о чем до процедуры она даже не могла и мечтать.
Эмболизация маточных артерий – уникальный инструмент для лечения больных миомой матки, но, несмотря на его кажущеюся простоту, пользоваться им надо осторожно и умеючи. Очень важно четко селектировать пациенток, которым этот метод поможет и тех, кому он будет не показан или даже опасен. Готовить и вести больных после процедуры надо максимально внимательно, поточности и конвейера в отношении этого метода быть не должно.
Другие методы лечения больших миоматозных узлов
К другим методам лечения больших миоматозных узлов относятся: 1. Высокочастотный фокусированный ультразвук 2. Лазерная вапоризация
3. Криомиолиз
Высокочастотный фокусированный ультразвук
Принцип лечения больных с использованием высокочастотного фокусированного ультразвука заключается в следующем: под контролем МРТ производится нацеливание лучей высокочастотного ультразвука на миоматозный узел, который должен быть расположен по передней стенке матки и на пути лучей не должно находиться никаких других органов. В нацеленном миоматозном узле под воздействием УЗ лучей создается высокая температура, порядка 60-70 градусов, которая коагулирует часть узла. При этом во время процедуры воздействие возможно направить только на один узел.
Во время процедуры, которая длится около двух часов больная должна неподвижно лежать, поскольку в случае изменения положения тела луч сбивается и может повредить соседние ткани. Обезболивание процедуры производится с использованием НПВС и седативных препаратов. Пациентки выписываются из клиники через несколько часов. Болевой синдром продолжается несколько дней, интенсивность его средняя. Для купирования болевого синдрома используются НПВС. Данную процедуру невозможно выполнить в случае наличия на передней брюшной стенке рубцов и избыточного отложения жировой ткани, поскольку это ослабляет ультразвуковой сигнал.
Теперь разрешите вопрос – зачем все это производить если:
1. воздействие оказывается только на один узел, который при этом должен быть особо расположен, перед ним не должно быть мочевого пузыря и петель кишечника 2. На передней брюшной стенке не должно быть рубцов и толстого слоя жировой клетчатки
3. Больная должна два часа лежать неподвижно
Столько усилий чтобы уменьшить в размерах только один узел, который, скорее всего, не обусловливает симптомы? А как же множество остальных узлов, которые точно есть, и которые после такого воздействия могут дать стремительный рост? Такой метод лечения столь распространенного заболевания, как миома матки, не может иметь столько ограничений к использованию – избыточное количество жировой клетчатки и рубец после кесарева сечения, которые есть чуть ли не у каждой третьей больной этим заболеванием. В общем, нам совсем не понятно зачем этот метод существует и, простите конечно, кому он такой нужен.
Криомиолиз и лазерная вапоризация
Суть данных методик заключается в локальном и непосредственном воздействии на ткань миоматозного узла различными физическими силами – лазером или холодом. Доступ к узлу осуществляется лапороскопическими инструментами. Под воздействием физических сил происходит уменьшение в размерах миоматозного узла, на который это воздействие направлено. Далее все точно также, как и в случае высокочастотного фокусированного ультразвука – сложно, дорого, долго и в результате уменьшился один или два поверхностно расположенных узла. Мы считаем, что данные методики не имеют большого будущего.
Заключение
Несмотря на то, что это может звучать вызывающе, мы близки к мысли, что в настоящий момент проблема миомы матки решена. Остались нерешенными лишь нюансы, такие как, скажем, проблема обезболивания после эмболизации маточных артерий, возможность полноценного сохранения репродуктивной функции после данного вмешательства, а также снижение его стоимости.
Миома матки – это такое заболевание, которое очень легко профилактировать. Мы порой поражаемся тому, что некоторые пациентки с гигантскими миомами годами растят это образование, ходя от одного врача к другому, лишь из-за страха подвергнуться хирургическому вмешательству. Миому легче всего и проще, когда размеры узлов небольшие. Как исправить положение? Длительный прием оральных контрацептивов, профилактика инфекций, абортов и инвазивных вмешательств, а также профилактические ультразвуковые исследований – могут коренным образом изменить ситуацию.
www.sovetginekologa.ru
Клиника миомы матки в Москве - Центр лапароскопии в Москве
Клиническое течение такого заболевания, как миома матки, во многом зависит от анатомического строения этой доброкачественной опухоли.
Подбрюшинные миомы небольших размеров могут иметь бессимптомное течение, т.е. женщины не предъявляют никаких жалоб, при этом менструальная функция также не нарушена. Тем не менее, детальное обследование этих пациенток свидетельствует о нарушении секреции гонадотропных и половых гормонов, изменениях в сердечно-сосудистой системе, волемических нарушениях (т.е. нарушениях, связанных с круговоротом жидкости в организме). Данные пациентки нуждаются в диспансерном наблюдении по месту жительства в поликлинике и консервативном (как правило, медикаментозном) лечении.
Множественные миомы
У большинства женщин даже при значительной величине миомы каких-либо явных клинических признаков болезни не наблюдается. Однако в некоторых случаях возникают различные симптомы болезни: кровотечение из половых путей, боли, сдавливание соседних органов, рост миомы. При расположении множественной миомы матки с интерстициальным (межмышечным) расположением узлов происходит растяжение полости матки и увеличение менструирующей поверхности. Вследствие этого увеличивается количество крови, теряемой во время менструации. Кроме того, нарушается сократительная способность матки.
Миомы с центрипетальным ростом
Особенно сильные кровотечения возникают при миомах с центрипетальным ростом (т.е. ростом в полость матки) и подслизистым расположением узлов. Для данного типа расположения узлов характерно не только длительные и обильные менструации, но и присутствие межменструальных кровотечений. Зачастую уровень гемоглобина в крови падает до очень низких значений. Кровотечения могут быть связаны с нарушение целостности капсулы миомы или с некрозом узла. Анемизированных пациенток (т.е. пациенток с выраженным снижением уровня гемоглобина в крови) можно узнать по характерному внешнему виду: бледная с желтоватым оттенком кожа, несколько одутловатое лицо и другим признакам.
Лечение миомы
Миома является серьезным заболеванием, которое должно не только своевременно распознаваться, но и адекватно лечиться. Небольшие миомы лечатся консервативно при помощи лекарственных средств, которые не только сдерживают дальнейший рост миомы, но и способствуют ее уменьшению. Однако наиболее успешной методикой лечения миомы матки практически любой локализации является применение лапароскопической методики. Лапароскопия обеспечивает щадящий доступ к миоме через несколько крохотных проколов, при этом время операции сокращается до минимума, а послеоперационные период занимает всего несколько дней.
Клиническое течение миомы матки в большинстве случаев бессимптомное, однако есть признаки, по которым можно самостоятельно заподозрить миомы матки. Они неспецифичны, т.е. нельзя на 100% быть уверенной в наличии миомы, тем не менее, по данным признакам можно выявить миому на ранней стадии и не запустить болезнь.
Ациклические кровотечения
Ациклические кровотечения при миоме матки у 20 – 40% женщин могут быть обусловлены нарушением функции яичников, что подтверждается нередко выявляемой гиперплазией эндометрия. Вместе с тем слизистая оболочка тела матки может иметь нормальное строение, либо оно соответствует таковому в неполноценной фазе секреции. Маточное кровотечение может быть обусловлено также сопутствующей патологией, весьма часто присутствующей при миоме матки: стромальной гиперплазией яичников, кистозной дегенерацией яичников, воспалением придатков матки, внутренним эндометриозом, гормонпродуцирующими опухолями яичников.
Появление кровотечения у женщин почти всегда свидетельствует о патологии яичников или эндометрия. В этих случаях необходимо проведение диагностического выскабливания. При хронических (регулярных) кровотечениях развивается постгеморрагическая анемия, выражающаяся в нарушении деятельности сердечно-сосудистой системы, частых обмороках, головокружении, слабости, быстрой утомляемости. По одиночке данные симптомы не могут рассматриваться в качестве признаков миомы, однако в совокупности должны настораживать женщину – рекомендуется обследование у гинеколога.
Болевой синдром
Болевой синдром вызывается из-за натяжения связочного аппарата матки, растяжения ее брюшинного покрова и давления опухоли на окружающие органы. Давление на соседние органы зависит от расположения и направления роста узлов. Например, исходящие из передней стенки матки узлы даже при собственных небольших размерах все равно оказывают давление на мочевой пузырь, вызывая при этом дизурические явления (расстройства мочеиспускания). Интралигаментально (внутри связок) расположенные узлы вызывают сдавление мочеточников с последующим развитием гидроуретера, гидронефроза и пиелонефрита.
Лечение миомы
В диагностике и лечении такого серьезного заболевания, как миома матки, нет места пренебрежительному отношению. Миома матки, вне зависимости от ее локализации стадии процесса, должна быть своевременно найдена и качественно вылечена. Радикальным методом терапии является плановая лапароскопия, которая позволяет женщине подготовиться к операции, а затем быстро восстановить работоспособность. Лапароскопия – это малоинвазивное вмешательство, которое обеспечивает минимум боли при максимуме эффекта.
med-port.ru