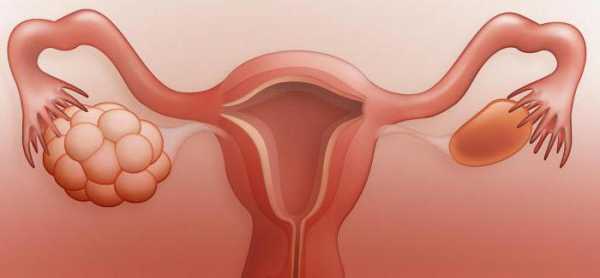
Циторедуктивная операция при раке яичников
Как вылечить рак яичников популярными методами — реабилитация больного после лечения и профилактика
Рак яичников на первых двух стадиях проходит с минимальным набором симптомов (тошнота, метеоризм, потеря веса), что делает проблематичным раннее выявление, лечение патологии. На более поздних стадиях (III-IV), когда раковые клетки постепенно разрастаются, охватывая близлежащие органы, лечение требуется кардинальное, комплексное, длительное. Шансы на выздоровление с каждой новой стадией уменьшаются, но всё-таки вероятность благоприятного исхода существует даже на последней стадии (10%).
Основные методы лечения при раке яичников – особенности, показания и противопоказания.
При подборе того или иного метода лечения при раке яичников доктор учитывает несколько факторов:
Зачастую переход патологии с I на II стадию занимает год. В дальнейшем скорость развития болезни будет зависеть от защитных реакций организма больного, иных факторов.
Некоторые опухоли имеют агрессивное течение (при раке яичников они встречаются чаще всего), в других случаях симптоматика не столь болезненна/менее опасна.
- Наличие/отсутствие метастазов
Для качественного лечения указанной патологии лучше применять комплексный подход, что будет включать несколько методов.

Когда операция при раке яичников — единственный выход?
Хирургическое лечение занимает главную позицию в лечении рассматриваемого недуга.Большинство медиков придерживаются мнения, что независимо от стадии патологии, природы опухоли, больного необходимо оперировать. Такая потребность объясняется возможными ошибками при определении стадии рака. Если же рак яичников начал давать метастазы, то одной лишь химиотерапии/лучевой терапии будет недостаточно. Метастазирующие органы не реагируют на воздействие каких-либо препаратов.
Существует несколько видов операций, которые применяют при указанной патологии:
Заключается в удалении матки, придатков, яичников, большого сальника. Если признаков рака шейки матки нет, ее оставляют. Яичники, придатки извлекаются практически всегда (хотя бывают исключения), так как риск распространения раковых клеток на оба органа достаточно велик. Сальник следует извлекать по причине вероятного возникновения здесь метастаз при раке яичников.
В некоторых случаях (по состоянию здоровья больного, в силу недостаточной квалификации оперирующего, в иных случаях) оперирующий может принять решение о надвлагалищном удалении матки.
Заключается в тотальном удалении матки, и ее органов (яичников, придатков, сальника, шейки матки). Экстирпация показана при наличии патологических изменений в шейке матки.
- Циторедуктивные манипуляции
Используют при невозможности ликвидации всей опухоли. Эта процедура нацелена на уменьшение параметров злокачественного образования, что в дальнейшем будет подвержено воздействию химиотерапии. При гигантских размерах опухоли указанные процедуры не являются плодотворными.
При раке яичников циторедуктивные операции осуществляют в 3 этапа:
- Первичная операция. Актуальна при наличии больших недоброкачественных образований. Цель манипуляции – максимальное уменьшение параметров опухоли, ее метастазов.
- Промежуточная. После первичной циторедуктивной операции пациент проходит не длительный курс химиотерапии (2 сеанса). При наличии положительных результатов, доктор принимает решение о проведении промежуточной операции, которая заключается в уменьшении объемов опухоли – это дает возможность в будущем повысить эффективность химиотерапевтических процедур.
- Вторичная. Если после всего пройденного курса лечения у пациента выявлена опухоль, параметры которой превышают 5 см, ему назначают вторичную циторедуктивную операцию.
Проводится при непредвиденных обстоятельствах, что связаны с распадом опухоли, которая провоцирует непроходимость кишечника, внутрибрюшное кровотечение, иные обострение. Цель манипуляции – извлечение опухоли, остановка кровотечения. 
Имеет диагностическое назначение: проводится больным, которые успешно прошли лечение, — другие обследования не выявили признаков наличия патологии. Цель процедуры – подтверждение отсутствия/наличия злокачественного образования, метастаз. Указанная манипуляция часто используется для взятия образца органа, что подвержен дефектным изменениям.
Лапаротомию возможно проводить на любых стадиях недуга, если у пациента нету противопоказаний к хирургическому вмешательству (воспалительные явления в мочеполовой системе, плохая свертываемость крови, сердечная недостаточность и т.д.).
Химиотерапия при раке яичников: когда химия — лучшее решение?
Указанная процедура является плодотворной при ее комбинировании с оперативными методами лечения опухоли. Среди медикаментов, что применяют при химиотерапии стоит выделить препараты платина+циклофосфан, или платина+таксол. При отсутствии какого-либо положительного сдвига, препараты заменяют иными: метотрексат, фторурацил, лофенал, и т.д.

Способов внедрения препаратов несколько: внутримышечно, внутривенно. При асците больному, после откачивания жидкости, медикаменты вводят также в брюшную полость.
После назначения курса лечения еженедельно у больного производят забор крови, что нужно для изучения состояния внутренних органов, состава крови.
Показания к химиотерапии при диагностировании рака яичников:
- После проведения хирургического лечения: химиотерапия является средством предупреждения появления метастазов/новых опухолей в будущем.
- До проведения хирургических манипуляций, — благоприятствует удержанию разрастания раковых клеток.
- Стабилизация роста раковых клеток. Назначается только после проведение лапароскопии.
- Устранение остаточных злокачественных образований после оперирования больного.
- С целью увеличения продолжительности жизни пациента. Помогает временно стабилизировать состояние здоровья.
Для каждого пациента медикаменты подбираются индивидуально, с учетом нескольких моментов:
- Веса.
- Общего состояния.
- Функционирования системы кроветворения.
- Природы злокачественного образования.
- Восприимчивости опухоли к тем или иным препаратам.
- Отсутствия/наличия асцита.
При использовании химиотерапии параллельно назначают препараты, которые оказывают положительное влияние на систему кроветворения.
В основе указанного метода лечения лежит использование радиоактивных лучей для облучения брюшной полости.
Для этих целей может быть применено несколько способов:
- Принцип движущихся полос. Облучение происходит не равномерно, что может спровоцировать переброс раковых клеток на здоровые участки в будущем.
- Принцип открытых полей. Более популярен в лечении рака яичников: радиоактивные лучи воздействуют на широкий участок органов брюшной полости/малого таза.
Лучевая терапия при лечении рассматриваемого недуга используются редко, ее сочетают с иными методами лечения.
Показания для проведения указанной процедуры:
- С целью облегчения болевых ощущений пациента, для улучшения общего состояния. Длительность 1-го сеанса ограничивается несколькими минутами в день. Количество процедур будет варьироваться от 1 до 10.
- Отсутствие результатов после проведения курса химиотерапии+операции.
- Диагностируется рецидив рака яичников. В этом случае назначается комплексное лечение химиотерапия+лучевая терапия.
- Ликвидация остаточных образований после проведения хирургического лечения.
Указанный вид лечения противопоказан больным, которые имеют серьезные нарушения в работе внутренних органов/систем.
Медикаментозное лечение рака яичников
Весь комплекс существующих медикаментов, которые используют в борьбе с раком яичников, возможно разделить на 6 групп:
Провоцируют сбой в синтезе ДНК раковой клетки, что благоприятствует ее уничтожению. Представителями указанной группы препаратов являются метотрексат, 6-меркаптопурин, фторафур.
- Хлорэтиламины, этиленамины
При попадании в организм такие препараты вступают в реакцию с опухолевыми клетками, нарушая их нормальное функционирование, что вызывает гибель клеток. Популярными препаратами этой группы являются циклофосфан, сарколизин, бензо-ТЭФ.
- Гормоны.
- Антибиотики (противоопухолевые)
На сегодняшний день точная схема их действия изучается. Цель использования препаратов – разрушение структуры раковых клеток. Положительными откликами пользуются брунеомицин, адриамицин.
- Медикаменты растительного происхождения
Не могут назначаться пациентам с низким содержанием гемоглобина в крови, при сбоях в работе кроветворной системы. Принцип их действия – блокировка деления раковых клеток. В лечении рака яичников зачастую применяют колхамин, винкристин, винбластин.
- Иные противоопухолевые препараты
Угнетают рост раковых клеток. Эти медикаменты (L-аспарагиназа, миелосан) являются представителями различных химических групп.
Восстановление больного после лечения рака яичников.
После/во время лечения рассматриваемого недуга у больного возникает ряд обострений, которые возможно устранить, либо облегчить их проявление. Комплекс необходимых и полезных мер будет назначен доктором.
Читайте также: Когда начинать поиски рака?
Существует несколько опций борьбы с побочными эффектами лечения рака яичников, основными из них являются следующие:
Лекарственная терапия
В зависимости от негативных явлений, что наступили во время курса химиотерапии, лучевой терапии пациенту могут назначаться поддерживающие препараты:
Зачастую приписываются одновременно с курсом химиотерапии. Однако если после окончания лечения тошнота, рвота присутствуют, с целью исключения обезвоживания организма могут быть выписаны Ативан, Зофран, Компазин. Вариаций приема таких медикаментом может быть несколько: орально, ректально (свечи), внутривенно (капельница).
Назначаются в том случае, если адекватная диета на дала положительного эффекта.
При удалении обоих яичников доктор подбирает препараты, которые нужно будет принимать регулярно. В противном случае нарушенный гормональный фон может спровоцировать негативные последствия (приливы, ранняя менопауза, сухость кожи/влагалища и т.д.)
- Препараты, способствующие поддержанию защитных реакций в организме (интерлейкином-2, активированные лимфоциты и т.д.).
Психологическая помощь больному
С целью моральной поддержки больные могут обратиться не только к родственникам, друзьям, партнерам:
Сможет рассказать о возможных обострениях вызванных лечением, о мерах профилактики, особенностях домашнего лечения (рацион питания, физические упражнения). Финансовые вопросы, моменты посещений врача можно уточнить у доктора/медсестры.
Смогут посоветовать организацию, куда возможно обратиться за финансовой поддержкой, где отыскать домработниц/сиделок.
- Священник, психотерапевт.
- Группа поддержки со стороны женщин, которые перенесли подобное заболевание
На сегодняшний день существует множество женщин-волонтеров, что распространяют сведения о нюансах перенесенного ими лечения рака, оказывают моральную помощь
Физиотерапия
Физнагрузки после лечения рассматриваемого недуга будут очень полезными. Физическая активность способствует улучшению кровообращения, благоприятствует обновлению организма на клеточном уровне. Спорт поможет справиться с тошнотой, улучшит аппетит.

Лучшими видами спорта в реабилитационный период являются плавание, лечебная гимнастика. Для этих целей существуют специальные центры, где могут заниматься люди, перенесшие тяжелые заболевания.
Физиотерапевтические процедуры возможно проводить в учреждениях здравоохранения.
Прогноз и профилактика – какой процент выживаемости после лечения?
После завершения лечения благоприятный прогноз (от 5 лет жизни) будет определяться стадией, на которой был выявлен рак, эффективностью лечения, гистотипом опухоли:
- 1 стадия — 78-86%.
- 2 стадия – 58-66%.
- 3 стадия – 22-40%.
- 4 стадия – 5-10%.
В силу того, что природа рассматриваемого недуга до конца не изучена, комплекса профилактических мер в отношении рака яичников не существует.
Однако, соблюдая несколько правил, возможно снизить риск возникновения указанной патологии:
- Регулярное посещение гинеколога – каждые 6 месяцев.
- Лечение бесплодия. Рак яичников чаще возникает у нерожавших женщин.
- Прием противозачаточных гормональных препаратов (до наступления менопаузы).
- Своевременное лечение воспалительных процессов мочеполовой системы.
www.operabelno.ru
18)Циторедуктивные операции
Выделяют первичные и вторичные циторедуктивные операции, а также
повторные (second look) и паллиативные хирургические вмешательства.
Первичная циторедуктивная операция подразумевает максимальное удаление
массы опухоли на первом этапе лечения рака яичников.
В ряде случаев, если ожидается, что опухоль не удастся удалить во время
первичной операции, циторедукция проводится после того, как эффект даже
после одного курса химиотерапии достигает максимума и это позволяет
удалить опухолевые массы в максимальном объеме. Такое хирургическое
вмешательство называется интервенционной циторедукцией.
Вторичная операция преследует те же цели, что и первичная, но проводится
у больных, у которых остаются опухолевые массы после того, как закончен
весь первичный цикл (т.е. несколько курсов химиотерапии) или при наличии
рецидивов опухоли.
Повторные хирургические вмешательства типа second look проводятся у
больных, которым проведен полный курс лечения по радикальной программе и
у которых нет клинических признаков продолжения заболевания. Цель этих
операций - ревизия органов брюшной полости, а при наличии рецидивов
опухоли, клинически себя не проявляющих, удаление последних в
максимальном объеме. В случае выполнения операций такого характера
обязательным является проведение биопсии не менее чем из 20-40 различных
участков, а также взятие промывных вод для цитологического исследования
на наличие атипических клеток.
Ряд специалистов довольно негативно относятся к операциям типа second
look, имея ввиду этическую сторону проблемы. Американские онкогинекологи
однозначно высказывают мысль о том, что такие хирургические
вмешательства могут проводиться лишь в том случае, когда ожидается, что
они сменят дальнейшую тактику лечения.
25)Фертильность
Сохранение репродуктивной функции (фертильности) при аденокарциноме эндометрия матки. Пациенток с аденокарциномой эндометрия можно лечить медикаментозно, если это 1 тип рака эндометрия без метастазов в лимфатические узлы и прорастания в миометрий или шейку матки, определяемых при МРТ. Этим пациенткам назначают прогестины в больших дозах, например мегэстрол в дозе 40-400 мг или медроксипрогестерон 200-800 мг. Рецидивы возможны, в связи с чем периодически проводят обследование, чтобы избежать значительного прогрессирования опухоли, если гормонотерапия окажется неэффективной.
studfiles.net
Онкогинекология. Рак яичников
03 Мая в 16:03 11339
Рак яичников составляет 4—6% всех злокачественных опухолей у женщин, занимая 7-е место по частоте среди всех онкологических заболеваний и 3-е место среди онкогинекологических.
В большинстве экономически развитых странах мира показатели смертности от рака яичников являются наиболее высокими среди всех показателей смертности от злокачественных гинекологических опухолей, что связано с поздней диагностикой заболевания.
По данным Международного агентства по изучению рака, ежегодно в мире регистрируются более 160 000 новых случаев рака яичников и более 100 000 женщин умирают от злокачественных опухолей этого органа.
В России ежегодно рак яичников выявляется более чем у 11 000 женщин. За последние 10 лет произошел прирост заболеваемости на 8,5%.
Факторы риска возникновения злокачественных новообразований яичников:
■ отсутствие беременностей и родов;
■ нерациональная заместительная гормональная терапия;
■ применение гормональных ЛС в гинекологии;
■ наследственная предрасположенность.
По гистологическому строению выделяют следующие эпителиальные опухоли яичников (в скобках указана распространенность): эпителиальные и вторичные (метастатические) опухоли.
Эпителиальные опухоли подразделяются на:
■ серозные (60—72%):
— доброкачественные;
— пограничные (потенциально низкой степени злокачественности);
— злокачественные;
■ муцинозные (8—10%):
— доброкачественные;
— пограничные (потенциально низкой степени злокачественности);
— злокачественные;
■ эндометриоидные (10—12%):
— доброкачественные;
— пограничные (потенциально низкой степени злокачественности);
— злокачественные;
■ светлоклеточные (мезонефроидные) (2—4%):
— доброкачественные;
— пограничные (потенциально низкой степени злокачественности);
— злокачественные;
■ опухоли Бреннера (0,5—1,5%):
— доброкачественные;
— пограничные (потенциально низкой степени злокачественности);
— злокачественные;
■ смешанные эпителиальные опухоли:
— доброкачественные;
— пограничные (потенциально низкой степени злокачественности);
— злокачественные;
■ недифференцированная карцинома (0,5—1%);
■ неклассифицируемые эпителиальные опухоли.
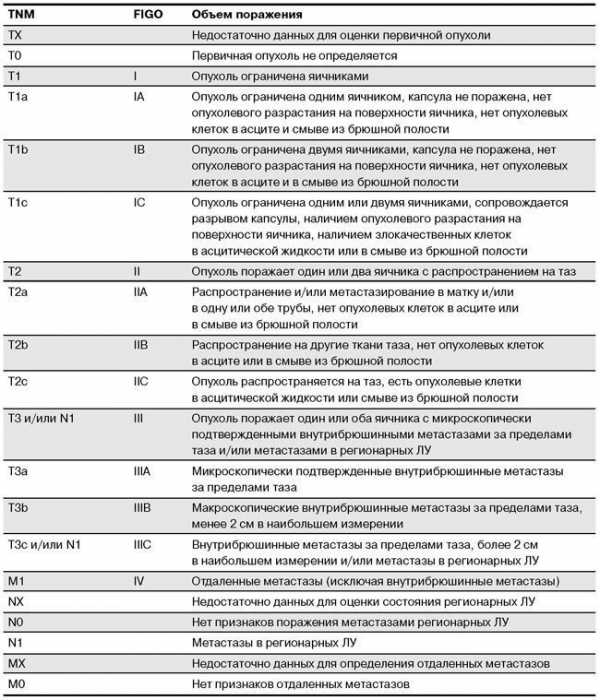
Общепринятая классификация стадий рака яичника отражена в таблице 56.5.
Метастазы в капсулу печени классифицируются как Т3/Ш стадия, метастазы в паренхиме печени — как M1/IV стадия, выявление опухолевых клеток в плевральной жидкости — как M1/IV стадия.
Этиология и патогенез рака яичников изучены недостаточно. Согласно теории непрерывной овуляции, зародышевый эпителий яичников не выдерживает многолетнего постоянного функционирования без физиологического отдыха, что приводит к возникновению опухоли. В эту теорию хорошо вписывается снижение риска заболевания раком яичников у женщин, имеющих детей с длительным грудным вскармливанием, а также применяющих гормональные контрацептивы.
Представляет интерес дисгормональная теория, согласно которой постоянная гиперстимуляция клеток яичников гонадотропными гормонами гипофиза приводит к их повреждению и озлокачествлению.
В последние годы интерес исследователей привлекают семейные случаи рака яичника. В настоящее время его причиной считается мутация генов BRCA1 и BRCA2. У носителей этих генов повышен риск заболевания (до 60%). Возможность развития рака яичников у женщин, матери или сестры которых страдали этим заболеванием, увеличивается на 5—7%.
Распространение рака яичников чаще идет по протяжению, путем имплантации по париетальной брюшине малого таза и за его пределами с поражением большого сальника.
Метастазирование идет по основным лимфатическим сосудам яичников в забрюшинные ЛУ и затем в главный лимфатический проток — грудной проток. Таким образом, в процесс вовлекаются верхние отделы брюшной полости, плевральная полость, надключичные и шейные ЛУ. Могут также поражаться паховые ЛУ и ЛУ малого таза.
Гематогенным путем происходит метастазирование в отдаленные органы.
Клинические проявления опухолевого процесса зависят от степени его распространения. На ранних стадиях общее состояние пациенток обычно не изменяется. Иногда появляется слабость, периодически возникают боли в животе без определенной локализации. Тошнота, рвота, ощущение распирания в верхнем отделе живота и тяжесть внизу живота иногда могут быть первыми симптомами заболевания.
По мере роста опухоли боли приобретают постоянный характер, локализуются в нижнем отделе живота, подвздошных областях и пояснице.
Возможны дизурические явления, нарушения функции ЖКТ. При прогрессировании опухолевого процесса отмечается резкое увеличение живота в объеме за счет роста опухоли и появления асцита, а также одышка, субфебрильная температура. При вовлечении в опухолевый процесс маточных труб и матки могут появиться кровяные выделения из половых путей.
Таблица 56.5. Классификация рака яичников по критериям ТNM и стадиям FIGO (1997)
Для распознавания заболевания помимо традиционного физикального и гинекологического исследований используют:
■ УЗИ с цветным допплеровским картированием;
■ компьютерную томографию (КТ);
■ магнитно-резонансную томографию (МРТ);
■ диагностическую лапароскопию.
К диагностической лапаротомии следует прибегать только при исчерпании возможностей всех других методов обследования. Диагноз уточняют после проведения гистологического и цитологического исследований. В последнее время широко применяют также определение опухолевых маркеров (СА-125 и др.).
Степень распространения опухоли определяют на основании данных клинического обследования, результатов оперативного вмешательства и гистологического изучения биоптатов, полученных во время операции из различных участков брюшной полости. Правильное определение стадии опухолевого процесса дает возможность выбрать оптимальную тактику лечения и улучшить его результаты.
Однако при определении степени распространения опухолевого процесса возможны значительные трудности, особенно при начальных стадиях заболевания. Так, у 28% пациенток с предполагаемой до операции I стадией заболевания и у 43% с предполагаемой II стадией после операции нередко выявляются более поздние стадии процесса.
При целенаправленном обследовании почти у 30% пациенток со злокачественными опухолями яичников I—II стадии выявляются метастазы в забрюшинных ЛУ различных локализаций.
Следует отметить, что обнаружить метастазы в забрюшинных ЛУ бывает достаточно трудно. Пораженные ЛУ могут оставаться неувеличенными, сохранять плотноэластическую консистенцию и относительно свободно смещаться.
Таким образом, несмотря на проведение операции, казалось бы, в полном объеме, у пациенток с предполагаемыми ранними стадиями заболевания отмечается достаточно высокий процент рецидивов — до 23%.
Существуют следующие критерии оценки риска рецидивирования рака яичника.
Низкий риск рецидивирования:
■ степень дифференцировки G1 и G2 (высокая и умеренная);
■ капсула яичника интактна;
■ отсутствие опухоли на наружной поверхности яичника;
■ отрицательный цитологический результат в биоптатах с брюшины;
■ асцит отсутствует. Высокий риск рецидивирования:
■ степень дифференцировки G3 (низкая);
■ капсула вовлечена в опухолевый процесс;
■ наличие опухоли на наружной поверхности яичника;
■ положительный цитологический результат в биоптатах с брюшины;
■ асцит имеется.
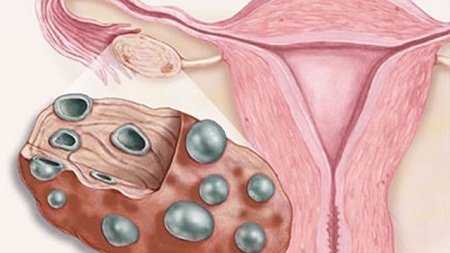
Дифференциальную диагностику рака яичников необходимо проводить с доброкачественными новообразованиями и следующими опухолевидными процессами:
■ лютеомой беременности;
■ гиперплазией стромы яичника и гипертекозом;
■ массивным отеком яичника;
■ единичной фолликулярной кистой и кистой желтого тела;
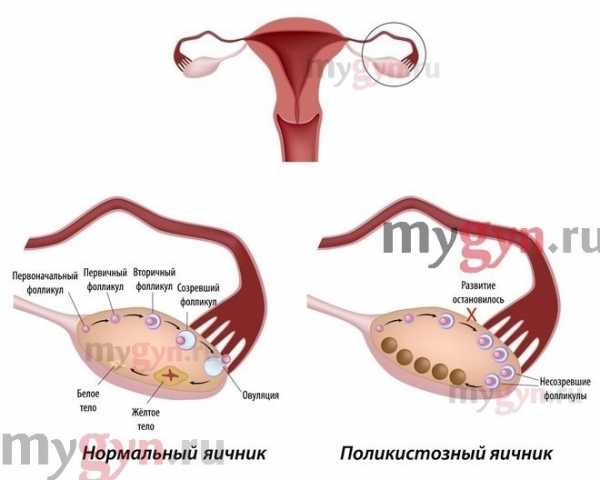
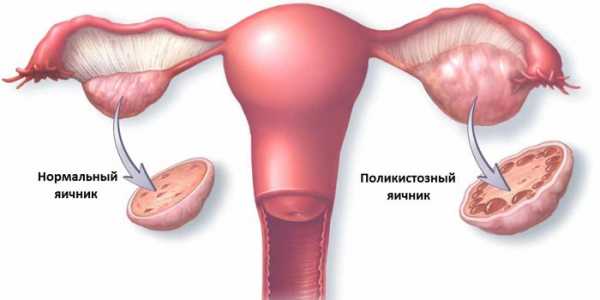
■ множественными фолликулярными кистами (поликистозные яичники);
■ множественными лютеинизированными фолликулярными кистами и/или желтыми телами;
■ эндометриоидными кистами яичника;
■ поверхностными эпителиальными кистами-включениями;
■ простыми кистами;
■ воспалительными процессами;
■ параовариальными кистами.
При лечении больных злокачественными новообразованиями яичников находят применение все основные методы лечения:
■ хирургический;
■ лучевой;
■ химиотерапия;
■ иммунотерапия.
Выбор варианта комбинированного лечения больных раком яичников зависит от выявленных клинико-морфологических факторов заболевания.
Оперативное лечение больных раком яичников за последнее десятилетие претерпело значительные изменения. В настоящее время выработаны показания как к органосохраняющим, так и к расширенным операциям.
Для выполнения последних должны соблюдаться 2 условия:
■ наличие метастазов в забрюшинных ЛУ, что определяется при УЗИ, КТ, МРТ;
■ отсутствие видимой опухоли в брюшной полости после операции стандартного объема.
При расширенной операции удаляют тазовые, парааортальные, а при необходимости и паховые ЛУ. Частота поражения удаленных ЛУ достигает 78%, что свидетельствует о целесообразности выполнения хотя бы селективной лимфаденэктомии при наличии увеличенных ЛУ.
Стандартным объемом операций при раке яичников I стадии является экстирпация матки с придатками и удаление большого сальника из срединного лапаротомного доступа. При этом производят обследование брюшной полости со взятием материала для цитологического исследования при наличии выпота или смывов с органов брюшной полости. При наличии подозрительных участков брюшины их иссекают для последующего гистологического изучения.
При желании молодых больных с пограничными опухолями или раком яичников IA стадии (серозной, муцинозной или эндомериоидной высокодифференцированной аденокарциномой G1) сохранить репродуктивную функцию допустимо выполнение органосохраняющей операции в объеме одностороннего удаления придатков матки с обязательной биопсией другого яичника со срочным гистологическим исследованием и удаление большого сальника.
От адъювантной химиотерапии можно воздержаться только при 1А стадии рака яичников указанных выше типов, высокой степени дифференцировки и диплоидности клеток опухоли. В этих случаях необходимо наблюдать за больной, проводя клиническое, ультразвуковое и иммунологическое (определение уровня онкомаркеров в сыворотке крови) обследования не реже 1 раза в 3 месяца.
Лечение пациенток с распространенными злокачественными опухолями яичников, как правило, следует начинать с хирургического вмешательства. При этом стараются максимально удалить опухолевые массы, т.к. это заметно улучшает выживаемость пациенток. Операция заключается в удалении матки с придатками и резекции большого сальника. Во время операции также определяют стадию опухолевого процесса. Обязательно проводят тщательное обследование брюшной полости с биопсией измененных участков брюшины и цитологическим исследованием аспиратов и смывов.
Хирургическое вмешательство играет важнейшую роль при проведении комбинированного лечения больных раком яичников. Как правило, при этом операция имеет характер циторедуктивного вмешательства, при котором максимально удаляют первичную опухоль и ее метастазы в брюшной полости. Качество выполненного циторедуктивного вмешательства в значительной мере определяет последующий прогноз.
Радикальность операции оценивают по размерам остаточной опухоли:
■ оптимальная циторедуктивная операция — отсутствие измеряемой остаточной опухоли при повышенном уровне СА-125, иногда наличие асцита и плеврита;
■ субоптимальная операция — остаточная опухоль не превышает 2 см в наибольшем измерении;
■ неоптимальная — остаточная опухоль более 2 см.
Целесообразность выполнения более обширных циторедуктивных операций признается далеко не всеми исследователями, поскольку современная химиотерапия является альтернативой хирургическому лечению.
Поскольку больным раком яичников проводятся лишь циторедуктивные операции, то им в дальнейшем показана системная химиотерапия.
При вовлечении в опухолевый процесс других органов брюшной полости иногда приходится прибегать к выполнению комбинированных операций.
Показанием к их выполнению является возможность удаления основных масс опухоли при поражении соседних органов. При этом чаще резецируют тонкую или толстую кишку (74%), мочевыводящие пути (15%), удаляют селезенку (5%), резецируют печень (5%).
Нередко (в 65% случаев) удается выполнить резекцию пораженной части кишки вместе с опухолью яичника и полностью восстановить проходимость кишечника с наложением анастомоза.
Увеличение объема хирургического вмешательства за счет удаления метастазов из стенки кишки и из ее брыжейки улучшает функцию ЖКТ, а следовательно, и состояние больной, облегчая в будущем переносимость химиотерапии.
При невозможности выполнения оптимальной первичной циторедуктивной операции может быть проведено отсроченное хирургическое вмешательство после нескольких курсов неоадъювантной химиотерапии.
Применение адъювантной лучевой терапии при раке яичников является предметом изучения и дискуссий. Показаниями к ее проведению служат остаточная химиорезистентная опухоль, локализующаяся в малом тазу или в забрюшинном пространстве, и сопутствующее поражение ЛУ.
Лучевую терапию планируют с учетом стадии заболевания, локализации и величины опухоли, эффекта от проведенной химиотерапии и общего состояния пациентки.
Облучение проводят с использованием следующих методик:
■ открытых полей и квадратов;
■ одновременного облучения малого таза и парааортальных зон;
■ последовательного облучения всего таза;
■ облучения одной пораженной опухолью зоны.
Эффективность лучевой терапии зависит от размеров опухоли и дозы облучения. Проведение одновременной химиолучевой терапии оказывается более эффективным, чем их последовательное применение, однако при этом отмечаются выраженные побочные реакции.
Адъювантная химиотерапия является неотъемлемой составной частью лечебного процесса для подавляющего большинства пациенток, страдающих раком яичников. Проведение ее следует начинать как можно быстрее — уже на 10— 12-е сутки после операции.
Под термином «первая линия химиотерапии» понимают применение противоопухолевых ЛС у больных, ранее не получавших химиопрепараты.
Вторая и последующие линии химиотерапии используются в отсутствие эффекта от применявшихся ранее схем лечения.
Использование химиотерапии в качестве основного лечебного воздействия для достижения выраженного эффекта называется индукционной химиотерапией.
Стандартом первой линии химиотерапии при IC—IV стадиях являются следующие схемы, включающие производные платины:
Паклитаксел в/в капельно в виде 3-часовой инфузии 175 мг/м2 1 раз в 3—4 нед, 6—8 циклов
+
Карбоплатин в/в капельно AUC 5 1 раз
в 3—4 нед, 6—8 циклов или Цисплатин в/в капельно 75 мг/м2 1 раз
в 3—4 нед, 6—8 циклов или
Доксорубицин в/в капельно 50 мг/м2 1 раз в 3—4 нед, 6—8 циклов
+
Циклофосфамид в/в капельно 500 мг/м2 1 раз в 3—4 нед, 6—8 циклов
+
Цисплатин в/в капельно 50 мг/м2 1 раз в 3—4 нед, 6—8 циклов или
Карбоплатин в/в капельно AUC 5 1 раз
в 3—4 нед, 6—8 циклов или Цисплатин в/в капельно 75 мг/м2 1 раз
в 3—4 нед, 6—8 циклов
+
Циклофосфамид в/в капельно 750 мг/м2 1 раз в 3—4 нед, 6—8 циклов или
Карбоплатин в/в капельно AUC 5—7 1 раз в 3—4 нед, 6—8 циклов или
Цисплатин в/в капельно 100 мг/м2 1 раз в 3—4 недели или 50 мг/м2 1 р/нед, 6—8 циклов.
Пожилым пациенткам в качестве адъювантной химиотерапии можно рекомендовать следующую схему:
Мелфалан внутрь 0,2 мг/кг/сут 1 р/сут, в течение 5 сут каждые 28 сут, 6 курсов.
В настоящее время перспективным методом лечения больных раком яичника считается внутрибрюшинное введение паклитаксела (это позволяет создать в брюшной полости концентрацию, превышающую концентрацию в плазме при в/в введении более чем в 100 раз):
Паклитаксел внутрибрюшинно 60 мг/м2 1 р/нед, 3—4 нед.
Внутрибрюшинное введение таксола может быть использовано для проведения химиотерапии у пациенток с оптимально выполненной циторедуктивной операцией в том случае, если размеры остаточных опухолевых образований не превышают 0,5 см, а также в качестве химиотерапии второй линии у больных с минимальными проявлениями болезни после химиотерапии.
Соблюдение оптимальной интенсивности химиотерапии, позволяющей сбалансировать токсичность и эффективность лечения, является важным фактором успешного лечения наряду с правильным выбором лекарственной комбинации. Необоснованное уменьшение числа курсов и/или доз химиопрепаратов, а также увеличение интервалов между курсами неминуемо приведет к ухудшению результатов лечения.
Ретроспективный анализ многочисленных работ показал, что с повышением доз цитостатиков в режимах комбинированной химиотерапии или дозы цисплатина при проведении монотерапии улучшаются непосредственные и отдаленные результаты лечения. Однако корреляция доза—эффект существует в пределах от 15 до 25 мг/м2 1 р/нед (или от 45 до 75 мг/м2 1 раз в 3 недели), дальнейшее повышение дозы не приводит к улучшению результатов лечения.
Пока не получено убедительных данных о целесообразности использования высокодозной химиотерапии с поддержкой стволовыми клетками костного мозга пациентки при распространенном раке яичников.
При использовании стандартных режимов химиотерапии уменьшение доз, как правило, не требуется, за исключением случаев тяжелой гематологической токсичности (нейтро- и/или тромбоцитопения III—IV степени), осложненной лихорадкой и/или геморрагическим синдромом, что чаще наблюдается при использовании карбоплатина в дозах AUC 6,5—7. Явления нефро- и нейротоксичности, как правило, не достигают выраженной степени и не требуют коррекции доз.
Важной составной частью успешной лекарственной терапии является соблюдение оптимальной периодичности лечения. Большинство используемых при раке яичников химиотерапевтических режимов предусматривает интервал между курсами, равный 3, реже 4 неделям. Увеличение интервала может и должно производиться в соответствии с четкими медицинскими показаниями. Наиболее частой причиной увеличения промежутка между курсами служат проявления токсичности: сохраняющаяся к моменту начала очередного цикла нейтро- и/или тромбоцитопения, что более характерно для комбинаций с включением карбоплатина. Уместно напомнить, что абсолютное число нейтрофилов, равное 1,5 X 109/л, и тромбоцитов, равное 100 X 109/л, является достаточным для проведения очередного курса лечения.
Правильный выбор лекарственного режима и соблюдение основных принципов проведения химиотерапии позволяют добиться объективного противоопухолевого эффекта у 70—80% больных при средней продолжительности ремиссии 12 месяцев.
Химиотерапия второй линии. Несмотря на исчезновение всех признаков заболевания, у подавляющего большинства пациенток в первые 2—3 года после окончания химиотерапии первой линии следует ожидать прогрессирования заболевания в основном за счет появления внутри-брюшных метастазов. Все эти пациентки будут нуждаться в проведении химиотерапии второй линии.
Появление после достижения полной регрессии клинических или определяемых с помощью дополнительных методов исследования признаков болезни либо рост имевшихся после окончания первой линии химиотерапии опухолевых узлов с ухудшением общего состояния — абсолютный признак прогрессирования заболевания. При этом требуется проведение химиотерапии второй линии.
В случае возникновения локального рецидива заболевания может быть рассмотрен вопрос о целесообразности оперативного вмешательства. Однако очень часто при выполнении операции помимо определяемого локального рецидива выявляются субклинические метастазы в брюшной полости.
Химиотерапия второй линии позволяет контролировать симптомы заболевания у большинства пациенток, в т.ч. с опухолями, резистентными к платине; увеличивать время до прогрессирования злокачественного процесса и общую продолжительность жизни у больных с высокой чувствительностью к платине, но не способна приводить к излечению. Таким образом, для подавляющего большинства больных химиотерапия второй линии носит паллиативный характер.
Эффективность химиотерапии второй линии зависит от продолжительности интервала между окончанием химиотерапии первой линии и возникновением признаков прогрессирования заболевания. Чем длиннее этот интервал, тем больше шанс получения противоопухолевого эффекта при последующем лечении. Рецидив заболевания, потенциально чувствительный к производным платины, предполагает обязательное включение в состав химиотерапии цисплатина или карбоплатина. При этом возможно проведение химиотерапии второй линии теми же ЛС, которые были использованы при проведении химиотерапии первой линии, или комбинацией производного платины с новым противоопухолевым ЛС.
Набор противоопухолевых ЛС, используемых для проведения химиотерапии второй линии, необычайно велик, что свидетельствует о том, что ни один из них не позволяет получить длительную ремиссию у большинства пациенток.
Наиболее часто применяемые ЛС и возможные комбинации представлены в таблице 56.6.
Таблица 56.6. ЛС химиотерапии второй линии при лечении рака яичников
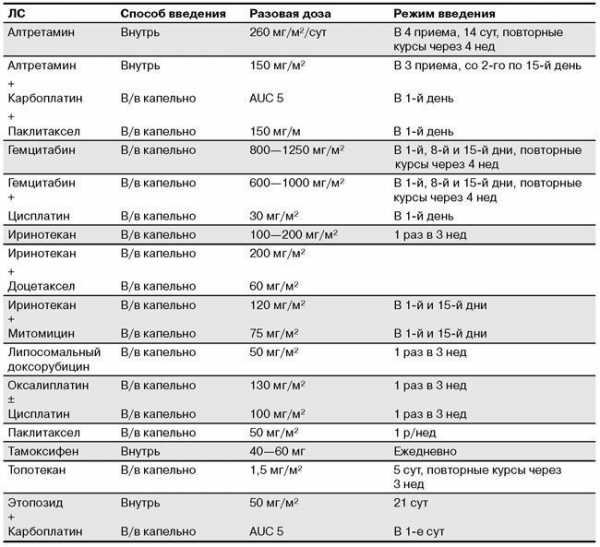
Эффективность применения этих химиопрепаратов варьирует от 12 до 40% при средней продолжительности жизни пациентов 9—12 месяцев.
Неудовлетворительные результаты лечения больных злокачественными новообразованиями яичников делает необходимыми совместные усилия хирургов, химиотерапевтов, радиологов по разработке новых программ и методов лечения.
После окончания первичного лечения больные раком яичников должны постоянно находиться под наблюдением онкогинеколога.
Им рекомендуется каждые 3 месяца, помимо клинического обследования и УЗИ, проводить определение в крови уровня опухолевого маркера СА-125.
Динамика уровня этого маркера тесно коррелирует с эффективностью лечения и выживаемостью. Уровень СА-125 в сыворотке крови необходимо определять перед каждым курсом химиотерапии. Повышенный уровень СА-125 может рассматриваться в качестве первого сигнала рецидива заболевания. В дальнейшем рецидив заболевания подтверждается клиническими и дополнительными методами исследования (УЗИ, КТ, МРТ).
Повышение уровня СА-125 у больных раком яичников нередко предшествует появлению симптомов прогрессирования процесса. Известно, что СА-125 является неспецифическим маркером рака яичников, повышение его уровня может быть обусловлено продукцией хронически воспаленного мезотелия брюшины после ранее проведенной операции и химиотерапии первой линии. Именно это обстоятельство иногда обусловливает умеренное персистирующее присутствие или повышение уровня СА-125 вскоре после окончания лечения в отсутствие признаков болезни.
В случае медленно текущей опухолевой прогрессии интервал между повышением уровня СА-125 и появлением других симптомов заболевания может составлять несколько месяцев, а иногда и лет.
По мнению сторонников раннего начала химиотерапии, проведение лечения при минимальных (субклинических) объемах опухолевой массы имеет большие шансы к достижению клинического эффекта. Противники этой точки зрения утверждают, что химиотерапия второй линии носит паллиативный характер, и ее проведение у больных в отсутствие симптомов способно лишь ухудшить общее состояние вследствие токсичности, не оказав влияния на прогноз заболевания.
При решении вопроса о начале химиотерапии в случае выявления повышенного уровня СА-125 следует учитывать мнение пациентки, поскольку эмоциональное состояние при росте уровня СА-125 является основной причиной немедленного начала терапии.
Эффективность применения химиотерапевтических ЛС оценивается по степени регрессии опухоли, общей и безрецидивной выживаемости больных.
Ниже представлена эффективность использования ЛС первой и второй линий химиотерапии рака яичников (табл. 56.7, 56.8).
Таблица 56.7. Эффективность применения ЛС первой линии химиотерапии рака яичников
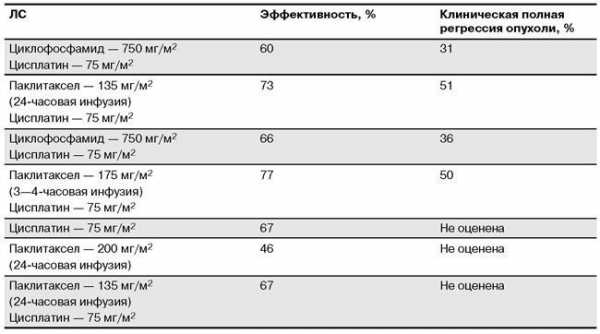
Таблица 56.8. Эффективность применения ЛС второй линии химиотерапии рака яичников
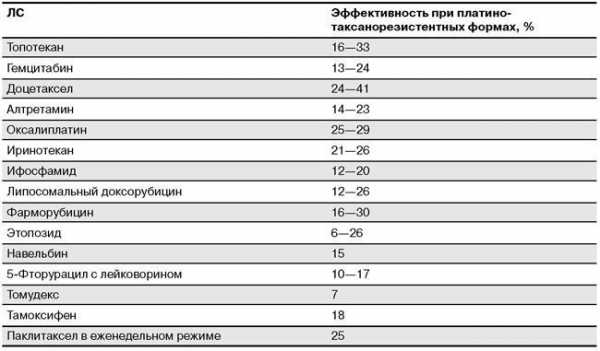
Применение противоопухолевых ЛС может сопровождаться значительной частотой побочных реакций.
Различают 5 степеней интенсивности побочного действия:
■ степень 0 — нет изменений самочувствия пациентки и лабораторных данных;
■ степень 1 — минимальные изменения, не влияющие на общую активность пациентки, лабораторные показатели изменены незначительно, их коррекция не требуется;
■ степень 2 — умеренные изменения, нарушающие нормальную активность и жизнедеятельность пациентки, вызывающие заметные изменения лабораторных показателей, обусловливающие необходимость в коррекции;
■ степень 3 — резкие нарушения, при которых требуются активное симптоматическое лечение, отсрочка или прекращение химиотерапии;
■ степень 4 — опасна для жизни, требует немедленной отмены химиотерапии.
Основные побочные эффекты комплексных соединений платины заключаются в появлении тошноты и рвоты, угнетении кроветворения, нефро- и нейротоксичности. Карбоплатин обладает меньшей по сравнению с цисплатином нефротоксичностью и оказывает более выраженное угнетающее миелопоэз действие.
Для токсанов характерно угнетение гемопоэза, главным образом гранулоцитарного ростка. Кроме того, возможны реакции в виде периферической нейропатии в виде парестезий, практически у всех пациенток отмечается аллопеция.
Включение платиновых производных в режимы индукционной полихимиотерапии при раке яичников является в настоящее время обязательным. Однако в России таким пациенткам нередко все еще назначают бесплатиновые комбинации, что не может считаться адекватной тактикой лечения.
Летальность пациенток со злокачественными опухолями яичников на первом году после установления диагноза составляет 35%. По сводным данным популяционных раковых регистров стран Европы, одногодичная выживаемость больных раком яичников составляет 63%, трехлетняя — 41%, пятилетняя — 35%.
При наличии хотя бы одного из признаков высокого риска рецидивирования (см. «Критерии оценки риска рецидивирования рака яичника») процесс должен рассматриваться как прогностически неблагоприятный. Кроме того, известно, что с неблагоприятным прогнозом ассоциируются серозные аденокарциномы, в то время как при эндометриоидных опухолях прогноз наилучший, а при муцинозных и светлоклеточных опухолях прогноз занимает промежуточное положение.
В случае высокодифференцированных опухолей 1А и В стадий хирургическое лечение позволяет обеспечить более чем 90% 5-летнюю выживаемость. Однако при этих же стадиях в группе пациенток с высоким риском рецидивирования (см. «Критерии оценки риска рецидивирования рака яичника») у 35—60% больных после оперативного лечения развиваются рецидивы.
В.И. Кулаков, В.Н. Серов
medbe.ru
Материалы конгрессов и конференций
ЛЕЧЕНИЕ БОЛЬНЫХ РАСПРОСТРАНЕННЫМ РАКОМ ЯИЧНИКА
Тюляндин С.А. ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Данная лекция посвящена важнейшим этапам лечения распространенного рака яичника, которыми являются оперативное вмешательство, проводимое с целью максимальной циторедукции, индукционная химиотерапия и лечение рецидивов заболевания.
Циторедуктивная операция.
Оперативное лечение больных раком яичников преследует две важнейшие цели:
1) установление стадии заболевания;
2) удаление первичной опухоли и максимально возможная резекция всех ее метастазов.
Опыт работы с больными раком яичником дает возможность утверждать, что сегодня при проведении оперативного лечения хирурги не уделяют должного внимания определению стадии заболевания независимо от того, где оперирована больная: в обще-хирургическом стационаре районной больницы или в специализированном отделении ведущей онкологической клиники. По моему мнению, основной причиной этого является отсутствие единого, общепризнанного в России, протокола операции, которому обязан следовать любой оперирующий хирург при подозрении на рак яичников.
В США и Европе считается необходимым выполнение следующих оперативных и диагностических мероприятия при подозрении на рак яичников (см. таблицу 1) [1].
Таблица 1. Оперативные и диагностические мероприятия при подозрении на рак яичников[1].
- Срединный разрез.
- Взятие на цитологическое исследование асцитической жидкости, а при ее отсутствии - смывов с тазовой брюшины, диафрагмы, малого и большого сальников.
- Экстирпация матки, двухсторонняя сальпингоовариоэктомия.
- Удаление большого сальника
- Аппендэктомия.
- Тщательный осмотр и описание состояния тонкой и толстой кишки, брыжейки, париетальной и висцеральной брюшины, включая капсулу печени, мочевого пузыря, селезенки, желудка, поджелудочной железы, почек.
- Биопсия всех подозрительных участков.
- Удаление или биопсия лимфоузлов таза и забрюшинных лимфоузлов (только пальпации недостаточно).
- Множественные биопсии брюшины, покрывающей мочевой пузырь и стенки таза, малого сальника, брыжейки тонкой и толстой кишки, диафрагмы.
Правильное стадирование болезни позволяет разделить больных на равноценные прогностические группы, определить оптимальную для каждой стадии тактику лечения и в последующем проводить сравнение результатов лечения.
Второй целью оперативного лечения распространенного рака яичников является удаление или максимальная резекция как самой первичной опухоли, так и всех ее метастазов. Удаление основной массы опухоли улучшает общее состояние больных за счет уменьшения интоксикации и нормализации функции кишечника. Кроме того, циторедукция повышает эффективность последующей химиотерапии за счет уменьшения числа опухолевых клеток, в том числе и резистентных к химиотерапии, перехода большей части оставшихся клеток из фазы покоя в фазу деления, и удаления плохо васкуляризованных участков опухоли, в которые затруднено попадание противоопухолевых препаратов.
Размеры опухолевых образований после циторедуктивной операции существенно влияют на результаты последующей терапии и прогноз пациентки. Так, средняя продолжительность жизни больных с размерами остаточных опухолевых узлов менее 0,5 см составляет 40 месяцев, а при размерах 0,5-2 и более 2 см 18 и 6 месяцев соответственно [2]. Именно поэтому оптимально выполненной циторедуктивной операцией считается та, при которой максимальные размеры оставшихся опухолевых образований не превышают 2 см. В некоторых центрах под оптимальной циторедукцией принимают размеры оставшихся опухолевых образований менее 1 см. Для достижения подобной циторедукции хирургу подчас приходится выполнять множественные резекции кишки, печени, селезенки, мочевого пузыря, диафрагмы, использовать ультразвуковой аспиратор и лазерный коагулятор для удаления мелких диссеминатов. Понятно, что циторедуктивные операции считаются технически сложными и требуют высокой квалификации хирурга, специализирующегося в онкогинекологии. Несмотря на все это, частота выполнения оптимальной циторедукции в ведущих клиниках мира составляет 23-54%, и только отдельные авторы добиваются этого у 75-90% больных.
Остается неясным значение циторедуктивной операции у больных IV стадией рака яичников. Большинство авторов согласны с тем, что при общем удовлетворительном состоянии больных целесообразна попытка максимального удаления массы опухоли на первом этапе с последующим проведением химиотерапии.
Первая линия химиотерапии.
В связи с заведомо нерадикальным характером циторедуктивной операции всем больным раком яичника IC-IV стадиями показано проведение химиотерапии. В последние годы происходит интенсивный поиск наиболее эффективной комбинации для проведения первой линии химиотерапии. В таблице 2 приведены результаты наиболее важных рандомизированных исследований, опубликованных в литературе или доложенных в предварительном виде на международных съездах и конференциях. При анализе результатов лечения бросается в глаза существенное увеличение продолжительности жизни больных распространенным раком яичников. Если в конце 80-х- - начале 90-х годов средняя продолжительность жизни составляла 18-24 месяца, то в большинстве приведенных исследований этот показатель увеличился до 30-38 месяцев.
Можно предложить два объяснения этого феномена. Во-первых, улучшилось качество выполнения циторедуктивных операций, в результате чего существенно сократились размеры остаточных образований и объем остаточной опухолевой массы после выполнения оперативного вмешательства. Вторая причина связана с появлением новых противоопухолевых препаратов, обладающих активностью при раке яичников. К таким препаратам относятся, в частности, таксаны (паклитаксел и доцетаксел).
Таблица 2. Результаты рандомизированных исследований, посвященных определению оптимальной первой линии химиотерапии распространенного рака яичников.
| GOG-111 (1996) [3] Цисплатин-циклофосфан (75/750) Цисплатин-паклитаксел (75/175) | 13 мес.* 18 мес.* | 24 мес.* 38 мес.* |
| OV-10 (2000) [4] Цисплатин-циклофосфан (75/750) Цисплатин-паклитаксел (75/135) | 12 мес.* 17 мес.* | 25 мес.* 35 мес.* |
| GOG 132 (2000) [5] Цисплатин (100)Паклитаксел (200) | 16 мес.* 11 мес.* | 30 мес. 26 мес. |
| Цисплатин-паклитаксел (75/135) | 14 мес. | 27 мес. |
| Neijt J.P. (2000) [6] Цисплатин-паклитаксел (75/175) Карбоплатин-паклитаксел (AUCx5/175) | 16 мес. 16 мес. | 30 мес. 32 мес. |
| AGO (1999)** [7] Цисплатин-паклитаксел (75/185) Карбоплатин-паклитаксел (AUCx6/185) | 16 мес. 17 мес. | Нетданных |
| GOG-158 (1999)** [8] Цисплатин-паклитаксел (75/135) Карбоплатин-паклитаксел (AUCx7,5/175) | 22 мес. 22 мес. | Нетданных |
| ICON-3 (2000)** [9] Карбоплатин (AUC x 6) или CAP (50/50/500) Карбоплатин-паклитаксел (AUCx6/175) | 17 мес. 16 мес. | 62%*** 64%*** |
| AGO-GINECO(2001)** [10] Карбоплатин-паклитаксел (AUCx5/175) Карбоплатин-паклитаксел-эпирубицин (AUCx5/175/60) | 18 мес. 18 мес. | Нетданных |
| SCOTROC (2001)** [11] Карбоплатин-паклитаксел (AUCx5/175) Карбоплатин-доцетаксел (AUCx5/75) | Одинакова | Одинакова |
- СAP-цисплатин-доксорубинин-циклофосфан *-статистически достоверная разница
**-предварительные данные
Первоначально в исследованиях GOG 111 и OV-10 было показано, что паклитаксел в сочетании с цисплатином существенно улучшают результаты лечения по сравнению с комбинацией цисплатин-циклофосфан. Высокая нейротоксичность комбинации цисплатин-паклитаксел сделала актуальным замену цисплатина на карбоплатин. В нескольких исследованиях [Neijt J.P., AGO, GOG-158] было продемонстрировано, что такая замена не приводит к ухудшению отдаленных результатов и существенно улучшает переносимость лечения. Затем в исследовании GOG-132 обнаружено, что при назначении как комбинации паклитаксела и цисплатина, так и последовательного использования двух препаратов (цисплатина для первой линии и паклитаксела для второй линии), продолжительность жизни больных одинакова. Таким образом, еще раз была подчеркнута необходимость использования таксанов на различных этапах лечения для достижения наилучших результатов.
Особняком стоит исследование ICON-3, в котором приняли участие 2039 больных Ic-IV стадиями рака яичников. В контрольной группе больные получали карбоплатин в дозе AUC>5 или комбинацию САР (500/50/50 мг/м2), в сравниваемой группе - комбинацию цисплатина и паклитаксела (75/175 мг/м2). Лечение проводилось каждые 3 недели в объеме 6 курсов. Предварительные данные свидетельствуют о том, что время до прогрессирования и общая продолжительность жизни была одинаковой независимо от применяемой химиотерапии. Большинство больных (57%) в группе карбоплатина и CAP получали таксаны в качестве химиотерапии второй линии, что объясняет сравнительно хорошие отдаленные результаты.
В исследовании AGO-GINECO авторы оценили целесообразность добавления антрациклинов к комбинации карбоплатин паклитаксел. Включение эпирубицина усилило токсичность комбинации, но не улучшило результаты терапии [10]. В исследовании SCOTROC произведено сравнение имеющихся сегодня в нашем распоряжении таксанов: паклитаксела и доцетаксела [11]. Оба препарата в комбинации с карбоплатином продемонстрировали одинаковую частоту объективных эффектов и время до прогрессирования. Комбинация карбоплатин-паклитаксел обладала более выраженной нейротоксичностью, в то время как карбоплатин-доцетаксел чаще обуславливал развитие нейтропении.
Таким образом, сегодня в нашем распоряжении имеется целый ряд эффективных препаратов и режимов для лечения больных распространенным раком яичников. В качестве первой линии химиотерапии можно использовать комбинированные режимы (карбоплатин-паклитаксел, цисплатин-паклитаксел, карбоплатин-доцетаксел или CAP) или монотерапию препаратами платины (цисплатин 100 мг/м2 каждые 3 недели 6 курсов или 50 мг/м2 еженедельно в течение 9 недель, карбоплатин AUC x 5-7 каждые 3-4 недели 6 курсов). Больные, получившие на первом этапе лечения режимы без включения таксанов, должны обязательно получать таксаны во второй линии химиотерапии. При назначении вышеуказанных препаратов и комбинаций в полных дозах и рекомендуемых интервалах можно рассчитывать на получение среднего времени до прогрессирования 15-17 месяцев и средней продолжительности жизни 30-36 месяцев.
Нерешенным остается вопрос об оптимальной продолжительности химиотерапии первой линии. Сегодня можно рекомендовать индивидуальный подход в каждом конкретном случае. На этапе химиотерапии первой линии нужно стремиться к достижению полной регрессии с исчезновением всех проявлений болезни, в том числе и нормализацией уровня СА-125, а затем закрепить достигнутый эффект проведением еще 2-3 дополнительных курсов. При достижении частичной регрессии следует продолжать химиотерапию до момента, когда в течение двух последних курсов отмечается стабилизация болезни, оценивая по размерам остаточных опухолевых масс и концентрации опухолевых маркеров. По собственному опыту могу сказать, что в этих случаях у большинства больных число курсов лечения составит от 6 до 12, но не менее 6. В случае стабилизации болезни объем лечения следует ограничить 6 курсами, по завершении которых терапия может быть прекращена до признаков прогрессирования или продолжена с использованием режимов второй линии в зависимости от общего состояния больной и ее отношения к дальнейшему проведению химиотерапия. При прогрессировании болезни следует переходить на режимы второй линии химиотерапии.
Химиотерапия второй линии.
Многолетний опыт показывает, что химиотерапия второй линии позволяет контролировать симптомы заболевания у большинства больных, в том числе и резистентных к производным платины, существенно увеличивать продолжительность ремиссии и жизни у отдельных больных с высокой чувствительностью к платиновым производным, но не способна приводить к излечению. Таким образом, для подавляющего большинства больных химиотерапия второй линии носит паллиативный характер [12].
Арсенал противоопухолевых средств, используемых для проведения химиотерапии второй линии необычайно велик. К ним относятся паклитаксел, доцетаксел, топотекан, липосомальный доксорубицин, пероральный этопозид, винорельбин, гемцитабин, оксалиплатин, алтретамин, ифосфамид. Столь большой перечень препаратов - это скорее свидетельство того, что ни один из них не позволяет достигнуть длительных ремиссий у большинства пациенток. Эффективность их колеблется от 12 до 40% при средней продолжительности жизни 9-12 месяцев.
Решение о выборе препаратов для химиотерапии второй линии должно базироваться, в первую очередь, на определении чувствительности опухоли к производным платины после химиотерапии первой линии. Интервал между окончанием терапии первой линии и прогрессированием заболевания более 6 месяцев свидетельствует о высокой чувствительности опухоли к производным платины. Таким больным для лечения рецидивов следует назначать комбинацию производных платины и новых препаратов из числа тех, что используются для проведения второй линии химиотерапии. У отдельных больных с длительностью ремиссии более 12 месяцев возможно проведение химиотерапии второй линии той же комбинацией, которая использовалась на этапе индукции. Частота объективного эффекта при использовании комбинации производных платины (чаще карбоплатина ввиду его меньшей токсичности) и новых препаратов составляет 30-50% при средней продолжительности жизни больных 12-14 месяцев.
У больных с резистентными (интервал менее 6 месяцев) или рефрактерными к цисплатину опухолями яичника для проведения химиотерапии следует выбирать препараты, ранее не использовавшиеся на этапе индукции. Производные платины этим больным не назначаются. В этом случае частота объективного эффекта не превышает 20-25% при средней продолжительности жизни 6-10 месяцев.
Список литературы:
1. Trimbos J.B., Bolis G. Guidelines for surgical staging of ovarian cancer. Obstet. Gynecol. Surv. 1994, 49:814.
2. Boente M.P., Chi D.S., Hoskins W.J. The role of surgery in the management of ovarian cancer: primary and interval cytoreductive surgery. Semin. Oncol. 1998, 25:326.
3. McGuire WP, Hoskins WJ, Brady MF et al. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and IV ovarian cancer. NEJM 1996, 334: 1-6.
4. Piccart M. J., Bertelsen K., James K., et al. Randomized Intergroup trial of cisplatin-paclitaxel versus cisplatin-cyclophosphamide in women with advanced epithelial ovarian cancer: three-year result. J.Natl. Cancer Inst. 2000, 92:699.
5. Muggia F. M., Braly P. S., Brady M. F. al. Phase III Randomized Study of Cisplatin Versus Paclitaxel Versus Cisplatin and Paclitaxel in Patients With Suboptimal Stage III or IV Ovarian Cancer: A Gynecologic Oncology Group Study. J.Clin.Oncol. 2000, 18:106.
6. Neijt J. P., Engelholm S. A., Tuxen M. K. et al. Exploratory Phase III Study of Paclitaxel and Cisplatin Versus Paclitaxel and Carboplatin in Advanced Ovarian Cancer. J.Clin.Oncol. 2000, 18:3084.
7. duBois A., Lueck H.J., Meier W. et al. Cisplatin/paclitaxel vs carboplatin/paclitaxel in ovarian cancer: update of an Arbeitsgemeinschaft Gynaekologische Onkologie (AGO) study group trial. Proc. ASCO 1999, 18:356a (abst. 1374).
8. Ozols R.F., Bundy B.N., Clarke-Pearson D. et al. Randomized phase III study of cisplatin (CIS)/paclitaxel (PAC) versus carboplatin (CARBO)/PAC in optimal stage III epithelial ovarian cancer (OC): a Gynecologic Oncology Group trial (GOG 158). Proc. ASCO 1999, 18:356a (abst. 1373).
9. Colombo N. Randomized trial of paclitaxel and carboplatin versus a control arm of carboplatin or CAP (cyclophosphamide, doxorubicin and cisplatin): the Third International Collaborative Ovarian Neoplasm Study (ICON3). Proc.ASCO 2000, 19: abst. 1500.
10. Du Bois A., Weber B., Pfisterer J. et al. Epirubicin/paclitaxel/carboplatin (TEC) vs. paclitaxel/carboplatin (TC) in first-line treatment of ovarian cancer FIGO stages IIb - IV. Interim results of an AGO-GINECO Intergroup phase III trial. Proc.ASCO 2001, 21: abst. 805.
11. Vasey P., on behalf of the Scottish Gynaecologic Cancer Trials Group. Preliminary results of the SCOTROC Trial: a phase III comparison of paclitaxel-carboplatin (PC) and docetaxel-carboplatin (DC) as first-line chemotherapy for stage Ic-IV epithelial ovarian cancer (EOC). Proc. ASCO 2001, 20: abst. 804.
12. Тюляндин С.А. Рак яичников: химиотерапия второй линии. Практическая онкология 2000, N 4, с.32.
rosoncoweb.ru