Таргетная терапия рака молочной железы
ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫТАРГЕТНОЙ ТЕРАПИЕЙ
Онкологическая клиника в Москве ¦ РАК МОЛОЧНОЙ ЖЕЛЕЗЫ ¦ Лечение рака молочной железы таргетной терапией
Таргетная терапия РМЖ (рака молочной железы) – это новейшее слово в лечении рака молочной железы. Еще ее называют терапия цели, тк воздействие таргетных препаратов идет на молекулярном уровне. Данная методика лечения рака выгодно отличается от классической: лучевой терапии, химиотерапии и хирургии, тем, что не оказывает побочного воздействия на здоровые ткани организма, и вызывает быструю гибель опухоли.
Таргетная терапия рака молочной железы в Европейской клинике
Рак молочной железы – опухоль, образовавшаяся на железистой ткани. У людей женского пола возрастом 13-19 лет, данное заболевание зачастую встречается. Рак молочных желез стоит на втором месте по частоте после рака легких.
Европейская клиника в Москве – одна из специализированных онкологических клиник России. Она фокусируется на здоровье пациента и прилагает все усилия, все методики, чтобы человек остался здоровым. Под одной крышей были собраны профессионалы, современное оборудование, высокий уровень обслуживания.
Специалисты усердно исследуют и разрабатывают новые методики и препараты, предназначенные для борьбы с различными заболеваниями.
Лечение рака молочной железы с помощью таргетной терапии успешно используется в Европейской клинике как самостоятельно, так совместно с химиотерапией или радиотерапией.
Препараты таргетной терапии рака молочной железы
Существует три препарата, предназначенные для лечения рака молочной железы. Воздействуют они на:
- PARP-белок,
- рецептор эпидермального фактора роста 2
- рецепторы эстрогена.
Каждый препарат будет рассмотрен по отдельности:
Препарат, блокирующий рецепторы эстрогена. Это первая разработка таргетной терапии, позволяющая удалять рецепторы эстрогена, которые в большем нормы количестве наблюдаются на опухолях молочной железы. При присоединении эстроген-рецептора к гормону эстрогена происходит активация генов, в результате чего наблюдается рост и размножение опухолевых клеток.
В процессе исследований было выявлено, что эффективным лечением рака молочной железы является, воздействие на клетки, в составе которых находятся эстроген-рецепторы, путем блокировки рецепторов. Препараты: Тамоксифен, Торемифен, Фулвестрант, носят название «селективный модулятор эстрогеновых рецепторов».
Препарат, блокирующий рост эстрогеновых рецепторов. Второй разработкой таргетной терапии стал препарат, который влияет на рост эстрогеновых рецепторов опухоли молочной железы, представленный так называемыми «ингибиторами ароматазы».
Ароматаза – это фермент организма, позволяющий вырабатывать эстроген. При снижении активности данного фермента, происходит уменьшение синтеза эстрогена в организмах женского пола. В результате чего происходит полное уничтожение клеток, которые нуждались в эстрогене. Только у женщин есть высокая чувствительность к действию препарата, это объясняется тем, что функционирующие яичники вырабатывают большое количество ароматазы, поэтому полное её блокирование просто невозможно. Экземестан, Анастрозол, Летрозол – препараты второго класса таргетных препаратов.
Препарат, блокирующий рецептор эпидермального фактора роста 2. Следующим препаратом таргетной терапии является Трастузумаб, или заменой ему может послужить Герцептин. Его цель – рецептор эпидермального фактора роста 2, который вырабатывается в результате опухоли или рака молочных желез. Данный рецептор является механизмом, передающего сигнала, который ведёт к росту опухолевой клетки.
Действие препарата «Герцептин» исследователям до конца не ясно. Есть предположение, что кроме блокировки рецептора на опухоли, препарат способен стимулировать иммунитет организма к атаке высококонцентрированных рецепторов эпидермального фактора роста клеток. Такой же способностью обладает препарат Тайверб или Лапатиниб.
Применение и преимущества Герцептина:
- После хирургического лечения снижается риск повторного проявления рака молочных желез.
- Происходит уменьшение или полное уничтожение метастатических очагов и опухолевых клеток. Герцептин применяется капельным путем внутривенно. Первая доза препарата должна вводиться в течение 90 минут, а вторая доза не менее 30 минут. В отличие от применения других химических препаратов не наблюдается побочных эффектов: не нарушает желудочно-кишечный тракт и иммунную систему.
+7(925)191-50-55 - европейские протоколы лечения в Москве
ЗАПРОС в КЛИНИКУ
www.rusmedserv.com
Таргетная терапия рака молочной железы - точно в цель
Когда ученым стало больше известно о генных мутациях в клетках, вызывающих рак, они занялись разработкой новых лекарственных средств, направленных на данные изменения. Эти целевые препараты работают иначе, чем стандартная химиотерапия. Для них характерны различные, зачастую менее тяжелые побочные эффекты.
Стоимость таргетной терапии рака молочной железы в Израиле от 1 000$.
Наша организация, медицинский сервис «TheBestMedic», предлагает организацию проведения таргетной терапии в Израиле – приемлемая стоимость, лечение у лучших врачей, безупречная организация в кратчайшие сроки, бытовое сопровождение, дополнительные услуги. Получить консультацию и цены
Рассмотрим основные препараты таргетной терапии, используемые в Израиле при лечении рака груди.
Таргетная терапия рака молочной железы препаратами, нацеленными на белок HER2/neu
Примерно у 1 из 5 пациенток, больных раком груди, на поверхности злокачественных клеток слишком много белка - HER2/neu (или просто HER2), способствующего их росту. Такой вид онкологии, как правило, быстро растет и распространяется более агрессивно, если лечение не проводится. Был разработан ряд препаратов, нацеленных против HER2/neu.
Ни одно из данных лекарств не является безопасным во время беременности, поскольку способно причинить вред или даже привести к смерти плода. При проведении таргетной терапии рака молочной железы женщинам, не достигшим периода менопаузы, необходимо использовать эффективные противозачаточные средства.
Таргетная терапия рака молочной железы: Трастузумаб (Герцептин)
Трастузумаб (Герцептин) – один из препаратов, известный как моноклональные антитела, техногенная версия специфического белка иммунной системы. Он прикрепляется к белку HER2 и может помочь замедлить рост раковых клеток со слишком большим количеством данного вещества. Более того, герцептин также стимулирует иммунную систему более эффективно бороться с онкологией.
Прием препарата осуществляется внутривенно, как правило, один раз в неделю или в большей дозе - каждые 3 недели.
Трастузумаб часто используется в качестве адъювантной терапии (после операции) HER2-положительного рака груди для снижения риска возврата заболевания. Сначала проводят совместное лечение с химиотерапией, а затем отдельно, в общей сложности в течение года. Герцептин также может назначаться до операции в качестве неоадъювантной терапии.
Кроме того, трастузумаб применяется для лечения рецидива болезни, а также в случае роста опухоли во время терапии. Комбинация химиопрепаратов и герцептина работает лучше, чем отдельно химиотерапевтическое лечение. Если рак прогрессирует, часто продолжают лечение трастузумабом, а химиотерапию меняют.
По сравнению с химиопрепаратами, побочные эффекты герцептина проявляются в относительно легкой форме. Эти нежелательные проявления встречаются редко и могут включать лихорадку и озноб, головную боль, слабость, кашель, тошноту, рвоту и диарею. Обычно они незначительны.
Более серьезным побочным эффектом считается повреждение сердца, которое приводит к возникновению так называемой застойной сердечной недостаточности. Для большинства (но не для всех) женщин, данный симптом носит временный характер и проходит после прекращения приема лекарственного средства. Риск этих побочных эффектов возрастает, когда трастузумаб сочетают с определенными химиопрепаратами, такими как Доксорубицин (Адриамицин) и Эпирубицин (Ellence). По этой причине работу сердца регулярно проверяют во время лечения. Основными симптомами застойной сердечной недостаточности являются одышка, отеки ног и сильная усталость. При возникновении этих признаков пациентка обязательно должна сообщить врачу.
Таргетная терапия рака молочной железы: Адо-трастузумаб эмтансин (TDM-1, Kadcyla ™)
Адо-трастузумаб эмтансин является одним из препаратов категории конъюгатов антитело-лекарств, состоящий из того же моноклонального антитела, найденного в герцептине, и химиопрепарата, известного как DM-1. В этом типе лекарственного средства антитело действует как прибор наведения, доставляя химиотерапевтический препарат непосредственно к злокачественным клеткам.
Kadcyla применяют для лечения распространенного рака груди, в виде инъекций каждые 3 недели. Общие побочные эффекты включают усталость, тошноту, боли в мышцах и в костях, низкое количество тромбоцитов, головную боль и запор. Возможны более серьезные нежелательные явления, такие как тяжелые аллергические реакции, повреждения печени и сердца, проблемы с легкими.
Таргетная терапия рака молочной железы: Пертузумаб (Perjeta ®)
Как трастузумаба, пертузумаб представляет собой моноклональное антитело, которое прикрепляется к HER2 белку. Этот препарат могут назначать вместе с доцетакселом (Таксотер) и трастузумабом для лечения распространенного рака груди, а также на начальных стадиях заболевания в качестве неоадъювантной терапии (до операции).
Пертузумаб вводят внутривенно каждые 3 недели. К общим побочным эффектам относят диарею, выпадение волос, тошноту, усталость, сыпь и низкое число белых клеток крови (иногда с лихорадкой).
При заболеваниях сердца пертузумаб не применяют, поскольку он может ослабить орган. Врачи в Израиле изучают состояние сердца, прежде чем назначить этот препарат, каждые несколько месяцев во время терапии пертузумабом они контролируют и проверяют состояние сердечной мышцы.
Таргетная терапия рака молочной железы: Лапатиниб (Tykerb)
Лапатиниб еще один препарат, который нацелен на белок HER2. Показанием является диагноз - распространенный HER2-положительный рак груди, при лечении которого оказались неэффективны химиопрепараты и трастузумаба. Tykerb также комбинируют с кселодой и летрозолом (Femara). Принимается в виде таблеток.
Результаты одного исследования показали большую эффективность применения лапатиниба наряду с трастузумабом при метастатическом раке груди по сравнению с одним приемом лапатиниба.
К наиболее распространенным побочным эффектам этого препарата относят диарею, тошноту, рвоту, сыпь и ладонно-подошвенный синдром. Диарея является распространенным нежелательным явлением лечения и может быть очень серьезным, так что важно сообщать врачу о любых изменения, связанных с работой кишечника.
В редких случаях лапатиниб способен вызвать проблемы с печенью или снижение функции сердца (что может привести к одышке), но симптомы, как правило, уходят, как только лечение заканчивается.
Таргетная терапия рака молочной железы: Эверолимус (Afinitor ®)
Эверолимус является одним из видов таргетной терапии, который блокирует белок mTOR. Данный белок координирует синтез на рибосомах многих белков, в том числе, связанных с размножением и ростом клетки. Избыточная активация функции mTOR провоцирует бесконтрольное деление клеток – то есть превращение их в злокачественные. Блокируя белок, можно предотвратить рост раковых клеток. Эверолимус способен также остановить развитие новых кровеносных сосудов в опухоли, что ограничит ее рост. В лечение рака груди эверолимус повышает эффективность гормональной терапии.
Эверолимус - это таблетки, которые нужно принимать один раз в день.
Этот препарат одобрен для лечения распространенного гормонально-позитивного, HER2-негативного рака груди у женщин постклимактерического возраста. Его назначают вместе с Экземестаном (Aromasin), если опухоль выросла в то время, когда проводили лечение летрозолом или анастрозолом.
Общие побочные эффекты этого препарата включают язвы в полости рта, диарею, тошноту, усталость, слабость, низкие показатели крови, одышку и кашель. Эверолимус может также увеличить уровень липидов в крови (холестерин и триглицериды) и сахара. Поэтому, пока принимается препарат, врачи делают анализы крови с целью контроля состояния организма. Эверолимус также способен увеличить риск серьезных инфекций.
Afinitor изучают с целью применения на ранней стадии рака молочной железы, с другими препаратами гормональной терапии и в комбинации с разными методами лечения.
Таргетная терапия рака молочной железы: бевацизумаб (Авастин ®)
Опухоль должна создавать и развивать новые кровеносные сосуды, чтобы расти. Препараты, которые нацелены на эти сосуды, эффективны против различных видов рака и были изучены при лечении онкологии груди.
Бевацизумаб представляет собой моноклональное антитело, которое назначают пациентам при диагнозе метастатический рак груди. Это антитело направлено против фактора роста эндотелия сосудов (ФРЭС), белка, который помогает опухолям создавать новые кровеносные сосуды.
Бевацизумаб применяется внутривенно, достаточно часто - в комбинации с химиотерапией.
Редкие, но потенциально серьезные побочные эффекты включают кровотечение, язвы, образующиеся в толстой кишке и требующие хирургического вмешательства, медленное заживление ран.
К более распространенным побочным эффектам относят высокое давление, усталость, тромбы, сниженное количество белых клеток крови, головные боли, язвы в полости рта, потерю аппетита и диарею. Высокое кровяное давление является очень распространенным явлением, поэтому важно, чтобы врач контролировал данный симптом в ходе лечения.
Бевацизумаб был впервые одобрен в США FDA как часть комплексной терапии метастатического рака груди в 2008 году. Данное утверждение основывалось на исследовании, в котором прием бевацизумаба с химиопрепаратом паклитаксел (Taxol) остановил рост опухоли на более длительное время, чем применение одного препарата паклитаксел.
Новые результаты исследования, представленные в июле 2010 FDA, не показали преимущество лечения бевацизумабом. Хотя препарат, казалось, замедлил рост рака в течение короткого времени у некоторых из женщин, это не повысило продолжительность их жизни. Поэтому учитывая гораздо более серьезные побочные эффекты бевацизумаба, FDA пришло к выводу, что риск этого препарата перевешивает преимущества в лечении метастатического рака груди. 18 ноября 2011 года FDA отозвало из показаний препарата диагноз рак груди. Это не означает, что лекарственное средство будет недоступно, так как оно по-прежнему одобрено для лечения некоторых других видов онкологии. Это означает, что компания, производящая бевацизумаб, не можете продать его как препарат для лечения данного вида рака, а также не может рекомендовать его врачам или пациентам как лекарство, используемое при лечении этого заболевания. В тоже время женщины, которые принимают бевацизумаб, могут продолжать прием, но они должны обсудить это лечение со своим врачом.
Координационный центр TheBestMedic окажет помощь в организации диагностики и лечения рака груди в Израиле, в том числе таргетной терапии. Современные возможности израильской медицины гарантируют наилучший результат в лечении онкологии.
thebestmedic.com
Таргетная терапия рака молочной железы
Препараты таргетной направленности сегодня входят в схемы лечения большого количества злокачественных новообразований, принципиально меняя возможности терапии и прогноз. Термин «таргетный» (англ. target – «мишень») предполагает действие препарата, повреждающее определенное звено канцерогенеза, хотя, строго говоря, этот принцип соблюдается далеко не всегда, а эффективность большинства таргетных препаратов, назначаемых по принципу адресной доставки, пока, увы, далека от 100%, что вызывает справедливую критику. Вместе с тем таргетные препараты, дополняя химио- и гормонотерапию, в ряде случаев позволяют существенно повысить эффективность лечения без серьезного усугубления токсичности.
Сегодня официально зарегистрированы три препарата, применяемых при лечении рака молочной железы (РМЖ) и относящихся к группе таргетных: два из них – трастузумаб и лапатиниб – воздействуют на представителей семейства рецепторов эпидермального фактора роста (EGFR) и назначаются больным с гиперэкспрессией HER-2/neu или амплификацией гена HER-2/neu. Третий препарат – бевацизумаб – обладает антиангиогенными свойствами и воздействует на лиганд рецептора сосудистого эндотелиального фактора роста (VEGF). Справедливости ради следует упомянуть и самый первый таргетный препарат, созданный задолго до появления термина «таргетная терапия», но обладающий наибольшей эффективностью среди всех известных таргетных препаратов, – это тамоксифен, блокатор эстрогеновых рецепторов (ER), назначаемый при гормонозависимых опухолях; эффективность его в монотерапии достигает 70–80%.
Анти-HER-2 терапия
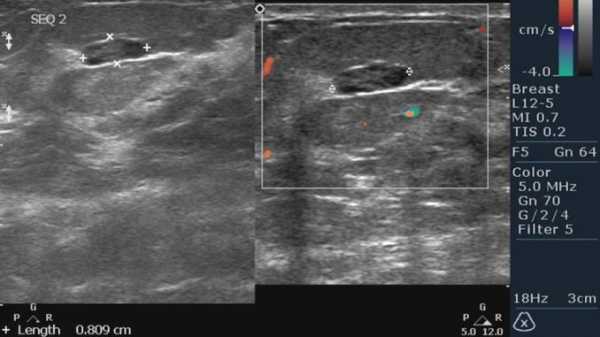
Этот вид терапии показан при HER-2-позитивном РМЖ, то есть в тех случаях, когда при иммуногистохимическом исследовании (ИГХ) на поверхности опухолевой клетки выявляется повышенная экспрессия рецептора эпидермального фактора роста HER-2/neu (erbB2) или определяется амплификация соответствующего кодирующего гена при флюоресцентной/хромогенной гибридизации in situ (FISH/CISH). Согласно современной молекулярной классификации, это могут быть HER-2/neu(+) и люминальный В типы РМЖ. Еще раз подчеркнем, что определение статуса HER-2/neu (с помощью ИГХ или FISH/CISH) является сегодня стандартной процедурой (по аналогии с ER и PgR), которая должна обязательно выполняться в рамках первичной диагностики. Сегодня при РМЖ разрешено клиническое применение двух анти-HER-2 препаратов – трастузумаба и лапатиниба.
Трастузумаб представляет собой моноклональное антитело к экстрацеллюлярному домену HER-2/neu и в монорежиме обладает умеренной эффективностью при метастатическом РМЖ (частота объективных эффектов в первой линии терапии не превышает 30–40%). Добавление трастузумаба существенно увеличивает противоопухолевую эффективность химиотерапии антрациклинами, таксанами, винорельбином, капецитабином, препаратами платины и гемцитабином. Назначение этих препаратов совместно с трастузумабом в первой и последующих линиях химиотерапии (вплоть до пятой) позволяет достичь частоты объективных эффектов от 24 до 81%. Увеличение противоопухолевого эффекта при комбинации трастузумаба и химиопрепаратов сопровождается незначительным усилением токсичности. Исключение составляет кардиотоксичность, присущая трастузумабу и усиливающаяся при его совместном применении с другими кардиотоксичными препаратами, в первую очередь антрациклинами.
В связи с этим до начала и в процессе лечения трастузумабом требуется оценка сократительной способности миокарда, особенно если имеется сопутствующая сердечно-сосудистая патология или терапия антрациклинами в анамнезе [1]. Есть сообщения об эффективности и относительной безопасности совместного применения трастузумаба с липосомальным доксорубицином, который представляет собой наночастицы доксорубицина, заключенные в полиэтиленгликолевую липосому; препарат обладает сходной с традиционным доксорубицином эффективностью и практически лишен кардиотоксических свойств [2]. Представляют интерес результаты ретроспективного анализа, проведенного S.S. Dawood и соавт., 2091 пациентки с метастатическим РМЖ, получавшей лечение в период с 1991 по 2007 г. Все больные были разделены на три группы:
- HER-2/neu(-) вариант (1782 пациентки; 85,3%);
- HER-2/neu(+) вариант без терапии трастузумабом в первой линии (118 больных; 5,6%);
- HER-2/neu(+) вариант с терапией трастузумабом в первой линии (191 больная; 9,1%).
При медиане времени наблюдения за больными 16,9 мес. 1-летняя выживаемость в HER-2/neu(-) группе составила 75,1%, в HER-2/neu(+) группе с терапией трастузумабом – 86,6% и в HER-2/neu(+) группе без терапии трастузумабом – 70,2%. Иными словами, терапия трастузумабом обеспечила снижение риска смерти среди больных HER-2/neu(+) РМЖ на 44% (p < 0,0001) по сравнению с больными HER-2/neu(-) РМЖ, то есть добавление трастузумаба в схему лечения позволило изменить естественное течение HER-2/neu(+) РМЖ [3]. Трастузумаб существенно улучшает также результаты адъювантной терапии HER-2/neu(+) РМЖ, особенно при одновременном использовании с таксансодержащими режимами. В 2006 г. трастузумаб был одобрен FDA к применению в адъювантном режиме и является составной частью адъювантных режимов терапии. В настоящее время ведутся исследования по определению оптимальной продолжительности адъювантного лечения трастузумабом [4].
Добавление трастузумаба к режимам предоперационной химиотерапии позволяет значительно увеличить частоту полных морфологических регрессий и, как следствие, улучшить отдаленные результаты лечения. Эффективность трастузумаба в комбинации со стандартной химиотерапией изучалась в многоцентровом рандомизированном исследовании NOAH с участием в общей сложности 228 больных местнораспространенным HER-2(+) РМЖ. 115 пациенток получали комбинацию индукционной химиотерапии: 3 курса доксорубицина и паклитаксела (60/150 мг/м2 каждые 3 нед.) → 4 курса паклитаксела (175 мг/м2 каждые 3 нед.) → 3 курса циклофосфамида, метотрексата, фторурацила (600/40/600 мг/м2 каждые 4 нед.) и трастузумаба (8 мг/кг → 6 мг/кг 1 раз в 3 нед. в течение 1 года), а 113 пациенток – только химиотерапию. Добавление трастузумаба к химиотерапии позволило значительно улучшить 3-летнюю бессобытийную выживаемость (71% и 56% соответственно при комбинированной терапии и химиотерапии; HR = 0,59; p = 0,013) и увеличить вдвое число полных морфологических регрессий в молочной железе и подмышечных лимфоузлах (19% и 38% в группе химиотерапии и комбинированной терапии соответственно; р = 0,001). Подгрупповой анализ показал аналогичные различия и среди больных инфильтративно-отечным РМЖ [5].
Лапатиниб – ингибитор тирозинкиназы рецепторов эпидермального фактора роста 1 (HER-1) и 2 (HER-2/neu). Лапатиниб в монотерапии обладает умеренной эффективностью (частота объективных эффектов в первой линии лечения составила 38%) и минимальной токсичностью [6]. У больных метастатическим HER-2/neu(+) РМЖ, получавших ранее антрациклины, таксаны и трастузумаб, назначение лапатиниба совместно с капецитабином позволило статистически значимо увеличить время до прогрессирования с 19 до 27 недель (р = 0,001) по сравнению с монотерапией капецитабином [7]. На основании полученных данных лапатиниб был зарегистрирован для лечения этой категории больных. Добавление анти-HER-2 препаратов к эндокринной терапии (летрозол и анастрозол) при гормонозависимых опухолях также повышает эффективность последней, хотя в целом результаты не столь выражены, как при химиотерапии [8, 9].
Очень интересным представляется опыт использования двух анти-HER-2 препаратов – трастузумаба и лапатиниба, которые при совместном применении могут полностью блокировать еrbB2 сигнальный путь и обеспечить максимальный противоопухолевый эффект в сравнении с монотерапией каждым из препаратов. В исследовании K.L. Blackwell и соавт. показано, что комбинация трастузумаба и лапатиниба позволила увеличить 6-месячную выживаемость без прогрессирования в сравнении с монотерапией трастузумабом [10]. Несмотря на скромные результаты такого варианта лечения, подобный подход создает предпосылки для полного отказа от крайне неспецифичной и высокотоксичной химиотерапии и требует дальнейшего изучения, возможно, с использованием других таргетных препаратов.
Целесообразность совместного назначения двух анти-HER-2 препаратов подтверждается и первыми результатами исследования NeoALTTO: комбинация трастузумаба и лапатиниба в сочетании с паклитакселом обеспечила достижение значительно большего числа полных морфологических регрессий (46,9%) по сравнению с режимами, в которых паклитаксел применяли в сочетании только с одним из этих препаратов (20,0% и 27,6%) [11].
В стадии изучения находятся и другие препараты, мишенью для которых являются рецепторы семейства EGFR. Пертузумаб – моноклональное антитело, нарушающее димеризацию HER-2 и препятствующее таким образом передаче сигналов, опосредованных HER-2-рецепторами (особенно HER-2/HER-3). В ряде пилотных исследований II фазы было показано, что пертузумаб эффективен при резистентности к терапии трастузумабом [12], однако наилучшими оказались результаты комбинированного использования этих двух моноклональных антител [13]. Из 66 включенных в исследование больных контроль над болезнью (ПР + ЧР + СТ ≥ 6 мес.) достигнут в 50% случаев, причем длительная стабилизация наблюдалась у 17 больных. Медиана времени до прогрессирования составила 5,5 мес. Комбинация обладала хорошей переносимостью, серьезной кардиотоксичности отмечено не было. В настоящее время закончен набор в рандомизированное исследование III фазы по изучению эффективности комбинации пертузумаба, трастузумаба и доцетаксела в первой линии терапии диссеминированного HER-2(+) РМЖ (исследование CLEOPATRA).
Крайне интересным представляется препарат T-DM1, сочетающий в себе анти-HER-2 компонент трастузумаб (Т) и ингибитор полимеризации микротрубочек (производное мэйтензина (DM1)). Предполагается, что это позволит осуществлять адресную доставку токсина и таким образом снизить системную токсичность, свойственную традиционным цитостатикам. В группе больных, получавших ранее многократные курсы лечения с включением трастузумаба и лапатиниба, применение T-DM1 позволило добиться объективного ответа у 33% пациентов, а контроля над болезнью – у 48%, медиана времени до прогрессирования составила 6,9 мес. [14].
В настоящее время инициировано исследование III фазы, сравнивающее эффективность T-DM1 и комбинации «лапатиниб + капецитабин» при прогрессировании на фоне трастузумаб-содержащей терапии (исследование EMILIA), а также исследование II фазы по изучению эффективности и переносимости комбинации T-DM1 в сочетании с пертузумабом. Планируется изучение T-DM1 в неоадъювантном и адъювантном режимах терапии HER-2(+) РМЖ. Поскольку в механизмы опухолевой прогрессии РМЖ вовлечены не только HER-1 и HER-2, в настоящее время ведется изучение эффективности необратимого пан-HER-тирозинкиназного ингибитора – нератиниба. В отличие от ряда других мультитаргетных тирозинкиназных ингибиторов, нератиниб продемонстрировал эффективность в монотерапии как у больных, ранее не получавших трастузумаб, так и у пациентов с прогрессированием опухоли на фоне терапии трастузумабом [15].
Антиангиогенная терапия
Ангиогенез, т.е. формирование сосудов, рассматривается сегодня как одно из ключевых звеньев формирования опухоли. Ангиогенез – сложный многоступенчатый процесс, который происходит не только в опухолевой, но и в нормальных тканях, в частности при беременности и заживлении ран. Ключевым звеном в этом процессе является сосудистый эндотелиальный фактор роста (VEGF), представляющий собой лиганд рецептора VEGF, который регулирует рост новых кровеносных сосудов. Опухолевые клетки также обладают способностью секретировать VEGF и таким образом стимулировать рост патологических кровеносных сосудов в опухоли. VEGF экспрессируется в большинстве типов опухолей, в том числе и при РМЖ, и рассматривается сегодня как потенциальная мишень противоопухолевой терапии.
Бевацизумаб – пока единственный зарегистрированный при РМЖ препарат антиангиогенной направленности – представляет собой рекомбинантные гиперхимерные моноклональные IgG1 антитела, которые селективно связываются с лигандом и ингибируют биологическую активность VEGF. В исследовании E2100, результаты которого послужили основанием для регистрации препарата при диссеминированном РМЖ, была показана способность бевацизумаба в комбинации с паклитакселом существенно увеличивать частоту объективных эффектов (21,2% в группе лечения паклитакселом и 36,9% в группе лечения бевацизумабом в комбинации с паклитакселом; р < 0,001) и медиану времени до прогрессирования (5,9 мес. и 11,8 мес. при применении паклитаксела и комбинации «бевацизумаб + паклитаксел» соответственно; HR = 0,60; p < 0,001) [16]. Однако ни в этом исследовании, ни в двух последующих (AVADO и RIBBON-1) препарат не влиял на общую выживаемость. Поэтому в последнее время к применению бевацизумаба при РМЖ стали относиться более сдержанно, хотя препарат продолжает изучаться в адъювантной терапии. Более актуальным на сегодняшний день является вопрос о поиске маркеров, которые позволили бы выделить популяцию больных РМЖ, наиболее чувствительных к данному препарату.
Между тем антиангиогенные подходы по-прежнему представляют интерес при лечении некоторых молекулярных подтипов РМЖ, в частности так называемого тройного негативного. При подгрупповом анализе результатов исследования E2100 оказалось, что снижение риска прогрессирования при добавлении бевацизумаба было наиболее выраженным в подгруппах с ER(+)/РgR(+) и ER(-)/РgR(-). Учитывая, что около 90% больных, включенных в исследование, не имели гиперэкспрессии HER-2/neu, группу больных с ER(-)/РgR(-) можно рассматривать как группу с тройным негативным фенотипом [17]. В исследовании R. Greil и соавт. бевацизумаб назначался в неоадъювантном режиме в комбинации с доцетакселом и капецитабином у больных местнораспространенным HER-2-негативным РМЖ. Частота полной морфологической регрессии составила 22% во всей группе и 67% – у больных тройным негативным раком [18]. Роль бевацизумаба положительно оценивается и при HER-2(+) РМЖ (исследования AVEREL, HAX) в комбинации с трастузумабом, а также при гормонозависимом РМЖ: в пилотном исследовании А. Forero-Torres и соавт. комбинация бевацизумаба с летрозолом позволила достичь объективного эффекта у 74% больных операбельным ER(+) РМЖ [19].
Среди других препаратов таргетной направленности, находящихся пока на стадии клинической оценки, в настоящее время большой интерес вызывает группа PARP-ингибиторов, которая в большей степени изучается сейчас при тройном негативном подтипе РМЖ. Биологическое сходство тройного негативного (а точнее, базальноподобного) и BRCA1-ассоцированного РМЖ дает основание для использования аналогичных лечебных подходов, направленных, в частности, на поломки пути BRCA1. Например, известно, что при дефектах репарации ДНК, характерных для BRCA1-ассоциированного рака, более эффективны цитостатики, нарушающие синтез ДНК путем образования межнитевых сшивок, например производные платины. Новым классом препаратов, которые активны при дефектах репарации ДНК, связанных с мутацией BRCA1, являются ингибиторы PARP (поли(АDP-рибоза)полимеразы). PARP активирует восстановление разрывов цепи ДНК, предотвращая ее повреждение в опухолевых клетках, и является возможной терапевтической мишенью при BRCA1-ассоциированном РМЖ. Ингибирование PARP предотвращает активацию ферментов репарации ДНК и приводит к нарушению восстановления разрывов цепи ДНК. В результате накопления таких разрывов происходит арест репликации и формируются разрывы двухцепочечной ДНК, что в итоге ведет к генетической нестабильности и гибели опухолевой клетки. С учетом сходства на молекулярном уровне BRCA-ассоциированного и базальноподобного рака можно предполагать, что последний подтип обладает чувствительностью к ингибиторам PARP, о чем свидетельствуют доклинические исследования.
Обнадеживают результаты первых клинических исследований ингибиторов PARP. Так, в исследовании II фазы изучалась эффективность комбинации гемцитабина и карбоплатина в сочетании с ингибитором PARP инипарибом и без него у 123 больных метастатическим тройным негативным РМЖ. Добавление инипариба к комбинации цитостатиков увеличило частоту объективных эффектов с 32 до 52% (р = 0,02), медиану времени до прогрессирования – с 3,6 до 5,9 мес. (HR = 0,59; р = 0,01) и медиану продолжительности жизни – с 7,7 до 12,3 мес. (HR = 0,57; р = 0,01). Существенных различий в частоте и спектре токсичности не выявлено, основными видами побочных эффектов 3–4-й степени в обеих группах были нейтропения, тромбоцитопения, анемия, слабость/астения, повышение уровня аланинтрансферазы [20, 21].
Заключение
На сегодняшний день метастатический рак молочной железы по-прежнему остается неизлечимым заболеванием. На протяжении почти 30 лет в области лечения диссеминированного РМЖ наблюдалась стагнация. Складывается впечатление, что к настоящему времени цитотоксическая терапия РМЖ достигла предела своей эффективности, и дополнительный прогресс в лечении может быть связан только с применением целевых (таргетных) агентов. Результаты клинических исследований различных таргетных препаратов позволяют надеяться на появление новых высокоэффективных и хорошо переносимых методов лечения РМЖ.
СПРАВКА
Очень интересным представляется опыт использования двух анти-HER-2 препаратов – трастузумаба и лапатиниба, которые при совместном применении могут полностью блокировать еrbB2 сигнальный путь и обеспечить максимальный противоопухолевый эффект в сравнении с монотерапией каждым из препаратов. Бевацизумаб – пока единственный зарегистрированный при РМЖ препарат антиангиогенной направленности – представляет собой рекомбинантные гиперхимерные моноклональные IgG1 антитела, которые селективно связываются с лигандом и ингибируют биологическую активность VEGF.
Среди препаратов таргетной направленности, находящихся пока на стадии клинической оценки, большой интерес вызывает группа PARP-ингибиторов, которая в большей степени изучается сейчас при тройном негативном подтипе РМЖ. Биологическое сходство тройного негативного (а точнее, базальноподобного) и BRCA1-ассоцированного РМЖ дает основание для использования аналогичных лечебных подходов, направленных, в частности,
на поломки пути BRCA1.
umedp.ru
Таргетная терапия рака молочной железы в Израиле | Ассута
Таргетная терапия является одним из методов лечения злокачественных заболеваний груди. Она применяет синтетические или природные вещества с целью поражения, контроля или воздействия на поведение раковых клеток. Таргетную терапию при раке молочной железы назначают:
Индивидуально подбираются препараты, дозы и режимы приема.
Препараты против белка HER2 таргетной терапии при раке молочной железы
 ERBB2 (HER2 или HER2/neu) -это мутировавший ген, который способствует росту злокачественной опухоли. Он является представителем семейства рецепторов эпидермального фактора роста. Данный ген контролирует и стимулирует рост белка, расположенного на поверхности клеток молочной железы. Каждая здоровая клетка содержит 2 копии гена HER2. Иногда в ее составе находится избыточное количество гена, поэтому организм вырабатывает слишком много белка HER2. Такое состояние называется гиперэкспрессией HER2.
ERBB2 (HER2 или HER2/neu) -это мутировавший ген, который способствует росту злокачественной опухоли. Он является представителем семейства рецепторов эпидермального фактора роста. Данный ген контролирует и стимулирует рост белка, расположенного на поверхности клеток молочной железы. Каждая здоровая клетка содержит 2 копии гена HER2. Иногда в ее составе находится избыточное количество гена, поэтому организм вырабатывает слишком много белка HER2. Такое состояние называется гиперэкспрессией HER2.
Трастузумаб (Герцептин)
Трастузумаб специально разработан для связывания дополнительных белков HER2 и остановки роста опухоли у женщин с HER2-положительным раком молочной железы. Препарат также способствует стимуляции работы иммунитета. Его назначают внутривенно или в виде подкожной инъекции. Могут применять в следующих случаях:
- В комбинации с цитостатиками в качестве адъювантного лечения после операции у женщин с высокой степенью риска метастатической опухоли. Его дают в одно время с химиотерапией или после нее. Лечение может быть продолжено в течение года после завершения химиотерапии.
- Используется в качестве монотерапии метастатической опухоли. Прием осуществляется, пока болезнь прогрессирует.
Лечение данным препаратом таргетной терапии при раке молочной железы проводится амбулаторно, как правило, три раза в неделю. Первое вливание занимает 90 минут, последующие дозы порядка 30. Если это инъекции, то от 2 до 5 минут. В течение 2 часов (при первой дозе – 6) пациентка пребывает в клинике.
Если проводиться лечение первичного рака, то трастузумаб принимается на протяжении года, если вторичного, то пока будет держать заболевание под контролем.
К распространенным побочным эффектам относят диарею, тошноту, гриппоподобные симптомы, к реже встречаемым – рвоту, одышку, головную боль, головокружение, проблемы с сердцем.
Пертузумаб (Perjeta ®)
Пертузумаб (Perjeta ®) - еще один препарат, нацеленный на белки HER2. Применяется с трастузумабом и таксанами (доцетаксел) при терапии метастатического HER2-положительного рака груди, а также местно-распространенного, когда опухоль проникла в ткани и лимфатические узлы под грудину, вокруг груди и шеи – не возможности удалить ее хирургическим путем. Его могут назначать пациенткам, которые не получили до этого терапию против белков HER2 или цитостатического лечения. Прием трастузумаба и пертузумаба может продолжаться до тех пор, пока держит под контролем заболевание.
Вводиться внутривенно, как правило, в руку или ногу. Лечение данным средством таргетной терапии при раке молочной железы осуществляется амбулаторно на протяжении 3-х недель. Обычно процесс занимает от 30 до 60 минут или дольше, если дается с другими препаратами.
Среди потенциальных нежелательных последствий приема пертузумаба отмечают утрату аппетита, диарею, тошноту, сыпь на коже, воспаления в полости рта, усталость, фебрильную нейтропению (критическое снижение нейтрофилов), анемию, затрудненное дыхание, сухость или зуд кожи, истончение или выпадение волос.
Трастузумаб эмтанзин (Trastuzumab emtansine)
Трастузумаб эмтанзин (Trastuzumab emtansine) состоит из трастузумаба и эмтанзина (DM1), не так давно разработанных противораковых лекарств. Медикамент вводят внутривенно. Показанием является HER2-положительный РМЖ с метастазами при отсутствии предварительного лечения трастузумабом или таксанами, отдельно или в комплексе.
Лапатиниб (Tykerb)
Lapatinib (Tykerb) – один из группы противоопухолевых препаратов, называемых ингибиторами тирозинкиназы, останавливающий рост и деление клеток. Lapatinib известен как двойной ингибитор киназы, потому что нацелен против HER2 и HER1 рецепторов. Он работает внутри раковых клеток, блокируя сигналы для их роста.
Препарат назначается только пациенткам с высоким уровнем HER2. Согласно статистике, рак молочной железы с HER2-положительным статусом встречается лишь у 20% больных РМЖ.
Его принимают перорально, за час до еды или через час после нее. Лапатиниб может предписываться в комбинации со следующими лекарственными средствами для лечения метастатической опухоли с HER2-положительным статусом:
- Капецитабином (Кселодой) при неэффективности трастузумаба или других видов цитостатиков.
- Летрозолом (Femara) – данная схема назначается пациенткам в период постменопаузы при эстроген-положительной распространенной опухоли с HER2-положительным статусом. Это препарат гормональной терапии.
Поскольку Lapatinib воздействует только на раковые клетки, побочных эффектов меньше, чем после химиотерапии. Их количество увеличивается, если подключают гормональную терапию или лечение цитостатиками. Среди распространенных нежелательных последствий лечения отмечают потерю аппетита, тошноту, диарею, кожные реакции, усталость и слабость, реже возникают проблемы с сердцем или печенью.
Everolimus (Afinitor)
Эверолимус (известен также под маркой Afinitor) принадлежит к группе препаратов, называемых ингибиторами mTOR. Он блокирует белки mTOR, помогая остановить или замедлить онкологический рост. Продолжаются исследования, которые изучают его применение в лечении злокачественных заболеваний груди.
Эверолимус дается в виде таблеток один раз в день, с пищей или без. Его назначают также с экземестаном – ингибитором ароматазы.
Лечение эверолимусом предлагается пациенткам в постменопаузе с ER-положительным (эстроген-рецептор положительным), HER2-отрицательным или вторичным рецидивным раком молочной железы, когда болезнь прогрессировала или возвратилась после приема гормональных препаратов летрозола или анастрозола.
Потенциальные общие побочные эффекты эверолимуса включают усталость, потерю веса, чувство слабости, головную боль, пневмонит, кашель, гипергликемию, тошноту и рвоту, диарею, воспаление в полости рта, изменения вкуса, сыпь, высокий уровень холестерина.
Если прием препарата осуществляется в комплексе с экземестаном, могут добавиться нежелательные последствия данного лекарственного средства.
Колониестимулирующие факторы (КСФ)
Колониестимулирующие факторы (CSFs) используются, чтобы уменьшить некоторые побочные эффекты лечения рака, особенно супрессию костного мозга. Они способствуют его стимуляции, увеличивают производство клеток крови. Это помогает уменьшить риск инфекции, анемии и кровотечения из-за низких показателей крови.
Благодаря данным факторам есть возможность проведения онкологического лечения в более полных дозах, которое при их отсутствии подвергалось бы задержке из-за низких показателей крови. В ряде случаях КСФ обеспечивают высокие дозы химиотерапии или облучения.
При злокачественных опухолях молочной железы колониестимулирующие факторы назначают, чтобы можно было продолжить лечение определенными цитостатическими препаратами. Обычно их применяют в виде инъекций.
Типы колониестимулирующих факторов, которые используются в лечении данного заболевания:
Гранулоцитарные факторы роста стимулируют выработку белых кровяных клеток и снижают риск инфицирования: филграстим (нейпоген), пегфилграстим (Neulasta).
КСФ, содействующие синтезу красных кровяных клеток и применяемые для лечения анемии: эпоэтин (эпрекс, эритропоэтин) и препарат дарбепоэтин (аранесп).
Рассчитать стоимость леченияПобочные действия таргетной терапии
Возможные негативные явления таргетной терапии при раке молочной железы имеют разную степень проявления у разных пациенток, они обусловлены типом назначенных лекарств, дозой и состоянием их здоровья.
Рассмотрим общие побочные эффекты, характерные для большинства препаратов данного вида терапии.
Диарея
Ряд факторов увеличивают вероятность данного явления, в том числе количество и тип принимаемых медикаментов. Побочный эффект усиливает прием комбинации препаратов.
Головная боль
Это один из часто встречаемых нежелательных явлений таргетной терапии при раке молочной железы. Специалисты клиники Ассута рекомендуют анальгетики мягкого действия. При неэффективности медикаментов, либо при появлении головокружения с головной болью обязательна консультация с врачом.
Рвота и тошнота
Отдельные препараты таргетной терапии рака молочной железы вызывают эти явления, в большей степени их комбинации.
Кожная сыпь
Сыпь на коже способны спровоцировать определенные медикаменты. Отмечаются краснота, сухость и зуд.
Поможет избавиться от высыпаний увлажняющий крем, рекомендованный лечащим врачом. Потребуется защита кожи от воздействия ультрафиолетовых лучей. Нужно будет применять солнцезащитный крем, носить шляпы, брюки и рубашки с длинными рукавами.
Усталость и слабость
Это распространенная и временная проблема, возникающая при приеме определенных средств таргетной терапии при раке молочной железы, зачастую обусловлена дозой. В большинстве случаев сопровождается гриппоподобными проявлениями.
Симптомы гриппа
К данным признакам обычно относят лихорадку, озноб, утрату аппетита, рвоту, умеренную боль в некоторых частях тела, тошноту. Они возникают сразу после терапии и снижаются спустя время, когда организм привыкает к препарату. Введение инъекций перед сном и прием других лекарств, таких как ацетаминофен (Тайленол), помогут уменьшить эти побочные действия.
Реакции аллергического характера
Развиваются редко, могут быть реакцией на любое лекарство таргетной терапии при раке молочной железы. Отмечают затрудненное и свистящее дыхание, сыпь на коже, кашель, в тяжелых случаях анафилаксию.
Запор
На появление запора могут повлиять тип медикамента; лекарства, купирующие нарушения роботы ЖКТ; уменьшение количества жидкости в сутки. Возникает в течение трех-семи дней после начала лечения.
Болевые ощущения в мышцах и суставах
Данные признаки часто сопровождаются гриппоподобными симптомами, на их развитие влияет доза препарата. Окажут помощь анальгетики и незатруднительные упражнения.
Утрата аппетита
Причиной этого нежелательного последствия таргетной терапии при раке молочной железы могут быть расстройства пищеварительного тракта, слабость и усталость, скопление токсинов из-за разрушения патологических клеток в организме. Некоторые женщины перестают есть и теряют вес. Важно поддерживать здоровый рацион, поскольку он будет способствовать восстановлению организма.
Воспаления в полости рта
Повышенные дозы медикаментозных средств могут спровоцировать воспалительный процесс в полости рта – стоматит. Есть вероятность развития инфекций и болезненных язв, тщательный и постоянный уход снижает ее. Врачи инструктируют по этому поводу, при необходимости для снижения боли назначают растворы для полоскания и препараты.
Скачки артериального давления
Прием определенных средств таргетной терапии при раке молочной железы может понизить или повысить давление крови. Возникает редко. Во время начала приема важно контролировать давление, медленно подниматься во избежание головокружения.
Повреждение сердца
Трастузумаб (Герцептин), особенно в сочетании с антрациклиновыми препаратами - lapatinib (Tykerb), могут стать причиной нарушений в работе сердечной мышцы, в том числе спровоцировать развитие застойной сердечной недостаточности и аритмии. Прежде чем приступить к лечению, а затем во время его проведения выполняются функциональные тесты - радионуклидная ангиография, эхокардиограмма. Проблемы с сердцем отмечаются лишь у небольшого количества пациенток. При их возникновении могут временно приостановить прием трастузумаба или проведение химиотерапии.
Ущерб, нанесенный трастузумабом, может быть обратим, антрациклиновыми препаратами, как правило, постоянный.
msassuta.com